CORRELATION OF ENZYME CONCENTRATIONS IN LP - AO SYSTEM IN BLOOD SERUM AND RAT LIVER TISSUES
КОРРЕЛЯЦИЯ КОНЦЕНТРАЦИЙ ФЕРМЕНТОВ СИСТЕМЫ ПОЛ-АО В СЫВОРОТКЕ КРОВИ И ТКАНЯХ ПЕЧЕНИ КРЫС
Научная статья
Девяткин А.А.1, Борискин П.В.2, Гуленко О.Н.3, *, Каримова Р.Г.4, Леонов В.В.5, Павлова О.Н.6, Тороповский А.Н.7
1 ORCID: 0000-0001-7506-8040;
3 ORCID: 0000-0001-6338-709;
6 ORCID: 0000-0002-8055-1958;
7 ORCID: 0000-0001-9779-5708;
1, 2, 7 ООО «ТестГен», Ульяновск, Россия;
3, 6 Самарский государственный университет путей сообщения, Самара, Россия;
4 Казанская государственной академия ветеринарной медицины имени Н.Э. Баумана, Казань, Россия;
5 Медицинский университет «Реавиз», Самара, Россия
* Корреспондирующий автор (gulenko_ol[at]mail.ru)
АннотацияОксидативный стресс играет ведущую роль в патогенезе некоторых заболеваний печени, так как способствует усилению образования активных форм кислорода и интенсификации перекисного окисления липидов (ПОЛ). Этот механизм лежит в основе перестройки биологических мембран, регуляции их состава и основных функций, среди которых основой жизнеобеспечения является барьерная функция. Перекисное окисление липидов обеспечивает в организме фаго- и пиноцитоз, а также синтез многих биологически активных соединений, среди которых простагладины, лейкотриены, холестерин, прогестерон. Центральным защитным звеном от экспонентного роста свободных радикалов является система глутатиона, включающая в себя глутатион и ферменты его метаболизма: каталазу, глутатионредуктазу, глутатионтрансферазу, глутатионпероксидазу. Дисбаланс между интенсификацией свободнорадикального окисления, вызываемого активными формами кислорода, и активностью защитной антиоксидантной системы организма приводит к серьезным нарушениям: дезорганизацией клеточных структур, изменениями их функциональной активности. В статье представлено исследование взаимосвязей распределения концентраций ферментов системы ПОЛ-АО в сыворотке крови и тканях печени белых беспородных крыс. С помощью коэффициентов Кендела Тау, Спирмена и гамма корреляции выявлено, что при концентрации СОД, ГП и МДА в организме животных в пределах физиологической нормы достоверно определяется слабая прямая корреляционная связь между активностью этих ферментов в сыворотке крови и тканях печени. При концентрации диеновых конъюгатов (ДК) в организме крыс в пределах физиологической нормы достоверно определяется слабая обратная корреляционная связь между активностью ДК в сыворотке крови и тканях печени.
Ключевые слова: оксидативный стресс, ткани печени, сыворотка крови, каталаза, супероксиддисмутаза, глутатионпероксидаза, глутатионредуктаза, малоновый диальдегид и диеновые конъюгаты.
CORRELATION OF ENZYME CONCENTRATIONS IN LP - AO SYSTEM IN BLOOD SERUM AND RAT LIVER TISSUES
Research article
Devyatkin A.A.1, Boriskin P.V.2, Gulenko O.N. 3, *, Karimova R.G.4, Leonov V.V.5, Pavlova O.N.6, Toropovsky A.N.7
1 ORCID: 0000-0001-7506-8040;
3 ORCID: 0000-0001-6338-709;
6 ORCID: 0000-0002-8055-1958;
7 ORCID: 0000-0001-9779-5708;
1, 2, 7 LLC Testgen, Ulyanovsk, Russia;
3, 6 Samara State Transport University, Russia, Samara;
4 Kazan State Academy of Veterinary Medicine named after N.E. Bauman, Kazan, Russia;
5 Reaviz Medical University, Samara, Russia
* Corresponding author (gulenko_ol[at]mail.ru)
AbstractOxidative stress plays a leading role in the pathogenesis of certain liver diseases since it enhances the formation of reactive oxygen intermediates and the intensification of lipid peroxidation (LP). This mechanism is the basis for the restructuring of biological membranes, the regulation of their composition and basic functions, and the barrier function is the basis of life support. Lipid peroxidation in a body provides phage and pinocytosis, as well as the synthesis of numerous biologically active compounds, including prostaglandins, leukotrienes, cholesterol, progesterone. The glutathione system is the central protective component against the exponential growth of free radicals; it includes glutathione and its metabolic enzymes: catalase, glutathione reductase, glutathione transferase, glutathione peroxidase. The imbalance between the intensification of free radical oxidation caused by reactive oxygen species and the activity of the body's protective antioxidant system leads to serious disturbances: disorganization of cellular structures, changes in their functional activity. This paper presents research on the relationship between the distribution of concentrations of enzymes of the LP – AO system in the blood serum and liver tissues of white outbred rats. Using the Kendel Tau, Spearman, and gamma correlation coefficients, the authors found out that when the concentration of SOD, GP, and MDA in animal bodies are within the physiological norm, a weak direct correlation between the activity of these enzymes in the blood serum and liver tissues can be determined reliably. At a concentration of diene conjugates (DCs) in rats within the physiological norm, a weak inverse correlation between DCs activity in blood serum and liver tissues is determined reliably.
Keywords: oxidative stress, liver tissue, blood serum, catalase, superoxide dismutase, glutathione peroxidase, glutathione reductase, malondialdehyde, and diene conjugates.
ВведениеПечень играет важную роль в обмене веществ и является органом, который выполняет более сорока функций. Она имеет отношение почти ко всем органам и системам в организме. Одной из основных функций печени является барьерная, благодаря которой происходит обезвреживание различных токсических веществ, попадающих в организм. Гарантией возможности выполнения данной функции является структурная организация и функциональное состояние клеточных мембран, а также фосфолипидный состав клеточных мембран. Установлено, что все фосфолипиды в составе мембран выполняет определенные функции, среди которых обеспечение проницаемости мембраны, способность связывать и транспортировать ионы, стимулирование активности мембраносвязанных ферментов и участие в сопряжении электронотранспортных процессов [1], [2].
В патогенезе нарушений функций печени важную роль играет чрезмерная продукция активных форм кислорода (АФК). В целом они необходимы для ряда таких физиологических процессов, как образование ферментов, функционирования иммунной системы организма и активации транскрипционных факторов, участвующих в экспрессии генов. Интенсивная продукция АФК стимулирует образование свободных радикалов и вследствие прооксидантных воздействий, а также несостоятельности антиоксидантной защиты организма развивается окисидативный стресс, сопровождающийся повреждением фосфолипидов мембран и развитием перекисного окисления липидов (ПОЛ) [3].
Известно, что окислительно-восстановительные процессы протекают в организме постоянно, являясь основой биохимического синтеза. Митохондриальный аппарат клеток успешно разлагает 95 % кислорода, поступающего в организм до воды, а 5 % остаются в виде прооксидантов (свободные радикалы). При оптимальном функционировании организма и нормальной активности антиоксидантной защиты свободные радикалы являются жизненно важным элементом метаболизма, так как регулируют состояние мембран, сосудов, участвуют в транспорте электронов в дыхательной цепи, инициируют процессы экспрессии генов и деление клеток, обладают микробицидным действием, активируют процессы белкового синтеза и т.д. [4].
Однако, экзо- и эндогенные неблагоприятные факторы среды усиливают процессы свободно-радикального окисления, инициируя повышенный синтез прооксидантов, которые дестабилизируют механизм антиоксидантной защиты, становясь патогенетическими агентами. В результате развивается оксидативный стресс, являющийся одной из главных причин формирования многих патологических процессов в организме. Центральным защитным звеном от экспонентного роста свободных радикалов является система глутатиона, включающая в себя глутатион и ферменты его метаболизма: каталазу, глутатионредуктазу, глутатионтрансферазу, глутатионпероксидазу [5].
Нарушения процесса синтеза глутатиона приводит к ряду патогенетических состояний атеросклероз, сахарный диабет, неалкогольная жировая болезнь печени, инфаркт миокарда, болезни нервной системы. В частности, существует ряд теорий, связывающих оксидативный стресс и заболевания печени. Так накопление липидов в гепатоцитах нарушает работу митохондрий, стимулируя пероксисомальный и микросомальный пути оксидации при ожирении, а также провоцирует выделение воспалительных цитокинов и, следовательно, развитие воспаления и процессов фиброза [6], [7], [8], [9]. Несмотря на довольно глубокую изученность вопроса патогенеза печени, остается еще много моментов требующих пояснения, а с учетом высокой распространенности подобных заболеваний данная тематика не теряет своей актуальности.
Цель исследования: изучить корреляции распределения концентраций ферментов перекисного окисления липидов – антиоксидантов в сыворотке крови и тканях печени белых беспородных крыс.
Задачи исследования: определить концентрацию каталазы, супероксиддисмутазы (СОД), глутатионпероксидазы (ГП), глутатионредуктазы (ГР), малонового диальдегида (МДА) и диеновых конъюгатов (ДК) в сыворотке крови и тканях печени белых беспородных крыс; выявить взаимосвязи распределения концентраций ферментов системы ПОЛ-АО в сыворотке крови и тканях печени малых экспериментальных животных.
Материалы и методы
Исследование проводили на белых беспородных половозрелых здоровых крысах-самцах шестимесячного месячного возраста, полученных из питомника лабораторных животных «Рапполово», массой 190-210 г в количестве 150 штук, которые содержались в виварии в стандартных условиях.
Все животные были поделены на 5 групп по тридцать крыс в каждой группе. Животные 1 группы – это интактные крысы. Животным 2, 3, 4 и 5 групп наносили в специальном приспособлении-фиксаторе проникающее ранение правого и левого глаз с помощью микролезвия под местной анестезией (2 % раствор новокаина) в области лимба. При этом происходило ранение роговицы, склеры и сосудистого тракта. Животных 2 группы содержали без лечения. Животным 3 группы проводили стандартную терапию механической травмы глаза, которая включала ежедневное введение подкожно дексаметазона фосфата по 0,1 мг/кг массы тела 1 раз в сутки, диклофенака натрия по 0,5 мг/кг 1 раз в сутки, гентамицина сульфата по 1,5 мг/кг 2 раза в сутки. Также в поврежденный глаз проводились инстилляции дексаметазона 4 раза в день и мезатона 2 раза в день (в титровании соответственно весу животного). Данная схема лечения проводилась в течение недели после травмы. Далее в течение месяца продолжались инстилляции раствора дексаметазона по убывающей схеме (по 3, 2, 1 раз в сутки по 2 дня каждый режим) и неванака 4 раза в день (или броксинака 1 раз в день). Животным 4 группы также проводили стандартную терапию травмы глаза, но добавляли внутрибрюшинные инъекции флавоноида кверцетина (ICN, США) в дозе 5 мг/кг массы. Животные 5 группы получали только внутрибрюшинные инъекции кверцетина в дозе 5 мг/кг массы. Терапия механической травмы глаза длилась 14 суток. Во время эксперимента все животные находились на стандартном рационе вивария при свободном доступе к воде и пище. Все группы крыс были вовлечены в эксперимент одновременно, что исключает влияние внешних температурных, климатических и иных факторов на активность изучаемого фермента в контрольной и опытных группах
Согласно методу Королюка М.А. проводили исследование активности каталазы [10]. Активность СОД определяли по методу В.С. Гуревича [11]. Определение активности ГП осуществляли по методу В.М. Мойн. Активность ГР и ДК определяли спектрофотеметрически при длине волны 340 нм и 233 нм соответственно [12]. Концентрацию малонового диальдегида определяли по методу В.В. Рогожина [13].
Концентрации ферментов изучали в тканях печени и сыворотке крови. Для этого крыс убивали методом декапитации под эфирным наркозом в соответствии с этическими нормами, а затем проводили извлечение печени, которую промывали физиологическим раствором и сразу замораживали. Затем из печени готовили гомогенаты путем механического измельчения ткани массой 1 г с 9 мл трис-буфера (рН 7,4), со скоростью 5000 об/мин в сосуде с двойными стенками, постоянно охлаждаемым проточной водой [12].
Исследование выполнено в соответствии с правилами лабораторной практики в Российской Федерации: приказ Минздрава СССР № 755 от 12.08.1977 г.; приказ МЗ РФ № 267 от 19.06.2003 г.; закон «О защите животных от жестокого обращения» гл. V, ст. 104679-ГД от 01.12.1999 г. На проведение эксперимента получено заключение Комитета по биоэтике при «Медицинском университете «Реавиз» № 163 от 29 августа 2019 г.
Полученный массив числовых данных подвергали статистической обработке путем непараметрического корреляционного анализа по Спирмену, а также с использованием коэффициентов гамма корреляции и Кенделла Тау.
Основные результаты
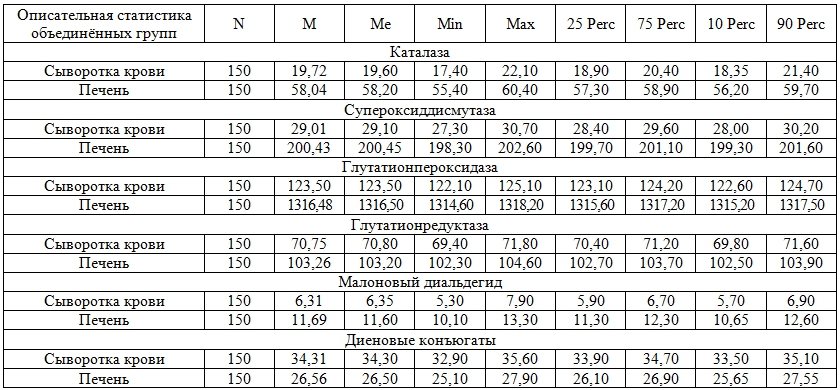
По результатам опыта получен массив числовых концентраций каталазы, СОД, ГП, ГР, МДА и диеновых конъюгатов в сыворотке крови и тканях печени белых беспородных крыс. Эти результаты были подвергнуты статистической обработке с использованием одновыборочного критерия Колмогорова-Смирнова изначально для проверки соответствия концентраций ферментов системы перекисного окисления липидов – антиоксидантов в сыворотке крови и тканях печени крыс нормальному распределению (табл. 1).
Таблица 1 – Распределение значений концентраций ферментов системы ПОЛ-АО в сыворотке крови и тканях печени малых экспериментальных животных
Установлено, что распределение концентрации ферментов системы ПОЛ-АО в сыворотке крови и тканях печени крыс не соответствует нормальному, поэтому для дальнейшей статистической обработки числовых данных нами были применены непараметрические методы анализа.
Для оценки взаимосвязи распределения концентраций ферментов системы ПОЛ-АО в сыворотке крови и тканях печени малых экспериментальных животных проводили исследование корреляций внутри группы наблюдения по непараметрическому коэффициенту корреляции Спирмена (табл. 2), а также с использованием коэффициентов гамма корреляции и Кенделла Тау (табл. 3).
Таблица 2 – Коэффициент корреляции Спирмена по распределению концентрации ферментов системы ПОЛ-АО в сыворотке крови и тканях печени крыс и значение р
| Фермент | Корреляция по Спирмену во всех объединённых измерениях | Valid N | Spearman R | p-level |
| Каталаза | сыворотка крови & печень | 150 | 0,053101 | 0,518689 |
| Супероксиддисмутаза | сыворотка крови & печень | 150 | 0,213389 | 0,008745 |
| Глутатиопероксидаза | сыворотка крови & печень | 150 | 0,166924 | 0,041188 |
| Глутатионредуктаза | сыворотка крови & печень | 150 | 0,083693 | 0,308567 |
| Малоновый диальдегид | сыворотка крови & печень | 150 | 0,181868 | 0,025921 |
| Диеновые конъюгаты | сыворотка крови & печень | 150 | -0,159332 | 0,051469 |
По данным, представленным в таблице 2, очевидно наличие слабой силы достоверной прямой корреляционной связи между активностью СОД в сыворотке крови и тканях печени (Spearman R 0,21 при p ≤ 0,008745); активностью ГП в сыворотке крови и тканях печени (Spearman R = 0,17 при p ≤ 0,041188), а также активностью малонового диальдегида в сыворотке крови и тканях печени (Spearman R 0,18 при p ≤ 0,025921).
Так как никаких взаимосвязей распределения концентраций ферментов системы ПОЛ-АО в сыворотке крови и тканях печени крыс с помощью коэффициента корреляции Спирмена выявлено не было, решено было провести анализ с использованием критериев гамма корреляции и Кенделла Тау (табл. 3).
Таблица 3 – Коэффициенты гамма и Кенделла Тау корреляции по распределению концентрации ферментов системы ПОЛ-АО в сыворотке крови и тканях печени крыс
| Коэффициент гамма корреляции | |||||
| MD pairwise deleted Marked correlations are significant at p <0,05000 | |||||
| Фермент | Корреляция во всех объединённых измерениях | Valid N | Gamma | Z | p-level |
| Каталаза | сыворотка крови & печень | 150 | 0,040228 | 0,70940 | 0,478076 |
| Супероксиддисмутаза | сыворотка крови & печень | 150 | 0,150943 | 2,628770 | 0,008569 |
| Глутатиопероксидаза | сыворотка крови & печень | 150 | 0,129765 | 2,228047 | 0,025877 |
| Глутатионредуктаза | сыворотка крови & печень | 150 | 0,064887 | 1,100367 | 0,271172 |
| Малоновый диальдегид | сыворотка крови & печень | 150 | 0,134463 | 2,306350 | 0,021091 |
| Диеновые конъюгаты | сыворотка крови & печень | 150 | -0,118381 | -2,02668 | 0,042695 |
| Коэффициент Кенделла Тау корреляции | |||||
| MD pairwise deleted Marked correlations are significant at p <,05000 | |||||
| Фермент | Корреляция во всех объединённых измерениях | Valid N | Kendall Tau | Z | p-level |
| Каталаза | сыворотка крови & печень | 150 | 0,039066 | 0,70940 | 0,478076 |
| Супероксиддисмутаза | сыворотка крови & печень | 150 | 0,144763 | 2,628770 | 0,008569 |
| Глутатиопероксидаза | сыворотка крови & печень | 150 | 0,122696 | 2,228047 | 0,025877 |
| Глутатионредуктаза | сыворотка крови & печень | 150 | 0,060596 | 1,100367 | 0,271172 |
| Малоновый диальдегид | сыворотка крови & печень | 150 | 0,127008 | 2,306350 | 0,021091 |
| Диеновые конъюгаты | сыворотка крови & печень | 150 | -0,111607 | -2,02668 | 0,042695 |
По данным, представленным в таблице 3 видно, что при изучении распределения концентрации диеновых конъюгатов в сыворотке крови и тканях печени крыс выявлены прямая достоверная корреляционная связь слабой силы между концентрацией СОД в сыворотке крови и тканях печени (Gamma 0,15 при p ≤ 0,008569; Kendall Tau 0,14 при p ≤ 0,008569); концентрацией ГП в сыворотке крови и тканях печени (Gamma 0,13 при p ≤ 0,025877; Kendall Tau 0,12 при p ≤ 0,025877) и концентрацией МДА в сыворотке крови и тканях печени белых беспородных крыс (Gamma 0,13 при p ≤ 0,021091; Kendall Tau 0,13 при p ≤ 0,021091). Также выявлена обратная достоверная корреляционная связь слабой силы между концентрацией ДК в сыворотке крови и тканях печени белых беспородных крыс (Gamma -0,12 при p ≤ 0,042695; Kendall Tau -0,11 при p ≤ 0,042695).
Заключение
Таким образом, все три примененные способа непараметрического корреляционного анализа для оценки взаимосвязи распределения концентрации ферментов системы ПОЛ-АО в сыворотке крови и тканях печени крыс выявили, что при концентрации СОД, ГП и МДА в организме животных в пределах физиологической нормы достоверно определяется слабая прямая корреляционная связь между активностью этих ферментов в сыворотке крови и тканях печени. При концентрации ДК в организме крыс в пределах физиологической нормы достоверно определяется слабая обратная корреляционная связь между активностью ДК в сыворотке крови и тканях печени.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Павлова О.Н. Реактивные изменения ткани печени крыс в результате нагрузки суспензией биомассы спирулины / О.Н. Павлова, Ю.В. Григорьева, Е.А. Грибанова, Н.Н. Желонкин, С.В. Первушкин, В.В. Зайцев // Актуальные вопросы ветеринарной биологии. – 2013. – Выпуск 2. – С. 51–55.
- Белозерова Л.А. Роль перекисного окисления липидов и системы антиоксидантной защиты в патологии печени и эритроцитов / Л.А. Белозерова, Генинг Т.П.; под. ред. д.б.н., проф. Т.П. Генинг // Система перекисного окисления липидов – антиоксиданты в норме и патологии. – Ульяновск: Вектор-С, – 2008. – С. 113-141.
- Грибанова Е.А. Влияние гумата калия на систему ПОЛ-АО печени цыплят-бройлеров / Е.А. Грибанова, Р.Г. Каримова, О.Н. Павлова // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана: – Казань, – 2015. – Т. 222. – С. 68–72.
- Фархутдинов P.P. Свободнорадикальное окисление: мифы и реальность / P.P. Фархутдинов // Медицинский вестник Башкортостана, – 2006. – С. 146-151
- Павлова О.Н. Природа оксидативного стресса и способы его коррекции / О.Н. Павлова, С.А. Симакова // Медико-физиологические проблемы экологии человека : Материалы IV Всероссийской конференции с международным участием (26–30 сентября 2011 г.). – Ульяновск: УлГУ, – – С. 244–246.
- Променашева Т.Е Роль оксидативного стресса и системы глутатиона в патогенезе неалкогольной жировой болезни печени / Т.Е. Променашева, Л.С. Колесниченко, Н.М. Козлова //БЮЛЛЕТЕНЬ ВСНЦ СО РАМН, – 2014. – 5 (99). – С. 80-83.
- Huang Z.Z. Mechanism and significance of increased glutathione level in human hepatocellular carcinoma and liver regeneration / Z.Z. Huang // FASEB J. – 2001. – Vol. 15, N 1. – Р. 19–21.,
- Montironi R. Expression of pi-class glutathione S-transferase: two populations of high grade prostatic intraepithelial neoplasia with different relations to carcinoma / R. Montironi // Mol. Pathol.– 2000. – Vol.53, N3. – Р.122–128;
- Rolo A.P. Role of oxidative stress in the pathogenesis of nonalcoholic steatohepatitis / A.P. Rolo, J.S. Teodoro, C.M. Palmeira // Free Radic. Biol. Med. – 2012. – Vol. 1, N 1. – Р. 59–69.
- Королюк М.А. Метод определения активности каталазы / М.А. Королюк, Л.И. Иванова, И.Т. Майорова // Лабораторное дело. – 1988. – № 1. – С. 16-19
- Максимович Д.И. Исследование активности антиоксидантных ферментов у крыс с экспериментальным метаболическим синдромом / Д.И. Максимович, Е.О. Корик // ИНТЕРНАУКА. – 2017. – № 12-1 (16). – С. 10-12
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / под общ. ред. Р.У. Хабриева. 2-изд., перераб. и доп. М.: Медицина, – 2005. – 832 с.
- Коробейникова О.Н. Модификация определения продуктов перекисного окисления липидов в реакции с тиобарбитуровой кислотой / О.Н. Коробейникова // Лабораторное дело. – 1989. – № 7. – C. 8–10.
Список литературы на английском языке / References in English
- Pavlova O.N. Reaktivnye izmenenija tkani pecheni krys v rezul'tate nagruzki suspenziej biomassy spiruliny [Reactive changes of rat liver tissue as a result of the spirulina biomass suspension load] / O.N. Pavlova, Y.V. Grigorieva, E.A. Gribanova, N.N. Zhelonkin, S.V. Pervushkin, V.V. Zaitsev // Aktual'nye voprosy veterinarnoj biologii [Actual problems of veterinary biology]. – 2013. – № 2. – P. 51–55. [in Russian]
- Belozerova L.A. Rol' perekisnogo okislenija lipidov i sistemy antioksidantnoj zashhity v patologii pecheni i jeritrocitov [Role of the lipid peroxidation and the antioxidant protection system in the liver and erythrocyte pathology] / L.A. Belozerova, Gening T.P.; pod. red. d.b.n., prof. T.P. Gening // Sistema perekisnogo okislenija lipidov – antioksidanty v norme i patologii [Lipid peroxidation system - antioxidants are normal and pathological]. – Ulyanovsk: Vector-S, – 2008. – P. 113-141. [in Russian]
- Gribanova, E.A. Vlijanie gumata kalija na sistemu POL-AO pecheni cypljat-brojlerov [Potassium humanate influence on the POL-AO system of the chicken broilers liver] / E.A. Gribanova, R.G. Karimova, O.N. Pavlova // Uchenye zapiski Kazanskoj gosudarstvennoj akademii veterinarnoj mediciny im. N.Je. Baumana [Scientific notes of the Kazan state Academy of veterinary medicine named after N. E. Bauman]: – Kazan, – 2015. – Vol. 222. – P. 68-72. [in Russian]
- Farkhutdinov P.P. Svobodnoradikal'noe okislenie: mify i real'nost' [Free radical oxidation: myths and reality] / P.P. Farkhutdinov // Medicinskij vestnik Bashkortostana [Medical bulletin of Bashkortostan], – 2006. – P. 146-151. [in Russian]
- Pavlova O.N. Priroda oksidativnogo stressa i sposoby ego korrekcii [The nature of oxidative stress and ways to correct it]/ O.N. Pavlova, S.A. Simakova // Mediko-fiziologicheskie problemy jekologii cheloveka: Materialy IV Vserossijskoj konferencii s mezhdunarodnym uchastiem (26–30 sentjabrja 2011 g.) [Medico-physiological problems of human ecology: Materials of the IV all-Russian conference with international participation (September 26-30, 2011)]. – Ul'janovsk : UlGU, 2011. – P. 244–246. [in Russian]
- Promenasheva T.E. Rol' oksidativnogo stressa i sistemy glutationa v patogeneze nealkogol'noj zhirovoj bolezni pecheni [The role of oxidative stress and glutathione system in the pathogenesis of non-alcoholic fatty liver disease] / E. Promenasheva, L.S. Kolesnichenko, N.M. Kozlova // BJuLLETEN VSNC SO RAMN [Bulleten VSNC SO RAMN], – 2014. – 5 (99). – P. 80-83. [in Russian]
- Huang Z.Z. Mechanism and significance of increased glutathione level in human hepatocellular carcinoma and liver regeneration / Z.Z. Huang // FASEB J. – 2001. – Vol. 15, N 1. – Р. 19–21.,
- Montironi R. Expression of pi-class glutathione S-transferase: two populations of high grade prostatic intraepithelial neoplasia with different relations to carcinoma / R. Montironi // Mol. Pathol.– 2000. – Vol.53, N3. – Р.122–128;
- Rolo A.P. Role of oxidative stress in the pathogenesis of nonalcoholic steatohepatitis / A.P. Rolo, J.S. Teodoro, C.M. Palmeira // Free Radic. Biol. Med. – 2012. – Vol. 1, N 1. – Р. 59–69.
- Koroljuk M.A. Metod opredelenija aktivnosti katalazy [Method for determining catalase activity] / M.A. Koroljuk, L.I. Ivanova, I.T. Majorova // Lab. delo. [Laboratory work] – 1988.– № 1. – P. 16-19. [in Russian]
- Maximovich D.I. Issledovanie aktivnosti antioksidantnyh fermentov u krys s jeksperimental'nym metabolicheskim sindromom [Investigation of the antioxidant enzymes activity in rats with the experimental metabolic syndrome] // INTERNAUKA [INTERNAUKA]. – 2017. – № 12-1 (16). – P. 10-12. [in Russian]
- Rukovodstvo po jeksperimental'nomu (doklinicheskomu) izucheniju novyh farmakologicheskih veshhestv [Manual for the experimental (preclinical) study of the new pharmacological substances] / pod obshh. red. R.U. Habrieva. 2-izd., pererab. i dop. M.: Medicina, – 2005. – 832 p. [in Russian]
- Korobeinikova O.N. Modifikacija opredelenija produktov perekisnogo okislenija lipidov v reakcii s tiobarbiturovoj kislotoj [Modification of determination of the lipid peroxidation products in reaction with thiobarbiturate acid] / O.N. Korobeinikova // Laboratornoe delo [Laboratory work]. – 1989. – No 7. – P. 8-10 [in Russian]