REVISITED METHODS FOR DETERMINING KINETIC PARAMETERS OF OXIDATIVE REACTIONS ON SURFACE OF Pt CATALYST
К ВОПРОСУ О МЕТОДАХ ОПРЕДЕЛЕНИЯ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ ОКИСЛИТЕЛЬНЫХ РЕАКЦИЙ НА ПОВЕРХНОСТИ Pt КАТАЛИЗАТОРА
Научная статья
Баландина О.А.1, *, Филатова Е.Б.2, Пуринг С.М.3
1ORCID: 0000-0002-2044-8545;
2ORCID: 0000-0001-5498-5595;
1, 2, 3 Самарский государственный технический университет, Самара, Россия
* Корреспондирующий автор (balandinaolya88[at]rambler.ru)
АннотацияРассмотрены реакции взаимодействия оксидов углерода и оксидов азота с атомарным кислородом на поверхности платинового катализатора в температурных диапазонах (300÷1000 К) и (1·104÷3,25 104 К). Представлены кинетические уравнения скорости химических реакций в соответствии с теорией гетерогенного катализа для окислительных реакций, параллельно протекающих на поверхности катализатора. Выполнен сравнительный анализ методов определения кинетических параметров окислительных реакций на поверхности катализатора. Анализ проводился методом сравнения экспериментальных и теоретических исследований динамики изменения концентрации продуктов окислительного процесса на поверхности катализатора от температуры дымовых газов. Определен наиболее рациональный метод определения кинетических параметров реакций окисления и , учитывающий температурный диапазон газового тракта котельных установок. Результаты сравнительного анализа могут быть применены для создания математических моделей, описывающих изменения состава дымовых газов по длине газового тракта и на катализационной поверхности.
Ключевые слова: кинетические параметры, катализатор, константа скорости химической реакции, оксиды углерода, оксиды азота, дымовые газы, температурная зависимость.
REVISITED METHODS FOR DETERMINING KINETIC PARAMETERS OF OXIDATIVE REACTIONS ON SURFACE OF Pt CATALYST
Research article
Balandina O.A.1, *, Filatova E.B.2, Puring S.M.3
1ORCID: 0000-0002-2044-8545;
2ORCID: 0000-0001-5498-5595;
1, 2, 3 Samara State Technical University; Samara, Russia.
* Corresponding author (balandinaolya88[at]rambler.ru)
AbstractThe authors consider reactions of the interaction of carbon oxides and nitrogen oxides with atomic oxygen O(S) on the surface of a platinum catalyst within the temperature ranges of (300 ÷ 1000 K) and (1 104 ÷ 3.25 104 K). The kinetic equations of the chemical reactions rate are presented by the theory of heterogeneous catalysis for oxidative reactions parallel to the surface of the catalyst. Besides, the author conducted a comparative analysis of the methods for determining the kinetic parameters of oxidative reactions on the catalyst surface. This research was carried out by comparing experimental and theoretical studies of the dynamics of changes in the concentration of products of the oxidative process on the surface of the catalyst from the temperature of the flue gases. The most rational method for determining the kinetic parameters of oxidation reactions and considering the temperature range of the gas path of boiler plants is determined as well. The results of the comparative analysis can be used to create mathematical models describing changes in the composition of flue gases along the length of the gas path and on the catalytic surface.
Keywords: kinetic parameters, catalyst, the chemical reaction rate constant, carbon oxides, nitrogen oxides, flue gases, temperature dependence.
По степени воздействия на окружающую среду оксиды азота и углерода относятся к веществам III и IV классов опасности, соответственно, оказывающим негативное влияние на состояние атмосферного воздуха, поверхностных вод, почвы, а также принимающим участие в образовании фотохимического смога [1], [2].
Восстановление оксидов азота и углерода до безвредных для окружающей среды молекулярных форм представляет собой кинетическую задачу, одним из решений которой является установка каталитических систем [3].
Введение
Нанесенные керамические гетерогенные катализаторы на основе соединений успешно применяются в разных отраслях промышленности и энергетики для решения задач снижения уровня вредных выбросов продуктов сгорания газового топлива. Каталитические системы на основе сплавов благородных металлов обладают высокой устойчивостью к каталитическим ядам и перепадам температур по сравнению с оксидными системами переходных металлов [4].
При подборе оптимального места размещения платинового катализатора в газовом такте котельной установки необходимо выполнить расчет, отражающий дискретное изменение концентраций токсичных компонентов дымовых газов по высоте катализационного слоя. Для выполнения такого расчета необходимо разработать математическую модель, учитывающую изменение концентраций оксидов азота и углерода, в зависимости от площади поверхности катализатора. Разработка подобной модели выявляет потребность в знании достоверных значений констант скорости окислительных реакций на поверхности платинового катализатора.
Методы и принципы исследования
Окислительные реакции на Pt катализаторе представляют собой взаимодействие CO и NO с атомарным кислородом на поверхности катализатора O(S) (буква S обозначает поверхность катализатора) [5], [6, с.51-52].
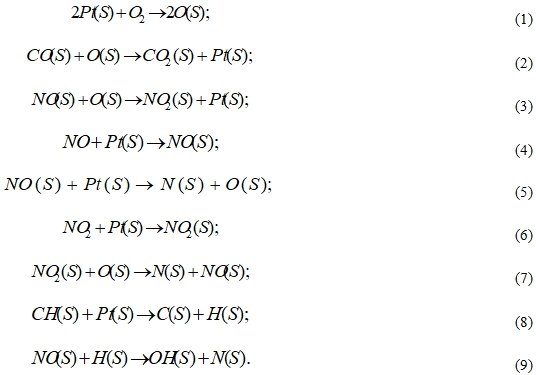
Аппроксимация экспериментальных и теоретических исследований, представленных в публикациях, и отбор данных, удовлетворяющих критериям сходимости, позволили выявить основные методы расчета кинетических скоростей реакций, применимые к разным диапазонам температур.
К термодинамическим задачам преимущественно применим метод микрокинетического моделирования, основанный на детальной кинетической схеме, с разбивкой реакций на стадии. Недостаток данного метода заключается в отсутствии зависимости энергии активации от температуры в уравнении Аррениуса, что приводит к проблеме плохой сходимости значений кинетических параметров с термодинамическими ограничениями [7, с.50].
где k – константа скорости реакции, численно равная наблюдаемой скорости реакции при фиксированной температуре и концентрации 1/c; A ‒ предэкспоненциальный множитель, не зависящий от температуры и определяемый только видом реакции; Tk ‒ температура на поверхности катализатора, K; E ‒ энергия активации реакции показывающая избыток энергии, необходимый для осуществления реакции, ![]() ; R - газовая постоянная [8].
; R - газовая постоянная [8].
Для оценки влияния температуры на скорость химических реакций используется соотношение Аррениуса, отражающее температурную зависимость константы скорости реакции [9]. Механизм окислительных реакций на поверхности платинового катализатора, рассмотренный авторами [10] включает в себя 56 реакций. Для основных из них уравнения реакционной скорости восстановления CO и NO на поверхности катализатора будут иметь вид[5], [10]:
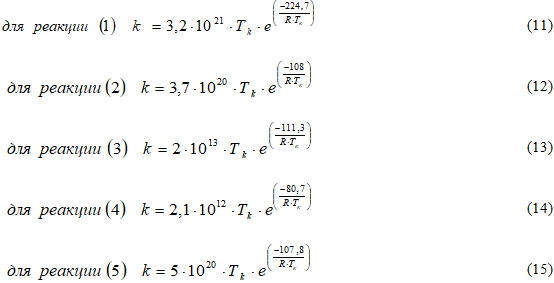
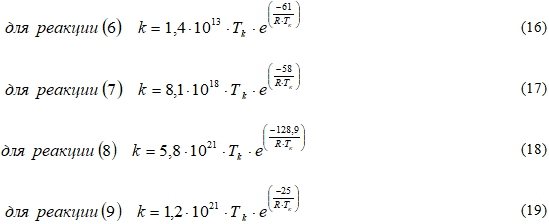
где k – константа скорости реакции, численно равная наблюдаемой скорости реакции при фиксированной температуре и концентрации, 1/c; Tk ‒ температура на поверхности катализатора, K; E ‒ энергия активации реакции, ![]() ; R - газовая постоянная [8].
; R - газовая постоянная [8].
Для сравнительной оценки разных методов определения кинетических параметров окислительных реакций на поверхности Pt катализатора были получены графические и функциональные зависимости изменения скоростей реакций (k) от температуры катализационной поверхности (Tk).
Диаграммы изменения констант скорости окислительных реакций CO и NO на Pt катализаторе в диапазоне температур (300÷1000 К) представлены на рисунках 1, 2.
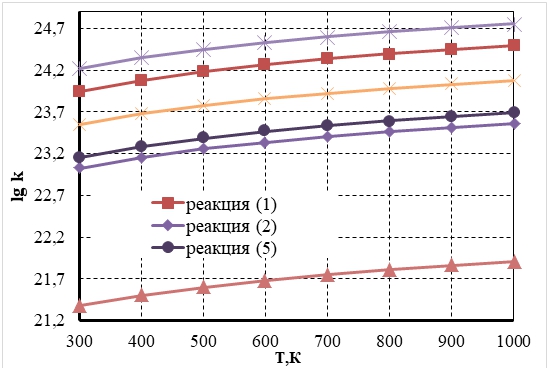
Рис. 1 – Температурная зависимость изменения констант скорости окислительных реакций (1, 2, 5, 7 ÷ 9) на поверхности платинового катализатора, определенная методом микрокинетического моделирования
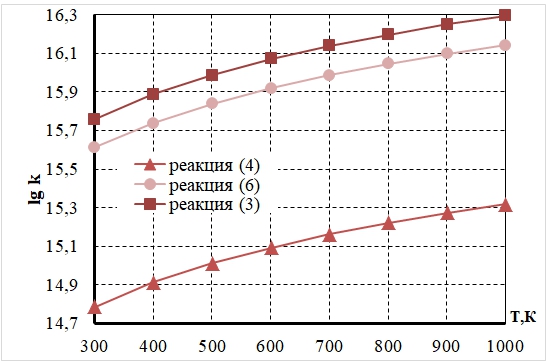
Рис. 2 – Температурная зависимость изменения констант скорости окислительных реакций (3,4,6) на поверхности платинового катализатора, определенная методом микрокинетического моделирования
Авторами [8, с.78] предложена модель уровневых химических реакций, учитывающая эффективность вклада колебательной энергии в энергию активации. Тогда уравнение определения константы скорости диссоциации CO и NO на поверхности катализатора будет иметь вид [11]:
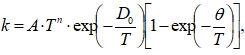 (20)
(20)
где ![]() ‒ авторские коэффициенты для реакций диссоциации в системе атомов
‒ авторские коэффициенты для реакций диссоциации в системе атомов ![]() ;
; ![]() ‒ энергия диссоциации; T ‒ температура дымовых газов, K (при вычислении значений k колебательная температура
‒ энергия диссоциации; T ‒ температура дымовых газов, K (при вычислении значений k колебательная температура ![]() предполагается равной T); θ ‒ характерная колебательная температура колебательно возбужденной диссоциирующей молекулы, K [11].
предполагается равной T); θ ‒ характерная колебательная температура колебательно возбужденной диссоциирующей молекулы, K [11].
Диаграмма изменения констант скорости окислительных реакций CO и NO в термически равновесных условиях на Pt катализаторе в диапазоне температур (1·104÷3,25· 104 К) представлена на рисунке 4.
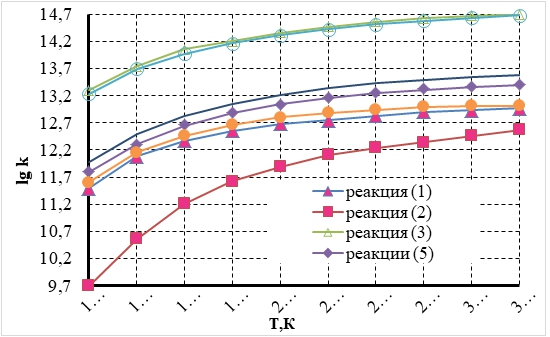
Рис. 3 – Температурная зависимость изменения констант скорости окислительных реакций на поверхности платинового катализатора, учитывающая эффективность вклада колебательной энергии в энергию активации.
Зависимости констант скорости в термически равновесных условиях для окислительных реакций CO и NO на Pt катализаторе при различных температурах дымовых газов описываются уравнениями (21÷27). Кинетические скорости реакций переноса атомов из реакционной смеси к внешней поверхности частиц катализатора (4,6) при описании моделей бимолекулярных химических реакций не рассматривались [12]. Для каждого уравнения определен коэффициент детерминации, характеризующий сходимость кинетических кривых с предложенными логарифмическими зависимостями.

Однако рассмотренные температурные зависимости позволяют определить значение константы скорости реакций только для крайне высоких значений температур. Учитывая, что в газовом тракте котельных установок отсутствуют участки газохода с температурой уходящих газов превышающей 1·104 К, применение модели уровневых химических реакций не является рациональным.
Предыдущие работы авторов [12] с помощью метода геометрической термодинамики позволили определить наиболее рациональный температурный диапазон (898,15÷933,15 К) для установки катализатора в газовом тракте котельной, при котором реакции окисления оксидов азота и углерода идут в прямом направлении, а вероятность протекания побочных реакций сведена к минимуму.
Заключение
Полученные в результате исследования данные позволяют сделать вывод, что для определения кинетических параметров окислительных реакций на поверхности Pt катализатора целесообразно использовать метод микрокинетического моделирования, так как он учитывает температурный диапазон газового тракта котельных установок. Результаты сравнительного анализа могут быть применены для создания математических моделей, описывающих изменения состава дымовых газов по длине газового тракта и на катализационной поверхности.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Grewe, V. Attributing ozone to NOx emissions: Implications for climate mitigation measures / V. Grewe et al // Atmospheric environment. – 2012. – V. 59. – P. 102 – 107.
- Морозов, В.В. Мониторинг атмосферного воздуха с учётом планирования и организации промышленных комплексов города Самары / В.В. Морозов, В.В. Саксонова // Известия Самарского научного центра Российской академии наук. – 2012. – Т. 14. – №. 5 – 3.
- Ertl, G. Handbook of Heterogeneous Catalysis / G. Ertl, H. Knözinger, F. Schüth, J. Weitkamp (Eds.). – 2nd Edition. – Weinheim: Wiley – VCH. – 2008. – 4270 p.
- Мытарева, А. И. Селективное каталитическое восстановление NOx аммиаком на композитных катализаторах : дис. ... канд. хим. наук: 02.00.15.: защищена 17.10.17 : утв. 01.08.17 / Матырева Алина Игоревна. – Москва: ИОХ РАН., 2017.–152 с.
- Koop J., Deutschmann O. Detailed surface reaction mechanism for Pt-catalyzed abatement of automotive exhaust gases //Applied Catalysis B: Environmental. – 2009. – V. 91. – №. 1 – 2. – P. 47 – 58.
- Чернова, Л. Е. К вопросу о механизме окисления монооксида углерода на платиновом катализаторе/ Л.Е. Чернова и др. // Успехи в химии и химической технологии. – 2017. – Т. 31. – №. 8 (189).
- Митричев, И.И. Термодинамические критерии оценки кинетических параметров каталитических реакций / И.И. Митричев, А.В. Женса, Э.М. Кольцова // Журнал физической химии. – 2017. – Т. 91. – №. – С. 49 – 57.
- Лосев, С. А. Кинетика химических реакций в термически неравновесном газе / С.А. Лосев и др. //Математическое моделирование. – 2003. – Т. 15. – №. – С. 72 – 82.
- Литвишков, Ю.Н. О физическом смысле параметров уравнения Аррениуса / Ю.Н. Литвишков // Kimya Problemlеri. – 2019. – №.
- Prasad, V. S. Microkinetic Modelling of NO Reduction on Pt Catalysts / V.S. Prasad, P. Aghalayam // World Academy of Science, Engineering and Technology, International Journal of Chemical, Molecular, Nuclear, Materials and Metallurgical Engineering. – 2016. – V. 10. – №. 11. – P. 1398 – 1404.
- Ковач, Э. А. Каталог моделей физико-химических процессов. Термически равновесные и неравновесные химические реакции / Э.А. Ковач и др. // Физико-химическая кинетика в газовой динамике. – 2010. – Т. 10. – №. – С. 318 – 412.
- Balandina O. A. A study of the effect of air temperature on the possibility and rate of formation of nitrogen oxides in boiler flue gases [Электронный ресурс] – URL: https://iopscience.iop.org/article/10.1088/1757-899X/791/1/012005/pdf,. (accessed 19.06.2020)
Список литературы на английском языке / References in English
- Grewe, V. Attributing ozone to NOx emissions: Implications for climate mitigation measures / V. Grewe et al // Atmospheric environment. – 2012. – V. 59. – P. 102 –107.
- Morozov, V. V. Monitoring atmosfernogo vozduha s uchyotom planirovaniya i organizacii promyshlennyh kompleksov goroda Samary [Monitoring of atmospheric air with regard to planning and organization of industrial complexes in Samara] / V. V. Morozov, V. V. Saxonova // Izvestiya Samarskogo nauchnogo centra Rossijskoj akademii nauk [Proceedings of the Samara scientific center of the Russian Academy of Sciences], 2012, V. 14, №. 5 – 3. [in Russian]
- Ertl, G. Handbook of Heterogeneous Catalysis / G. Ertl, H. Knözinger, F. Schüth, J. Weitkamp (Eds.). – 2nd Edition. – Weinheim: Wiley – VCH. – 2008. – 4270 P.
- Mytareva, A. I. Selektivnoe kataliticheskoe vosstanovlenie NOx ammiakom na kompozitnyh katalizatorah [Selective catalytic reduction of NOx by ammonia on composite catalysts] : dis. ... of PhD in Chemical Sciences: 02.00.15.: protected 17.10.17: approved 01.08.17 / Motyreva Alina Igorevna. – Moscow: IOH RAS., 2017. – 152 p. [in Russian]
- Koop J., Deutschmann O. Detailed surface reaction mechanism for Pt-catalyzed abatement of automotive exhaust gases //Applied Catalysis B: Environmental. – 2009. – V. 91. – №. 1 – 2. – P. 47 – 58.
- Chernova, L. E. K voprosu o mekhanizme okisleniya monooksida ugleroda na platinovom katalizatore [On the question of the mechanism of carbon monoxide oxidation on a platinum catalyst] / L. E. Chernova et al. // Uspekhi v himii i himicheskoj tekhnologii [Advances in chemistry and chemical technology]. – 2017. – V. 31. – №. 8 (189). [in Russian]
- Mitrichev, I. I. Termodinamicheskie kriterii ocenki kineticheskih parametrov kataliticheskih reakcij [Thermodynamic criteria for evaluating the kinetic parameters of catalytic reactions] / I. I. Mitrichev, A.V. Zhensa, E. M. Koltsova // Zhurnal fizicheskoj himii [Journal of physical chemistry]. – 2017. – V. 91. – №. 1. – P. 49 – 57. [in Russian]
- Losev, S. A. Kinetika himicheskih reakcij v termicheski neravnovesnom gaze [Kinetics of chemical reactions in thermally non-equilibrium gas] / S. A. Losev et al. // Matematicheskoe modelirovanie [Mathematical modeling]. – 2003. – V. 15. – №. 6. – P. 72 – 82. [in Russian]
- Litvishkov, Yu. N. O fizicheskom smysle parametrov uravneniya Arreniusa [On the physical meaning of parameters of the Arrhenius equation] / Yu. N. Litvishkov // Kimya Problemleri [Chemical Problems]. – 2019. – №.3.
- Prasad, V. S. Microkinetic Modelling of NO Reduction on Pt Catalysts / V.S. Prasad, P. Aghalayam // World Academy of Science, Engineering and Technology, International Journal of Chemical, Molecular, Nuclear, Materials and Metallurgical Engineering. – 2016. – V. 10. – №. 11. – P. 1398 – 1404
- Kovach, E. A. Katalog modelej fiziko-himicheskih processov. Termicheski ravnovesnye i neravnovesnye himicheskie reakcii [Catalog of models of physical and chemical processes. Thermally equilibrium and non-equilibrium chemical reactions] / E. A. Kovach et al. // Fiziko-himicheskaya kinetika v gazovoj dinamike [Physical and chemical kinetics in gas dynamics]. – 2010. – V. 10. – №. 2. – P. 318 – 412. [in Russian]
- Balandina, O. A. Investigation of the influence of air temperature on the possibility and speed of nitrogen oxides formation in the flue gases of boilers [Electronic resource] – URL: https://iopscience.iop.org/article/10.1088/1757-899X/791/1/012005/pdf,. (accessed 19.06.2020)
