ПОВЫШЕНИЕ КПД ЭЛЕКТРОЛИЗА ЗА СЧЕТ ТЕПЛОТЫ СРЕДЫ
ПОВЫШЕНИЕ КПД ЭЛЕКТРОЛИЗА ЗА СЧЕТ ТЕПЛОТЫ СРЕДЫ
Научная статья
Бузмаков И.В.
Инженер
Аннотация
Рассмотрен механизм использования потенциала Доннана, а также внутренней контактной разности потенциалов, как источников, повышающих КПД электролиза за счет теплоты среды. Описание построено в виде качественного анализа работы электрохимического элемента специальной конструкции.
Ключевые слова: электролиз, полиэлектролит, потенциал Доннана, теплота Пельтье.
Keywords: electrolysis, polyelectrolyte, Donnan potential, Peltier heat.
Часть 1. Некоторые термины и определения
Электродвижущая сила (э.д.с.) это интеграл напряженности поля сторонних сил по участку, содержащему источник тока… Сторонние силы в гальванических элементах действуют на границах между электролитами и электродами. Они действуют также на границе соприкосновения двух разнородных металлов и обусловливают контактную разность потенциалов между ними [5, с. 193, 191]. Сумма скачков потенциалов на всех поверхностях раздела цепи равна разности потенциалов между проводниками, находящимися на концах цепи, и называется электродвижущей силой цепи проводников… Э.д.с. цепи, состоящей только из проводников первого рода, равна скачку потенциала между первым и последним проводниками при непосредственном их соприкосновении (закон Вольта)… Если цепь правильно разомкнута, то э.д.с. этой цепи равна нулю. К правильно разомкнутой цепи проводников, в состав которой входит хотя бы один электролит, закон Вольта неприменим… Очевидно, что только цепи проводников, включающие хотя бы один проводник второго рода, являются электрохимическими элементами (или электрохимическими цепями элементов) [1, с. 490 – 491].
Полиэлектролиты это полимеры, способные диссоциировать в растворе на ионы, при этом в одной макромолекуле возникает большое число периодически повторяющихся зарядов… Сшитые полиэлектролиты (иониты, ионообменные смолы) не растворяются, а только набухают, сохраняя при этом способность к диссоциации [6, с. 320 – 321]. Полиэлектролиты, диссоциирующие на отрицательно заряженные макроионы и ионы H+ называются поликислотами, а диссоциирующие на положительно заряженные макроионы и ионы OH– называются полиоснованиями.
Потенциал Доннана это равновесная разность потенциалов, возникающая на фазовой границе между двумя электролитами в случае, если эта граница проницаема не для всех ионов. Непроницаемость границы для некоторых ионов может быть обусловлена, например, наличием мембраны с очень узкими порами, которые непроходимы для частиц превышающих определенный размер. Избирательная проницаемость межфазной границы возникает и в случае, если какие-то ионы настолько прочно связаны в одной из фаз, что покинуть ее вообще не могут. Именно так ведут себя в ионообменных смолах ионогенные, или ионообменные группы, зафиксированные гомеополярными связями в молекулярной решетке, или матрице. Раствор, находящийся внутри такой матрицы, образует вместе с ней одну фазу; раствор, находящийся вне ее, - вторую [7, с. 77].
Двойной электрический слой (ДЭС) это возникающая на границе раздела фаз совокупность двух противоположно заряженных слоев, расположенных на некотором расстоянии друг от друга [7, с. 96].
Пельтье эффект это выделение или поглощение тепла на контакте двух разнородных проводников в зависимости от направления электрического тока текущего через контакт [2, с. 552].
Часть 2. Анализ механизма повышения КПД электролиза за счет теплоты среды на примере электрохимического элемента специальной конструкции.
Рассмотрим механизм возникновения в цепи электрохимического элемента (далее Элемент), схематически изображенного на рис. 1, дополнительной э.д.с., обусловленной внутренней контактной разностью потенциалов (КРП) и эффектом Доннана (краткое описание сути эффекта Доннана, внутренней КРП и связанной с ней теплоты Пельтье приводится в третьей части статьи).
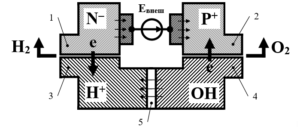
Рис.1
Рис. 1. Схематически представленный электрохимический элемент: 1 – катод, контактирует с раствором 3, на его поверхности протекают электрохимические реакции восстановления катионов электролита, выполнен из химически инертного донорного n-полупроводника. Поверхность, соединяющая катод с внешним источником напряжения, металлизирована; 2 – анод, контактирует с раствором 4, на его поверхности протекают электрохимические реакции окисления анионов электролита, выполнен из химически инертного акцепторного p-полупроводника. Поверхность, соединяющая катод с внешним источником напряжения, металлизирована; 3 – катодное пространство, раствор полиэлектролита, диссоциирующего в воде на отрицательно заряженные макроионы R– и положительно заряженные малые противоионы K+ (в рассматриваемом примере это ионы водорода H+); 4 – анодное пространство, раствор полиэлектролита, диссоциирующего в воде на положительно заряженные макроионы R+ и отрицательно заряженные малые противоионы A– (в рассматриваемом примере это гидроксид-ионы OH–); 5 – мембрана (диафрагма), непроницаемая для макромолекул (макроионов) полиэлектролитов, но полностью проницаемая для малых противоионов K+, A– и молекул воды, разделяет пространства 3 и 4; Евнеш – внешний источник напряжения; стрелки  показывают положительные направления полей ДЭС, образованных внутренней контактной разностью потенциалов; знаки
показывают положительные направления полей ДЭС, образованных внутренней контактной разностью потенциалов; знаки показывают направление движения электронов в месте контакта электродов с раствором.
показывают направление движения электронов в месте контакта электродов с раствором.
Э.д.с. от эффекта Доннана
Для наглядности, электролитом катодного пространства (3, рис. 1) выбран водный раствор поликислоты (R–H+), а электролитом анодного пространства (4, рис. 1) – водный раствор полиоснования (R+OH–). В результате диссоциации поликислоты, в катодном пространстве, вблизи поверхности катода (1, рис. 1), возникает повышенная концентрация H+ ионов. Положительный заряд, возникающий в непосредственной близости от поверхности катода, не скомпенсирован отрицательно заряженными макроионами R–, т.к. они не могут подойти близко к поверхности катода в силу своих размеров и наличию положительно заряженной ионной атмосферы (подробнее см. описание эффекта Доннана в приложении №1 третьей части статьи). Таким образом, граничный слой раствора, непосредственно соприкасающийся с поверхностью катода, имеет положительный заряд. В результате электростатической индукции, на поверхности катода, граничащей с раствором, возникает отрицательный заряд из электронов проводимости. Т.е. на границе раздела между поверхностью катода и раствором возникает ДЭС. Поле этого ДЭС толкает электроны из катода - в раствор.
Аналогично на аноде (2, рис. 1), граничный слой раствора в анодном пространстве (4, рис. 1), непосредственно соприкасающийся с поверхностью анода, имеет отрицательный заряд, а на поверхности анода, граничащей с раствором, возникает положительный заряд. Т.е. на границе раздела между поверхностью анода и раствором также возникает ДЭС. Поле этого ДЭС толкает электроны из раствора - в анод.
Таким образом, мы имеем два источника э.д.с., действующих согласованно, т.е. толкающих отрицательные заряды в контуре против часовой стрелки - это поля ДЭС на границах раздела катода и анода с раствором, поддерживаемые тепловой диффузией ионов раствора.
Диссоциация поликислоты и полиоснования вызывает тепловую диффузию через мембрану (5, рис. 1) ионов H+ из катодного пространства - в анодное, и ионов OH– из анодного пространства - в катодное. Макроионы R+ и R– полиэлектролитов не могут перемещаться через мембрану, поэтому на ней, со стороны катодного пространства, появляется избыточный отрицательный заряд, а со стороны анодного пространства – избыточный положительный заряд, т.е. появляется ДЭС, обусловленный эффектом Доннана. Таким образом, на мембране тоже возникает э.д.с., толкающая отрицательные заряды против часовой стрелки в контуре и поддерживаемая тепловой диффузией ионов раствора.
В рассматриваемом примере напряжение на мембране может достигать 0,83 Вольта, т.к. это соответствует изменению потенциала стандартного водородного электрода от - 0,83 до 0 Вольт при переходе из щелочной среды анодного пространства в кислую среду катодного пространства. Подробнее см. в Приложении №1 третьей части статьи.
Э.д.с. от внутренней КРП
В Элементе э.д.с. возникает, в том числе, в месте контакта полупроводников анода и катода с их металлическими частями, служащими для подключения внешнего источника напряжения. Эта э.д.с. обусловлена внутренней КРП. Внутренняя КРП не создает, в отличие от внешней, поле в пространстве вокруг контактирующих проводников, т.е. не влияет на движение заряженных частиц вне проводников. Конструкция n-полупроводник/металл/p-полупроводник достаточно известна и используется, например, в термоэлектрических модулях Пельтье. Величина э.д.с. такой конструкции при комнатной температуре может достигать величин порядка 0,3 – 0,6 Вольт [5, с. 459; 2, с. 552]. Поля в контактах направлены таким образом, что толкают электроны против часовой стрелки в контуре.
Внутренняя КРП, возникающая за счет диффузии электронов в местах контакта электродов и раствора, толкает электроны по часовой стрелке в контуре. Т.е. при движении электронов в Элементе против часовой стрелки, в этих контактах должна выделяться теплота Пельтье. Но переход электронов из катода в раствор и из раствора в анод (при движении электронов против часовой стрелки) обязательно сопровождается эндотермической реакцией образования водорода и кислорода, поэтому Теплота Пельтье не выделяется в среду, а идет на уменьшение эндотермического эффекта, т.е. как бы «консервируется» в энтальпии образования водорода и кислорода. Подробнее см. в приложении №2 третьей части статьи.
Носители тока (электроны и ионы) движутся в контуре Элемента не по замкнутым траекториям, ни один заряд в Элементе не движется по замкнутому контуру. Каждый электрон, полученный анодом из раствора (в процессе окисления иона OH– до молекулы кислорода) и пройдя по внешней цепи до катода, улетучивается вместе с молекулами водорода (в процессе восстановления ионов H+). Точно также ионы H+ и OH– движутся не по замкнутому контуру, а только до соответствующего электрода, и потом улетучиваются в виде молекул водорода и кислорода. Т.е. и ионы и электроны, двигаясь каждый в своей среде в ускоряющих полях, в конце пути объединяются в молекулы, преобразуя всю запасенную энергию - в энергию химической связи, и выходят из контура !
Все рассмотренные внутренние источники э.д.с. Элемента, снижают затраты внешнего источника на электролиз воды. Таким образом, теплота внешней среды, поглощаемая Элементом в процессе своей работы для поддержания диффузионных ДЭС, идет на уменьшение затрат внешнего источника, т.е. увеличивает КПД электролиза.
Часть 3. Приложения
В этой части дается более подробное обоснование влияния равновесия Доннана, внутренней КРП на стыке металл/полупроводник и теплоты Пельтье на окислительно-восстановительные реакции в Элементе.
Потенциал Доннана (Приложение №1)
Рассмотрим механизм возникновения потенциала Доннана для полиэлектролита. После диссоциации полиэлектролита, его малые противоионы начинают, под действием диффузии, покидать объем, занятый макромолекулой. Направленная диффузия малых противоионов из объема макромолекулы полиэлектролита в растворитель происходит вследствие повышенной их концентрации в объеме макромолекулы по сравнению с остальным раствором. Далее, если, например, малые противоионы заряжены отрицательно, то это приводит к тому, что внутренние части макромолекулы приобретают положительный заряд, а раствор, непосредственно примыкающий к объему макромолекулы – отрицательный. Т.е. вокруг положительно заряженного объема макроиона, возникает как бы «ионная атмосфера» из малых противоионов – заряженная отрицательно. Прекращение роста заряда ионной атмосферы происходит, когда электростатическое поле между ионной атмосферой и объемом макроиона уравновешивает тепловую диффузию малых противоионов. Образовавшаяся в результате равновесная разность потенциалов между ионной атмосферой и макроионом и есть потенциал Доннана. Потенциал Доннана также называют мембранным потенциалом, т.к. аналогичная ситуация возникает на полупроницаемой мембране, например, когда она отделяет раствор электролита, в котором есть ионы двух сортов – способные и не способные проходить через нее, от чистого растворителя.
Потенциал Доннана можно рассматривать как предельный случай диффузионного потенциала, когда подвижность одного из ионов (аниона или катиона) равна нулю. Тогда, согласно [1, с. 535], принимая заряд противоионов равным единице:
|Eд| = (RT/F)Ln(a1/a2), где
Eд – потенциал Доннана;
R – Универсальная газовая постоянная;
T – Термодинамическая температура;
F – Постоянная Фарадея;
a1, a2 – активности противоионов в контактирующих фазах.
Как видим, потенциал Доннана увеличивается прямо пропорционально росту температуры. Для диффузионного гальванического элемента теплота Пельтье является единственным источником для производства полезной работы, поэтому неудивительно, что для таких элементов э.д.с. растет с увеличением температуры. В диффузионных элементах, для производства работы, теплота Пельтье всегда забирается из среды. Т.к. потенциал Доннана является частным случаем диффузионного потенциала, то при протекании тока через ДЭС, сформированный эффектом Доннана, в направлении, совпадающем с положительным направлением поля ДЭС (т.е. когда поле ДЭС совершает положительную работу), из среды поглощается тепло для производства этой работы.
Но в диффузионном элементе происходит непрерывное и однонаправленное изменение концентраций ионов, что в конечном итоге приводит к выравниванию концентраций и остановке направленной диффузии, в отличие от равновесия Доннана, при котором, в случае протекания квазистатических токов, концентрация ионов, однажды достигнув определенного значения, остается неизменной.
Рассмотрим вопрос о том, как влияет мембрана (5, рис. 1) на электродные потенциалы. Потенциал реакции образования кислорода при отсутствии ионов ОН– (1,23 Вольта в кислой среде) отличается на 0,83 Вольта от такого же потенциала при их высокой концентрации (0,4 Вольта в щелочной среде). Аналогично, потенциал реакции образования водорода при отсутствии ионов Н+ (-0,83 Вольта в щелочной среде) отличается от такого же потенциала при их высокой концентрации (0 Вольт в кислой среде), также на 0,83 Вольта [4, с. 66-67]. Т.е. очевидно, что 0,83 Вольта требуется для того, чтобы получить в воде высокую концентрацию соответствующих ионов. Это означает, что 0,83 Вольта требуется для массовой диссоциации нейтральных молекул воды на ионы Н+ и ОН–.
Таким образом, если мембрана поддерживает в катодном пространстве кислую среду, а в анодном щелочную, то напряжение ДЭС такой мембраны может достигать 0,83 Вольта. Такое напряжение обеспечивает высокую проводимость пространства ДЭС мембраны за счет диссоциации воды внутри нее на ионы Н+ и ОН–.
КРП и теплота Пельтье (Приложение №2)
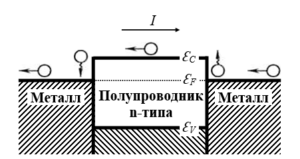
«Причина возникновения Пельтье эффекта заключается в том, что средняя энергия носителей заряда (для определенности электронов), участвующих в электропроводности, в различных проводниках различна … При переходе из одного проводника в другой электроны либо передают избыточную энергию решётке, либо пополняют недостаток энергии за её счёт (в зависимости от направления тока). В первом случае вблизи контакта выделяется, а во втором - поглощается т. н. теплота Пельтье (Рис.3)» [2, с. 552].
Рис. 3. Эффект Пельтье на контакте n-полупроводник/металл: ԐF - уровень Ферми; ԐC - дно зоны проводимости полупроводника; ԐV - потолок валентной зоны; I – положительное направление тока.
Т.к. проводимость n-полупроводника обеспечивают электроны свободной зоны, находящейся выше уровня Ферми, то охлаждаться будет контакт, в котором электроны движутся из металла в n-полупроводник. Контакт металл/p-полупроводник будет охлаждаться, если электроны движутся из p-полупроводника в металл, т. к. проводимость p-полупроводника обеспечивают дырки его валентной зоны, находящейся ниже уровня Ферми. Теплота Пельтье, выделяемая или поглощаемая контактом двух проводников, обусловлена производством отрицательной или положительной работы внутренней КРП.
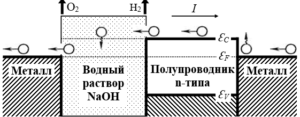
Включим в разрыв левого контакта, на котором происходит выделение теплоты Пельтье (Рис. 3), электролитическую ячейку, например, водный раствор NaOH (Рис.4), а металл и n-полупроводник пусть будут химически инертными.
Рис. 4. Левый контакт металла и n-полупроводника разомкнут, и в этот разрыв помещен раствор электролита.
Т.к., при протекании тока «I», из n-полупроводника в раствор поступают электроны с большей энергией, чем выходят из раствора в металл, то эта избыточная энергия (теплота Пельтье) должна выделиться в ячейке.
Ток через ячейку может идти только в случае протекания в ней электрохимических реакций. Если реакции в ячейке экзотермические, то теплота Пельтье выделяется в ячейке, т.к. больше ей деваться некуда. Если же реакции в ячейке – эндотермические, то теплота Пельтье идет целиком или частично на компенсацию эндотермического эффекта, т.е. на образование продуктов реакций. В нашем примере, суммарная реакция ячейки: 2H2O → 2H2↑ + O2↑ - эндотермическая, поэтому теплота (энергия) Пельтье, идет на создание молекул H2 и O2, образующихся на электродах. Таким образом, получаем, что теплота Пельтье, отобранная у среды в правом контакте n-полупроводник/металл, не выделяется обратно в среду, а сохраняется в виде химической энергии молекул водорода и кислорода. Очевидно, что работа внешнего источника напряжения, затрачиваемая на электролиз воды, в этом случае будет меньше, чем в случае применения одинаковых электродов, не вызывающих возникновения эффекта Пельтье..
Независимо от свойств электродов электролитическая ячейка сама может поглощать или выделять тепло Пельтье при прохождении через нее тока. В квазистатических условиях изменение потенциала Гиббса ячейки [4, с. 60]:
ΔG = ΔH – TΔS, где
ΔH – изменение энтальпии ячейки;
T – Термодинамическая температура;
ΔS – изменение энтропии ячейки;
Q = – TΔS – теплота Пельтье ячейки.
Для водород-кислородного гальванического элемента при T = 298 (К) изменение энтальпии ΔHпр = – 284,5 (кДж/моль) [8, с. 120], изменение потенциала Гиббса [4. с. 60]:
ΔGпр = – zFE = 2*96485*1,23 = – 237,3 (кДж/моль), где
z – количество электронов на одну молекулу;
F – постоянная Фарадея;
E – э.д.с. гальванического элемента.
Следовательно
Qпр = – TΔSпр = ΔGпр – ΔHпр = – 237,3 + 284,5 = 47,2 (кДж/моль) > 0,
т.е. водород-кислородный гальванический элемент выделяет тепло Пельтье в среду, повышая при этом ее энтропию и понижая свою. Тогда в обратном процессе, при электролизе воды, что и происходит в нашем примере, теплота Пельтье Qобр = – Qпр = – 47,3 (кДж/моль) будет поглощаться электролитом из внешней среды.
Обозначим через П – теплоту Пельтье, отобранную у среды в правом контакте n-полупроводник/металл. Теплота П > 0 должна выделиться в ячейке, но т.к. реакция разложения воды в ячейке эндотермическая (ΔH > 0), то теплота Пельтье П идет на компенсацию теплового эффекта реакции:
ΔGобр = (ΔHобр – П) + Qобр (1)
Qобр зависит только от состава электролита, т.к. является характеристикой электролитической ячейки с инертными электродами, а П зависит только от материалов электродов.
Уравнение (1) показывает, что теплота Пельтье П, а также теплота Пельтье Qобр, идут на производство полезной работы. Т.е. теплота Пельтье отобранная у среды уменьшает затраты внешнего источника электроэнергии, необходимые для электролиза. Ситуация, когда теплота среды является источником энергии для производства полезной работы, является характерной для всех диффузионных, а также для многих электрохимических элементов, примеры таких электрохимических элементов приведены в [3, с. 248 – 249].
Список литературы / References
- Герасимов Я. И. Курс физической химии. Учебное пособие: Для вузов. В 2 т. Т.II. – 2-е изд., испр. – М.: ХИМИЯ Москва, 1973. – 624 с.
- Дашевский М. Пельтье эффект. //Физическая энциклопедия. В 5 т. Т. III. Магнитоплазменный – Пойнтинга теорема. /Гл. ред. А. М. Прохоров. Ред. кол. Д. М. Алексеев, А. М. Балдин, А. М. Бонч-Бруевич, А. С. Боровик-Романов и др. – М.: Большая Российская энциклопедия, 1992. – 672 с. – ISBN 5-85270-019-3 (т. 3); ISBN 5-85270-034-7.
- Краснов К. С. Физическая химия. В 2 кн. Кн. 1. Строение вещества. Термодинамика: Учеб. для вузов; К. С. Краснов, Н. К. Воробьев, И. Н. Годнев и др. – 3-е изд., испр. – М.: Высш. шк., 2001. – 512 с. – ISBN 5-06-004025-9.
- Краснов К. С. Физическая химия. В 2 кн. Кн. 2. Электрохимия. Химическая кинетика и катализ: Учеб. для вузов; К. С. Краснов, Н. К. Воробьев, И. Н. Годнев и др. –3-е изд., испр. – М.: Высш. шк., 2001. – 319 с. – ISBN 5-06-004026-7.
- Сивухин Д. В. Общий курс физики. Учебное пособие: Для вузов. В 5 т. Т.III. Электричество. – 4-е изд., стереот. – М.: ФИЗМАТЛИТ; Изд-во МФТИ, 2004. – 656 с. – ISBN 5-9221-0227-3 (т. 3); 5-89155-086-5.
- Тагер А. А. Физико-химия полимеров. – М.: ХИМИЯ Москва, 1968. – 536 с.
- Феттер К. Электрохимическая кинетика, перевод с немецкого языка с дополнениями автора для русского издания под редакцией чл.-кор. АН СССР проф. Колотыркина Я.М. – М.: ХИМИЯ Москва, 1967. – 856 с.
- Эткинс П. Физическая химия. В 2 т. Т.I., перевод с английского языка доктора химических наук Бутина К.П. – М.: МИР Москва, 1980. – 580 с.