BIOCHEMICAL MECHANISMS OF THE TOXIC EFFECT OF FLUORINE ON THE HUMAN BODY
BIOCHEMICAL MECHANISMS OF THE TOXIC EFFECT OF FLUORINE ON THE HUMAN BODY
Abstract
The article presents a literature review, which examines the biochemical mechanisms of the toxic effect of fluorine on the human body. In high concentrations, fluorine acts as a cumulative toxin, which leads to damage to mechanisms of energy support of vital activity processes. Fluorine ions are able to bind to functional groups of amino acid residues in the active centre of enzymes, causing their inhibition. Fluorine compounds disrupt mitochondrial functions, causing a drop in membrane potential, which leads to inhibition of the respiratory chain, suppression of ATP synthesis and increased generation of reactive oxygen species. It was shown on experimental models that oxidative stress is one of the mechanisms of fluorine cytotoxicity. Chronic action of high concentrations of fluorine changes parameters of carbohydrate and lipid metabolism. In fluoride intoxication there are multidirectional changes in the blood content of a number of important hormones — parathormone, thyroid hormone and iodine-containing thyroid hormones. Fluorine compounds affect the level of phospholipids in the membranes of various organs and blood serum. Fluorides induce apoptosis in leukocytes, fibroblasts, alveolocytes and lung epithelial cells.
1. Введение
Фтор издавна известен своей мощной окислительной способностью. Этот элемент поступает в организм человека преимущественно с питьевой водой (в количестве 1–1,2 мг), а также в существенно меньших дозах с пищей, концентрируясь в костях и минерализованных зубных тканях . Важно отметить, что около четверти поступившего фтора задерживается в организме, при этом основная его часть (95%) аккумулируется в костном скелете . Незначительные концентрации фтора играют важную роль в процессах роста и развития организма . Его дефицит может привести к проблемам с фиксацией кальция в костной ткани и нарушению всасывания железа. В условиях недостатка фтора бактерии в полости рта более активно синтезируют лактат из глюкозы. Апатиты, имеющие общую формулу Сa10(PO)4X2, где X — анионы ОH⁻, образующие гидроксиапатит (ГАП) Ca10(PO4)6(OH)2 представляют собой «биологические» минеральные соединения . При этом существует возможность замещения ОH⁻ на F⁻, что приводит к образованию фторапатита (ФАП) - Ca10(PO4)6F2. ФАП содержится в небольших количествах в твердой фазе минерализованных тканей (менее 0,7%). Также присутствуют и другие типы апатитов, прочно связанные с органическим матриксом .
2. Основная часть
Фтор проявляет высокое сродство к белкам зубного матрикса и включается в структуру кристаллов ГАП либо на этапе формирования первичных кристаллов эмали, либо путем замены группы ОН¯ в уже сформированном кристалле . Формирование фторапатита обусловлено близкими ионными радиусами и одинаковым зарядом ионов фтора и гидроксила, а также схожей степенью гидратации. Это приводит к изменению кристаллической структуры. В результате реакции изоморфного замещения формируется смешанный тип апатита Са10(РО4)6(ОН)2-ХFХ. Концентрация этого элемента в зрелой зубной эмали обычно составляет 0,05 моль/кг, что отражается в соотношении групп ОН¯ к фтору в молекуле ГАП, примерно равном 40:1(см. рисунок 1).
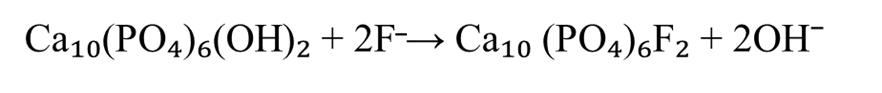
Рисунок 1 - Реакция изоморфного замещения ГАП при небольших концентрациях фтора
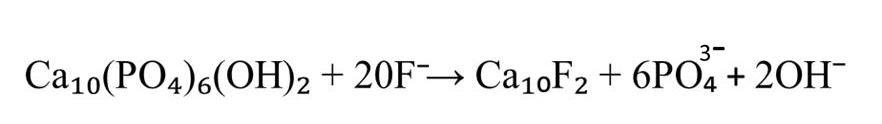
Рисунок 2 - Реакция изоморфного замещения ГАП при избыточном поступлении фторидов
На данный момент научное сообщество выделило пять основных способов, посредством которых неорганические фториды оказывают негативное воздействие на организм человека . В частности, фторсодержащие соединения оказывают влияние на:
1) клеточный метаболизм;
2) проницаемость мембран клеток;
3) окислительно-восстановительный баланс клеток, а также процессы транскрипции и трансляции;
4) различные пути передачи сигналов внутри клеток;
5) механизмы клеточной пролиферации и запрограммированной гибели клеток (апоптоз и некроз) , , .
Многочисленные научные работы демонстрируют, что повышенная концентрация фтора влечёт за собой нарушения в энергетическом обеспечении жизненно важных процессов, что выражается в нарушении работы ферментов . Важно подчеркнуть, что для поддержания стабильного уровня макроэргических соединений, в частности АТФ, необходимо постоянное производство этих молекул в клетках в процессе биологического окисления. Субстратами для этой реакции служат продукты катаболизма, где дегидрирование выступает как экзергонический процесс . Энергия, выделяющаяся при окислении, может рассеиваться в виде тепла или частично использоваться для фосфорилирования АДФ с образованием АТФ .
Экспериментальные данные подтверждают, что фтор является одним из ингибиторов, нарушающих биоэнергетические процессы в тканях . В результате катаболизма глюкозы, являющейся основным источником энергии, образуется пируват, который при участии ферментов пируватдегидрогеназного комплекса преобразуется в ацетил-КоА. В цикле Кребса (ЦТК) в реакцию вступают ацетил-КоА, оксалоацетат и 2-оксоглутарат. В ходе этих превращений формируются изоцитрат, α-кетоглутарат, сукцинат и малат, которые служат субстратами для следующего этапа энергетического обмена — биологического окисления. Снижение концентрации образующихся субстратов и подавление ферментов ЦТК, приводящее к снижению производства АТФ, нарушает энергообеспечение клеток (см. рисунок 3).
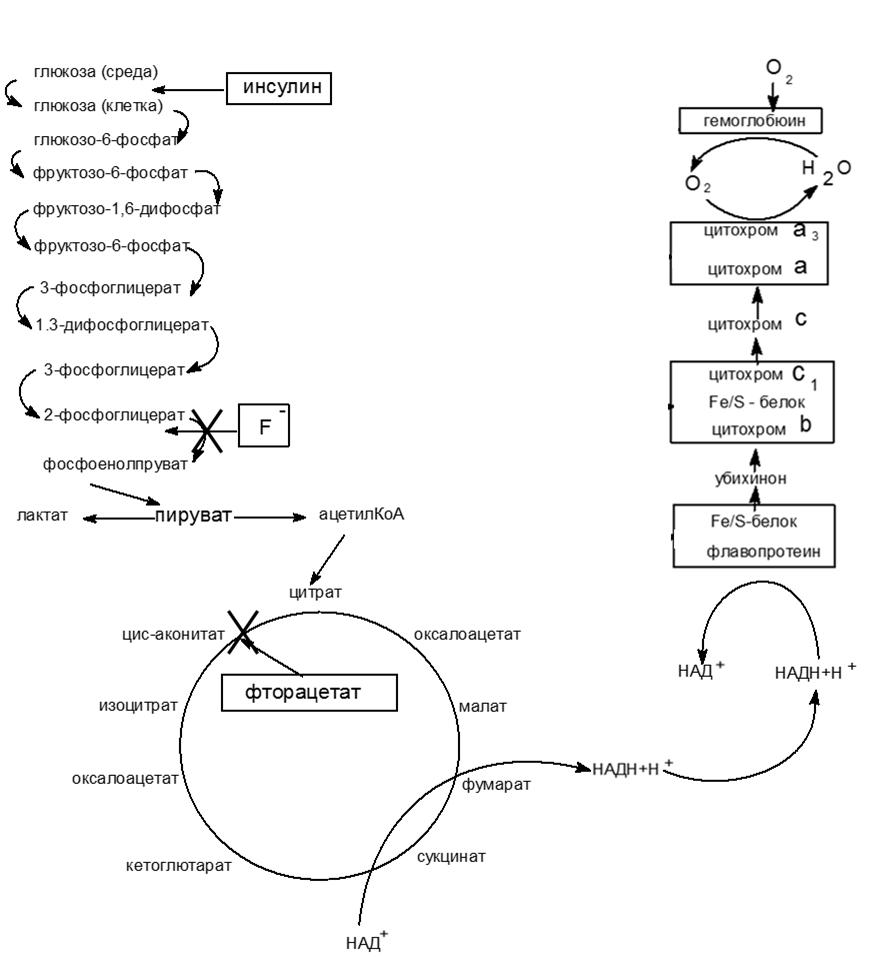
Рисунок 3 - Влияние фтора на основные процессы биоэнергетики
Подводя итог вышесказанному, можно отметить, что, экспериментальные данные убедительно свидетельствуют о негативном влиянии фтора на ключевые процессы клеточной энергетики. Подавляя цикл Кребса, этот элемент нарушает нормальное производство АТФ — главного энергетического «топлива» клеток, что, в свою очередь, приводит к сбоям в их функционировании и может иметь серьезные последствия для здоровья. Понимание механизмов его влияния на биоэнергетические процессы необходимо для разработки эффективных стратегий профилактики и снижения негативных последствий, связанных с воздействием этого элемента. Будущие исследования должны быть направлены на более глубокое изучение метаболизма фтора и его взаимодействия с ферментами цикла Кребса, а также на поиск путей нейтрализации его токсического воздействия на клеточный энергетический обмен.
Современные исследования показывают, что фторсодержащие вещества обладают высокой аффинностью к некоторым ионам металлов, выступающим в роли кофакторов ферментов, участвующих в основных метаболических путях . Механизмы воздействия фтора зависят от его концентрации и типа фермента, вследствие чего фтор может подавлять активность ферментов (например, миллимолярные концентрации ингибируют фосфатазы) или, в некоторых случаях, стимулировать их активность . Установлено, что ионы фтора способны связываться с функциональными группами аминокислотных остатков (треонин, валин, лейцин) в активном центре ферментов, что приводит к их ингибированию, например, активности Na+, K+-АТФазы, что ведет к уменьшению уровня АТФ в клетке и нарушению мембранного потенциала .
На основании вышеизложенного следует подчеркнуть, что влияние фторсодержащих веществ на ферментативные процессы – это сложный и многогранный феномен. От концентрации фтора и специфики фермента зависит, будет ли он стимулировать или подавлять активность фермента. Это обусловлено его способностью взаимодействовать с ионами металлов — кофакторами ферментов и функциональными группами аминокислотных остатков в активном центре.
В результате, воздействие фтора на ключевые ферменты, такие как Na+, K+-АТФаза, приводит к каскаду нарушений в клеточном метаболизме, включая снижение уровня АТФ и изменение мембранного потенциала.
Продолжительное воздействие повышенных концентраций фторидов негативно влияет на метаболизм углеводов и липидов . Исследования на грызунах демонстрируют, что уже к четвертой неделе отравления фтором развивается гипергликемия. В бета-клетках поджелудочной железы этих животных отмечается снижение уровня мРНК, кодирующей инсулин. Фторид-ионы также угнетают пентозофосфатный путь, в частности, фермент глюкозо-6-фосфатдегидрогеназу , .
В заключение следует отметить, что, накопление фторидов в организме оказывает глубокое и многогранное воздействие на ключевые метаболические процессы. Нарушение углеводного и липидного обмена, вызванное фторидной интоксикацией, представляет собой серьезную угрозу для здоровья.
Соединения фтора оказывают деструктивное воздействие на митохондрии, вызывая снижение мембранного потенциала и формирование гигантской поры на внешней мембране . Открытие этой поры приводит к набуханию митохондриального матрикса, разрыву внешней мембраны и высвобождению цитохрома С из межмембранного пространства. Утрата цитохрома С митохондриями нарушает работу дыхательной цепи, подавляет синтез АТФ и стимулирует образование активных форм кислорода (АФК). Более того, нарушение барьерной функции митохондриальных мембран под влиянием ионов фтора способствует развитию апоптоза , .
Окислительный стресс является одним из ключевых механизмов цитотоксичности фтора, что подтверждается результатами различных экспериментальных исследований. Фтор действует как прооксидант, стимулируя генерацию супероксидного аниона, пероксида водорода, гидроксильного радикала и оксида азота (NO) в клетках , . Фтористые соединения подавляют активность антиоксидантных ферментов, таких как супероксиддисмутаза (СОД), каталаза и глутатионпероксидаза . Дисбаланс между прооксидантами и антиоксидантами приводит к активации свободно-радикальных процессов и повреждению мембранных структур клеток различных органов и тканей . Интоксикация высокими дозами фтора подтверждается повышенной активностью глутатионтрансферазы и снижением активности глутатионредуктазы в слюне пациентов с флюорозом. Снижение активности глутатионредуктазы при фтористой интоксикации может указывать на угнетение пентозофосфатного пути и, как следствие, анаболических процессов .
Таким образом, воздействие фторидов на митохондрии и антиоксидантную систему клетки представляет собой сложный и многогранный процесс, приводящий к серьезным нарушениям клеточного метаболизма и развитию цитотоксичности. Фтор, нарушая целостность митохондрий и стимулируя окислительный стресс, запускает каскад патологических реакций, в конечном итоге приводящих к апоптозу и повреждению тканей. Полученные данные подчеркивают важность дальнейшего изучения механизмов токсического действия фтора и разработки эффективных стратегий для защиты клеток от его негативного воздействия. Будущие исследования должны быть направлены на поиск антиоксидантных соединений и митопротекторов, способных смягчить или предотвратить разрушительные эффекты фтора на клеточном уровне.
Известно, что воздействие фторидов уменьшает транспорт ионов кальция (Са2+) через эндоплазматический ретикулум и плазматические мембраны клеток почек, а также в саркоплазматическом ретикулуме кардиомиоцитов, что связано со снижением концентрации белков-переносчиков Са2+ и ингибированием Са2+ насосов . В нервных клетках фтор подавляет активность фосфолипазы С, снижая образование диацилглицерола (ДАГ), вторичного мессенджера, и поступление Са2+ в клетку. Однако в цитозоле других тканей (эритроциты, остеобласты, проксимальные канальцы, фибробласты, эндотелиальные клетки) отравление фтором вызывает увеличение концентрации Са2+ . Доказано, что фтористые соединения ингибируют ферменты, регулирующие фосфорно-кальциевый обмен, в частности, снижают активность 1α-гидроксилазы в проксимальных канальцах, что приводит к уменьшению продукции и концентрации 1,25(ОН)2D3-кальцитриола в сыворотке крови. Следует обратить внимание на то, что в настоящее время науке известно порядка 80 белков, участвующих в ключевых метаболических процессах организма, чья активность подвержена обратимым изменениям под воздействием фторид-ионов.
Нарушение транспорта ионов кальция, ингибирование ключевых ферментов, регулирующих фосфорно-кальциевый обмен, а также изменение концентрации вторичных мессенджеров — все это свидетельствует о потенциальном токсическом воздействии фторидов на клеточные функции. Понимание механизмов, посредством которых фториды вмешиваются в регуляцию кальциевого гомеостаза, имеет решающее значение для разработки эффективных стратегий профилактики и лечения фторидной интоксикации.
Важно подчеркнуть, что при интоксикации фтором наблюдаются разнонаправленные колебания концентрации ряда важных гормонов в крови . Эти фазовые изменения гормонального фона отражают компенсаторные механизмы организма, активизирующиеся в ответ на пролонгированное воздействие фторсодержащих соединений . В частности, высокие концентрации фтора стимулируют секрецию паратгормона (ПТГ), что подтверждается экспериментальными данными, демонстрирующими превышение контрольных значений уровня этого гормона в крови подопытных крыс в 5 раз . Доказано, что повышенный уровень ПТГ, увеличивая приток ионов кальция в клетки, способствует разобщению окислительного фосфорилирования, снижению синтеза АТФ и оказывает негативное влияние на метаболизм липидов и углеводов .
Результаты исследований свидетельствуют о том, что длительное воздействие фтора вызывает изменения в концентрации тиреотропного гормона (ТТГ) и йодсодержащих гормонов щитовидной железы — трийодтиронина (Т3) и тироксина (Т4) в крови , . При этом динамика уровня этих гормонов определяется продолжительностью воздействия повреждающего фактора. На начальной стадии наблюдается увеличение уровня как ТТГ, так и Т4, при одновременном снижении концентрации Т3. Затем уровень ТТГ и гормонов щитовидной железы возвращается к исходным значениям, а при дальнейшем воздействии повреждающего фактора наступает фаза угнетения, характеризующаяся снижением уровня ТТГ, Т4 и Т3. Известно, что гормоны щитовидной железы играют ключевую роль в регуляции окислительно-восстановительных процессов и основного обмена, обеспечивая более интенсивное функционирование организма в условиях стресса , .
При профессиональном воздействии фтора, когда рабочие электролизных цехов вдыхают около 10 мг фтора за смену, его влияние на организм существенно сильнее (примерно в 30 раз), чем при поступлении фтора с питьевой водой. В связи с этим было проведено исследование состояния здоровья работников алюминиевого завода, занятых в электролизном производстве, с учетом их стажа работы. Данные из научной литературы о влиянии производственных условий на функцию щитовидной железы, оцениваемую по способности поглощать йод, указывают на ее пониженную активность. В то же время, клинические исследования демонстрируют, напротив, повышенную функцию железы, которая усиливается с увеличением рабочего стажа.
При этом было замечено снижение уровня трийодтиронина (Т3) на ранних этапах интоксикации фтором, при нормальном уровне тиреотропного гормона (ТТГ). При продолжительном контакте с фтором наблюдается ослабление тиреотропной функции гипофиза. Следовательно, представления о состоянии щитовидной железы при длительном воздействии фторидов на производстве остаются противоречивыми и основаны на ограниченном количестве наблюдений. Исследование тиреоидного статуса у рабочих электролизных цехов, учитывающее продолжительность контакта с фторидами и стадию заболевания, выявило специфические особенности функционирования щитовидной железы, не проявляющиеся в виде явных симптомов гипо- или гипертиреоза. Снижение способности щитовидной железы поглощать йод, прогрессирующее с увеличением рабочего стажа и стадии заболевания, выражено умеренно и не приводит к нарушениям в процессе образования и выделения тиреоидных гормонов, что подтверждается стабильным уровнем Т4. Снижение концентрации Т3, усугубляющееся с увеличением стажа и стадии флюороза, является достаточно значительным и соответствует картине гипотиреоза. Вероятно, синдром низкого уровня Т3 связан с воздействием фтора на преобразование Т4 в Т3 на периферии, в тканях-мишенях, хотя этот эффект может быть опосредован нарушением функции других эндокринных желез. В частности, снижение уровня андрогенов при хронической интоксикации фтором, которое активно изучалось в последние годы, может вызывать сопутствующие изменения в работе щитовидной железы , .
Не исключено, что синдром низкого уровня Т3 связан с поражением печени, которое часто встречается при флюорозе. Наиболее часто (75,6%) синдром низкого уровня Т3 наблюдался у рабочих с начальными проявлениями профессионального заболевания. Это указывает на важную роль печени в процессе дейодирования Т4, который преимущественно происходит в клетках печени. Вероятно, печень играет ключевую роль в развитии синдрома низкого уровня Т3. Синдром низкого уровня Т3, который наблюдается при различных острых и хронических заболеваниях, а также в условиях метаболического стресса, таких как голодание и недостаточное питание, возможно, способствует снижению скорости обмена веществ с целью сохранения энергии.
Как показали проведённые исследования, фтор-индуцированная интоксикация представляет собой сложный процесс, затрагивающий ключевые гормональные системы организма. Разнонаправленные колебания концентраций паратгормона, тиреотропного гормона и йодсодержащих гормонов щитовидной железы отражают многоступенчатый адаптационный ответ на хроническое воздействие фторсодержащих соединений.
Важно отметить, что нарушение гормонального баланса, вызванное фтором, может иметь далеко идущие последствия для метаболизма липидов, углеводов и энергетического обмена в целом. Понимание взаимосвязи между интоксикацией фтором и гормональным дисбалансом открывает новые перспективы для разработки терапевтических подходов, направленных на восстановление гормонального гомеостаза и минимизацию негативных последствий воздействия фтора на организм.
Анализ полученных данных позволил установить влияние соединений фтора на концентрацию фосфолипидов в мембранах различных органов и сыворотке крови . Интоксикация фторидами также сопровождается изменением соотношения насыщенных и полиненасыщенных жирных кислот в липидах эритроцитов и гепатоцитов, с преобладанием повышенным количеством миристиновой, олеиновой, линолевой кислот и достоверным снижением уровня арахидоновой кислоты . Важно отметить, что изменения в составе жирных кислот происходят на фоне повышенной активности фосфолипазы А2, что указывает на потенциальные нарушения в синтезе эйкозаноидов, таких как простагландины, простациклины, тромбоксаны и лейкотриены .
Таким образом, полученные данные убедительно демонстрируют, что соединения фтора оказывают выраженное воздействие на липидный состав биологических мембран и сыворотки крови. Изменения в концентрации фосфолипидов и соотношении жирных кислот, вызванные фторидной интоксикацией, свидетельствуют о серьезных нарушениях в метаболизме липидов.
При этом повышенная активность фосфолипазы А2 на фоне измененного жирнокислотного профиля указывает на потенциальный сбой в синтезе эйкозаноидов – ключевых регуляторов воспаления, иммунитета и гемостаза.
Известно, что высокие концентрации фтора индуцируют некроз гепатоцитов и тимоцитов, в патогенезе которого участвуют активные формы кислорода (АФК) и повышение уровня внутриклеточного кальция . Фториды являются индукторами апоптоза в лейкоцитах, фибробластах, альвеолоцитах и эпителиальных клетках легкого . Механизмы апоптоза, индуцированного фтором, включают:
1) увеличение уровня АФК и активацию свободно-радикального окисления ;
2) повреждение митохондрий и активацию митохондриального пути апоптоза ;
3) повышение уровня внутриклеточного кальция и увеличение числа клеток, экспрессирующих маркер апоптоза – аннексин V ;
4) активацию каспазного каскада — каспаз 3, 8 и 9 ;
5) изменение активности внутриклеточных сигнальных путей — повышение активности протеинкиназы С, MAPK , .
3. Заключение
В заключение, анализ многочисленных исследований показывает, что фтор, являясь высокотоксичным веществом, способен вызывать острые нарушения энергетического обмена посредством взаимодействия с различными биохимическими компонентами организма, начиная с транспорта кислорода и заканчивая синтезом макроэргических соединений. Любые нарушения в энергообеспечении клетки приводят к серьезным последствиям, вплоть до гибели биологической структуры. Фторсодержащие соединения выступают в роли цитотоксического фактора, влияющего на метаболизм, модулирующего пути внутриклеточной сигнализации и активирующего программируемую клеточную гибель.
Подводя итог вышесказанному, можно заключить, что механизмы физиологического или токсического воздействия фторсодержащих соединений на организм определяются их концентрацией и длительностью воздействия. Кроме того, повреждающее действие фтора может быть связано с его генотоксическими свойствами — способностью подавлять синтез внутриклеточных защитных белков и антиоксидантных ферментов.
