LIPID PEROXIDATION IN RAT BLOOD SERUM AGAINST HEMIC HYPOXIA UNDER ANTIHYPOXANT TREATMENT
LIPID PEROXIDATION IN RAT BLOOD SERUM AGAINST HEMIC HYPOXIA UNDER ANTIHYPOXANT TREATMENT
Abstract
Hypoxia is a typical pathological process characterised by a decrease in oxygen content in blood and tissues, development of a complex of secondary non-specific metabolic and functional disorders, and adaptation reaction. An important pathogenetic mechanism of hypoxic states development is activation of lipid peroxidation processes and decreased activity of antioxidant defence enzymes, which leads to disruption of cell membrane structure and lipid metabolism, and, as a consequence, toxic effect of metabolites formed in the organism on tissues. The multiplicity of pathophysiological changes in the organism under hypoxia requires the search for effective antihypoxants. Promising antihypoxants are extracts of blackcurrant and medicinal raspberry, as these extracts have a wide range of bioflavonoids, alkaloids and other biologically active substances. The aim of the study was to examine the features of lipid peroxidation in the blood serum of rats against hemic hypoxia with the use of antihypoxants. The study was carried out on 180 white mongrel rats. The animals were divided equally into 6 groups. According to group affiliation, the animals received intragastrically extracts of blackcurrant, medicinal raspberry, a mixture of these extracts in the ratio of 1:1 and cytochrome C, which was administered intramuscularly, for 15 days. A model of hemic hypoxia was used. The activity of catalase, SOD, GP and GR, as well as the concentrations of MDA and diene conjugates were studied in rat blood serum by standard methods and the antioxidant-prooxidant index and local antioxidant index were calculated on the basis of the obtained data. It was found that acute hypoxia leads to activation of peroxidation in tissues, which is reflected by disturbances of oxidative homeostasis leading to depletion of antioxidant defences of the organism and metabolic disorders, which is confirmed in experiments on lipid metabolism. The use of antihypoxants against hypoxia allows to normalise oxidative homeostasis most effectively and the most pronounced positive effect is observed when using a mixture of plant extracts in the ratio 1:1, which is confirmed by stabilisation of concentrations and activities of enzymes of the lipid peroxidation system.
1. Введение
Гипоксия – типовой патологический процесс, характеризующийся снижением содержания кислорода в крови и тканях, развитием комплекса вторичных неспецифических метаболических и функциональных расстройств, а также реакцией адаптации , .
Важным патогенетическим механизмом развития гипоксических состояний служит активация процессов перекисного окисления липидов и снижение активности ферментов антиоксидантной защиты. Все это приводит к нарушению структуры клеточных мембран и липидного обмена, и, как следствие, токсическому действию образующихся в организме метаболитов на ткани , .
При гипоксии интенсивность окисления субстратов цикла Кребса в митохондриях снижена, поэтому в тканях возрастает концентрация восстановленного никотинамидадениндинуклеотидфосфата и восстановленного никотинамидадениндинуклеотида, что увеличивает одноэлектронное восстановление кислорода. И поэтому в организме возникает парадоксальная ситуация, состоящая в том, что снижение концентрации кислорода приводит к увеличению количества кислородных радикалов и других активных форм кислорода , .
Также оксидантный стресс, повреждая наружную мембрану митохондрий, может являться причиной их дисфункции, с другой стороны – именно в поврежденных митохондриях с нарушенной АТФ-синтетической способностью происходит активация продукции активных форм кислорода и формируется «порочный круг» взаимоусиления оксидантного и гипоксического повреждения клеток .
Множественность патофизиологических изменений в организме при гипоксии требует поиска эффективных антигипоксантов , .
Перспективными антигипоксантами являются экстракты смородины черной и малины лекарственной, так как эти экстракты обладают широким спектром биофлавоноидов, алкалоидов, микроэлементов и других биологически активных веществ. Проявление ими антигипоксического эффекта осуществляется за счет усиления процесса отдачи кислорода тканям посредством снижения сродства гемоглобина кислороду; путем предупреждения разобщения окисления и фосфорилирования за счет мембранопротекторного действия; посредством повышения эффективности цикла трикарбоновых кислот и шунтирования зон гипоксической блокады транспорта электронов в дыхательной цепи с помощью искусственных переносчиков электронов и восстановления фонда окисленных коферментов .
Цель исследования – изучить особенности перекисного окисления липидов в сыворотке крови крыс на фоне гемической гипоксии при применении антигипоксантов.
2. Методы и принципы исследования
Исследования произведены на 180 белых беспородных крысах, массой 240-260 г. Животные были разделены поровну на 6 групп. Одна группа – интактные крысы (нулевая группа). Животные 1 группы получали в течение недели до моделирования гипоксии экстракт смородины черной в дозе 100 мг/кг массы; животные 2 группы получали в аналогичный период и в той же дозе экстракт малины лекарственной; животные 3 группы – цитохром С (в качестве эталонного антигипоксанта) в рекомендуемой дозе; животные 4 группы – получали смесь экстрактов смородины черной и малины лекарственной в соотношении 1:1 в дозе 200 мг/кг массы, а животные 5 группы – контроль, получавшие дистиллированную воду по аналогичной схеме в эквивалентном объеме. Антигипосакнты вводили в течение 15 дней внутрижелудочно до моделирования гипоксии .
Цитохром С разводили физиологическим раствором и вводили крысам внутримышечно также в течение 15 суток в дозе 0,1 мг/кг живой массы активного вещества.
Антигипоксическое действие растительных экстрактов исследовали на модели гемической гипоксии, которую воспроизводили путем однократного внутрибрюшинного введения нитрита натрия в дозе DL100 (200 мг/кг) .
Активность каталазы, СОД, ГП и ГР, а также концентрации МДА и диеновых конъюгатов (ДК) изучали в сыворотке крови крыс стандартными методами с использованием тестовых наборов фирмы BSBE (Китай) .
Для интегральной оценки окислительного гомеостаза у крыс использовали коэффициенты оксидативного стресса: антиоксидантно-прооксидантный индекс (АПИ), который выражает соотношение активности каталазы к концентрации МДА и локальный антиоксидантный индекс (ЛАИ), являющийся отношением произведения активностей каталазы и СОД к концентрации МДА
.Цифровой материал экспериментов подвергали статистической обработке с помощью пакета программ STATISTICA Application 10.0.1011.0. (США). В исследовании использовались описательная статистика, параметрические и непараметрические методы анализа.
3. Основные результаты
На фоне гемической гипоксии и ее коррекции антигипоксанатами произведено исследование изменений активности и концентрации ферментов системы перекисного окисления липидов в сыворотке крови крыс и результаты эксперимента отражены в таблице 1, а в таблице 2 представлен анализ этих изменений.
Таблица 1 - Ферменты системы перекисного окисления липидов в сыворотке крови на фоне острой гемической гипоксии и ее коррекции антигипоксантами
Группы
| Показатель | |||||
Каталаза, мкат/л | СОД | ГП | ГР | МДА | ДК | |
0 | 20,24±0,77 | 31,06±1,18 | 129,47±4,53 | 74,51±2,68 | 6,51±0,25 | 35,93±1,26 |
1 | 18,37±0,721 | 28,01±1,061 | 110,39±4,191 | 69,04±2,78 | 7,11±0,281 | 38,01±1,48 |
2 | 18,26±0,511 | 27,15±1,111 | 107,68±3,911 | 68,41±2,37 | 7,28±0,331 | 38,97±1,341 |
3 | 18,01±0,671 | 27,44±0,981 | 109,21±4,051 | 67,89±2,191 | 7,34±0,251 | 38,55±1,51 |
4 | 18,93±0,812 | 28,36±0,871 | 113,16±4,181,2 | 69,57±2,972 | 6,97±0,212 | 36,69±1,412 |
5 | 17,46±0,491 | 26,77±0,931 | 102,67±4,071 | 63,78±2,231 | 7,61±0,411 | 41,21±1,591 |
Примечание: различия достоверны при P < 0,05: 1 – по сравнению с показателями интактных животных; 2 – по сравнению с показателями контрольной группы
Таблица 2 - Анализ соотношений активности и концентрации ферментов системы перекисного окисления липидов в сыворотке крови крыс при острой гемической гипоксии на фоне нагрузки антигипоксантами растительного происхождения, интактных животных и животных контрольной группы
Группы | Показатель | |||||||
Каталаза, % | СОД, % | ГП, % | ГР, % | МДА, % | ДК, % | ЛАИ, % | Каталаза/МДА, % | |
Антигипоксант – экстракт смородины черной | ||||||||
1 | <0 на 9,2 | <0 на 9,8 | <0 на 14,7 | <0 на 7,3 | > 0 на 9,2 | >0 на 5,8 | <0 на 25,1 | <0 на 16,9 |
>5 на 5,2 | >5 на 4,6 | >5 на 7,5 | >5 на 8,2 | <13 на 6,6 | <5 на 7,8 | >5 на 17,8 | >5 на 12,6 | |
Антигипоксант – экстракт малины лекарственной | ||||||||
2 | <0 на 9,8 | <0 на 12,6 | <0 на 16,8 | <0 на 8,2 | >0 на 11,8 | > 0на 8,4 | <0 на 29,5 | <0 на 19,3 |
>5 на 4,6 | ≈5 | >5 на 4,9 | >5 на 7,3 | <5 на 4,3 | <5 на 5,4 | >5 на 10,9 | >5 на 9,3 | |
Антигипоксант – цитохром С | ||||||||
3 | <0 на 11,0 | <0 на 11,7 | <0 на 15,6 | <0 на 8,9 | > 0на 12,7 | > на 7,3 | <0 на 30,3 | <0 на 21,1 |
>5 на 3,2 | ≈5 | >5 на 6,4 | >5 на 6,4 | <5 на 3,5 | <5 на 6,5 | >13 на 9,6 | >5 на 6,9 | |
Антигипоксант – смесь экстрактов смородины черной и малины лекарственной | ||||||||
4 | <0 на 6,5 | <0 на 8,7 | <0 на 12,6 | <0 на 6,6 | >0 на 7,1 | >0 на 2,1 | <0 на 20,2 | <0 на 12,6 |
>5 на 8,4 | >5 на 5,9 | >5на 10,2 | >5 на 9,1 | <5 на 8,4 | <5 на 11,0 | >5 на 25,4 | >5на 18,4 | |
Контроль | ||||||||
5 | <0 на 13,7 | <0 на 13,8 | <0 на 20,7 | <0 на 14,4 | > 0 на 16,9 | > 0 на 14,7 | <0 на 36,4 | <0 на 26,2 |
По результатам, представленным в таблицах, мы наблюдаем, что в сыворотке крови на фоне острой гемической гипоксии происходит активация окислительных процессов. Это отражается повышением концентрации малонового диальдегида и диеновых конъюгатов в тканях, а также снижением интенсивности восстановительных процессов, что связано со снижением активности антиоксидантных ферментов, которое свидетельствует о возникновении оксидативного стресса.
Для интегральной оценки окислительного гомеостаза сыворотки крови крыс на фоне острой гемической гипоксии произведен расчет локального антиоксидантного индекса крыс и отношения каталазы к малоновому диальдегиду (рис. 1 и 2).
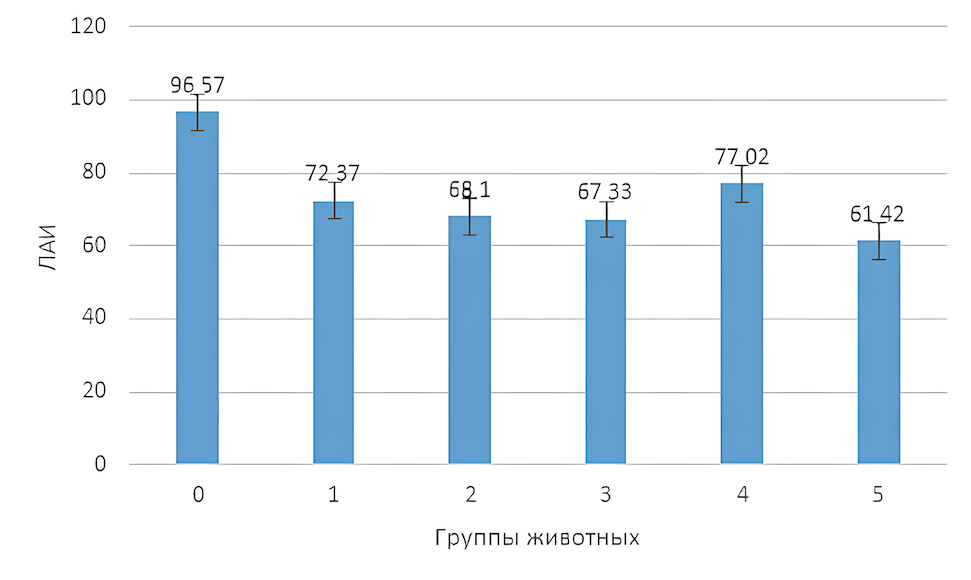
Рисунок 1 - Локальный антиоксидантный индекс сыворотки крови крыс на фоне гемической гипоксии и ее коррекции антигипоксантами
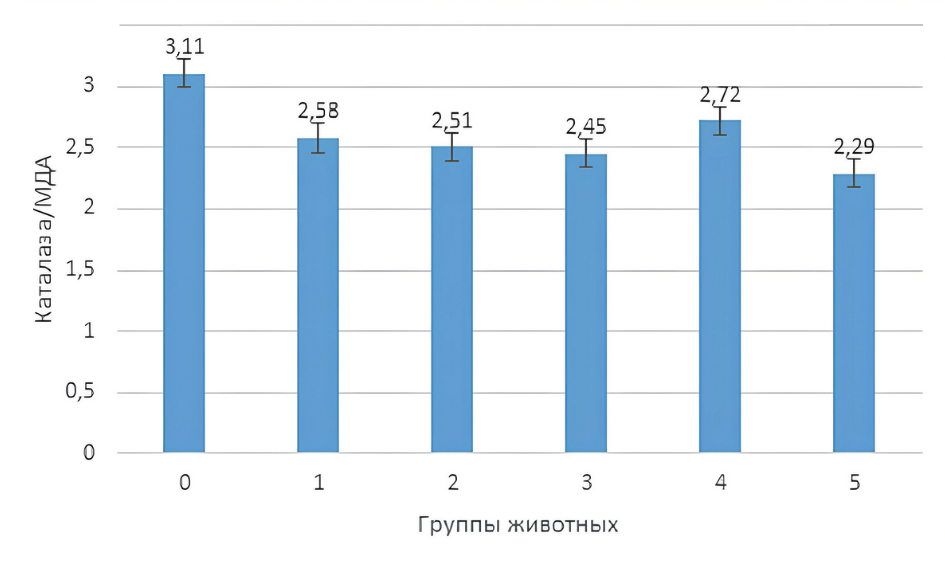
Рисунок 2 - Антиоксидантно-прооксидантный коэффициент сыворотки крови крыс на фоне гемической гипоксии и ее коррекции антигипоксантами
4. Обсуждение
В настоящее время доказан факт активации ПОЛ в условиях гипоксии и полученные нами результаты это подтверждают. Активация ПОЛ при гипоксии осуществляется за счет нескольких причин, ведущими из которых являются восстановление ионов железа, выход цитохрома С из митохондрий в результате набухания последних, а также активация мембранных фосфолипаз, сопровождающихся накоплением неэстерифицированных жирных кислот.
Изменение активности СОД при гипоксии имеет большое физиологическое значение, так как при недостатке кислорода формируются условия для усиления окислительного повреждения переносчиков дыхательной цепи и тем самым создаются предпосылки для усиления генерации активных форм кислорода (супероксид-радикала, пероксида водорода).
Полученные нами результаты согласуются с работами , , в которых изложено, что при терминальных состояниях вследствие гипоксической гипоксии на 24-м часе постреанимационного периода резко повышается содержание первичных продуктов ПОЛ, что является показателем необратимости процессов, развивающихся в центральной нервной системе.
Аналогичные нашим исследованиям изменения в картине ПОЛ отмечает в своих работах М.М. Мелконян и др. , который установил, что при гипоксии происходит повышение концентрации МДА в крови и возрастание концентрации продуктов свободнорадикального окисления на фоне гипоксии и объясняет это начинающимся срывом адаптационных резервов.
Повышение уровня МДА при кислородной недостаточности отмечали в своих исследованиях и другие авторы. Так, по данным Е. Roth и др. , в эксперименте кислородная недостаточность при ишемическом повреждении миокарда вызывает повышение уровня МДА в зоне миокарда уже к 3-му часу после перевязки артерии, что сопровождалось выраженным нарушением функции и структуры мембран клеток миокарда. Особенно резкое образование продуктов ПОЛ отмечается после восстановления кровотока в ишемизированных органах, при переходе из состояния гипоксии к нормоксии , .
Полученные нами данные экспериментального исследования согласуются с результатами
в которых установлено в опытах на белых крысах, что острая гипоксическая гипоксия вызывает значительное снижение активности цинк и медьсодержащей СОД в растворимой фракции печени и мозга и несколько менее выражено в митохондриях печени и мозга, микросомах печени, эритроцитах и плазме крови. Результаты исследования свидетельствуют о существовании взаимосвязи между гипоксическим снижением активности СОД и постгипоксическим накоплением гидроперекисей липидов . Снижение активности СОД в условиях кислородной недостаточности в различных биологических субстратах отмечено также в работах , .Таким образом, острая гипоксия приводит к активации перекисного окисления в тканях, что отражается нарушениями окислительного гомеостаза, приводящими к истощению антиоксидантных средств защиты организма и метаболическим нарушениям, что подтверждается в опытах по изучению липидного обмена.
5. Заключение
Применение антигипоксантов на фоне гипоксии позволяет наиболее эффективно нормализовать окислительный гомеостаз и наиболее выраженный положительный эффект наблюдается при использовании смеси растительных экстрактов в соотношении 1:1, что подтверждается стабилизацией концентраций и активностей ферментов системы перекисного окисления липидов.
