THE EFFECT OF LOW-DOSE INTRANASAL ADMINISTRATION OF DALARGIN ON THE PATHOLOGICAL AND TOXIC PROCESSES IN STRESS ULCEROGENESIS
ВЛИЯНИЕ ДАЛАРГИНА В МАЛОЙ ДОЗЕ ПРИ ИНТРАНАЗАЛЬНОМ ВВЕДЕНИИ НА ПАТОЛОГИЧЕСКИЕ И ТОКСИЧЕСКИЕ ПРОЦЕССЫ ПРИ СТРЕССОРНОМ УЛЬЦЕРОГЕНЕЗЕ
Научная статья
Никольская В.А.1, Черетаев И.В.2, *
1 ORCID: 0000-0003-1642-2884;
2 ORCID: 0000-0003-1852-4323;
1 Крымский инженерно-педагогический университет имени Февзи Якубова, Симферополь, Россия;
2 Крымский федеральный университет им. В.И. Вернадского, Симферополь, Россия
* Корреспондирующий автор (5612178[at]ukr.net)
АннотацияСтатья посвящена проверке гипотезы о снижении патологических и токсических процессов при стрессорном ульцерогенезе (СУ) на фоне предварительного курсового введения интраназальной формы даларгина в малой дозе. В течение 28 дней в сыворотке крови 32 половозрелых крыс-самцов (180-220 г) изучали уровень маркеров патологических и токсических процессов – молекул средней массы (МСМ) при длинах волн регистрации (λ) 254 и 272 нм модифицированным методом Габриэлян. СУ у крыс моделировали согласно официальному экспериментальному протоколу.
Установлено, что в условиях СУ после превентивного курсового интраназального введения даларгина (0,2 мкг/кг) оказывает стресс-протекторный эффект, который проявляется в достоверном и выраженном снижении уровня МСМ в сыворотке крови крыс как при λ 272 нм, так и при λ 254 нм по сравнению с контролем (курсовое введение физиологического раствора). Эффект превентивного воздействия даларгина на фоне СУ на уровень МСМ более мощный по сравнению с изолированным воздействием даларгина и СУ.
Ключевые слова: даларгин, крысы, молекулы средней массы, стресс, ульцерогенез.
THE EFFECT OF LOW-DOSE INTRANASAL ADMINISTRATION OF DALARGIN ON THE PATHOLOGICAL AND TOXIC PROCESSES IN STRESS ULCEROGENESIS
Research article
Nikolskaya V.A.1, Cheretaev I.V.2, *
1 ORCID: 0000-0003-1642-2884;
2 ORCID: 0000-0003-1852-4323;
1 Fevzi Yakubov Crimean Engineering and Pedagogical University, Simferopol, Russia;
2 V.I. Vernadsky Crimean Federal University, Simferopol, Russia
* Corresponding author (5612178[at]ukr.net)
AbstractThe article contains research on testing the hypothesis of a decrease in pathological and toxic processes in stress ulcerogenesis (SU) against the background of a preliminary course of administration of the small intranasal dose of dalargin. Using the modified Gabrielyan method, the authors studied the level of markers of pathological and toxic processes — middle molecules — in the blood serum of 32 mature male rats (180-220 g) at the 254 and 272 nm registration wavelengths (λ) in the course of 28 days. SU in rats was modeled according to the official experimental protocol.
The study found that in the conditions of SU after the preventive course of intranasal administration of dalargin (0.2 mcg/kg) has a stress-protective effect, which is manifested in a significant and pronounced decrease in the middle molecule levels in the blood serum of rats at both λ 272 nm and λ 254 nm compared to the control estimates (course administration of saline solution). The effect of preventive exposure to dalargin against the background of SU on the middle molecule level is more powerful than that of isolated exposure to dalargin and SU.
Keywords: dalargin, rats, middle molecules, stress, ulcerogenesis.
Введение
Аналог мет-энкефалина даларгин (тирозил-D-аланил-глицил-фенилаланил-лейцил-аргинина диацетат) в терапевтических дозах (15-200 мкг/кг) является биологически активным нейропептидом, молекулярный механизм эффектов которого зависит от активации периферических µ- и δ-опиоидных рецепторов [1, С. 72–76]. Показано, что при внутрибрюшинном и пероральном способах введения (500 мкг/кг и более) он проходит через гематоэнцефалический барьер, активирует центральные опиоидные рецепторы и проявляет гастропротекторные, антиоксидантные, антистрессорные и анальгетические эффекты [1, С. 72–76], [2, С. 43–51]. Недавно получены данные и о выраженной анальгетической и антидепрессантной активности даларгина при интраназальном введении (ИВ) [2, С. 43–51], [3, С. 22–26]. Возможно, что использование этого препарата в малых дозах в клинике позволит преодолеть его побочные эффекты, характерные для терапевтических доз (артериальная гипотензия, тахикардия, гиперемия кожи, аллергические реакции, болезненность в месте инъекции, головная боль, боли за грудиной и в эпигастрии).
Наличие стресс-протекторных эффектов даларгина в малых дозах при ИВ в условиях стресса может быть проверено путём изучения динамики маркёров, повышение которых характерно при активно происходящих патологических и токсических процессах в организме. Согласно литературным данным, одним из таких надёжных показателей в клинической лабораторной практике являются молекулы средней массы (МСМ) [4, С. 79–80], [5, С. 11–16], [8, С. 139–145].
Цель работы – проверить рабочую гипотезу о снижении патологических и токсических процессов при СУ на фоне предварительного курсового ИВ даларгина в малой дозе.
Методы и принципы исследования
Эксперимент проводили на 32 половозрелых беспородных крысах-самцах (180-220 г), разделённых на 4 группы по 8 особей, которые на протяжении 28 дней ежедневно получали путём ИВ по 0,1 мл растворов исследуемых веществ: крысам контрольной группы и группы II вводили 0,9% раствор хлорида натрия, а группам I и III – даларгин, разведённый в 0,9% растворе хлорида натрия (0,2 мкг/кг, «Фармсинтез», Украина). Именно в этой дозе даларгин проявляет наиболее выраженные и стабильные эффекты [3, С. 22–26]. На 28-й день через 30 минут после введения тестируемых растворов крысы II и III групп подвергались СУ, который моделировали, подвергая животных продолжительному плаванию в течение 60 мин. в керамической ёмкости (80 х 80 х 130 см), заполненной до уровня 30 см водой (+ 20 ºС) [9, Р. 23–52]. Через 2 часа с момента последнего введения соответствующего тестируемого раствора осуществляли декапитацию крыс. Крыс групп II и III декапитировали через 30 мин. после СУ. После декапитации осуществляли сбор крови в пробирки с разделительным гелем и получали сыворотку путём центрифугирования, как описано в работе [7, С. 172–176].
Об общем состоянии патологических и токсических процессов у особей контрольной и экспериментальных групп судили по уровню МСМ в е. о. п. (экстинкции) в сыворотке (соединения с молекулярной массой от 300 до 5000 Да), который определяли методом Габриэлян [4, С. 79–80] в модификации. Данный показатель широко используется в скрининговой системе клинической лабораторной диагностики при различных патологических состояниях организма [7, С. 172–176], [8, С. 139–145], [10, С. 21–29]. После осаждения белковых компонентов и центрифугирования проводили измерения экстинкций супернатанта при λ 254 и 272 нм на спектрофотометре 5400-УФ («Экрос-аналитика», Россия) и в этом заключалась модификация этого метода [11, С. 398–409]. Следует отметить, что при λ 280 нм определяли триптофансодержащую фракцию МСМ, а при λ 272 нм – фракцию, содержащую ароматические тирозиновые производные, позволяющую более детально оценить стресс-протекторный эффект применяемых курсовых воздействий.
Статистическую обработку данных эксперимента осуществляли с помощью t-критерия Стьюдента.
Основные результаты и обсуждение
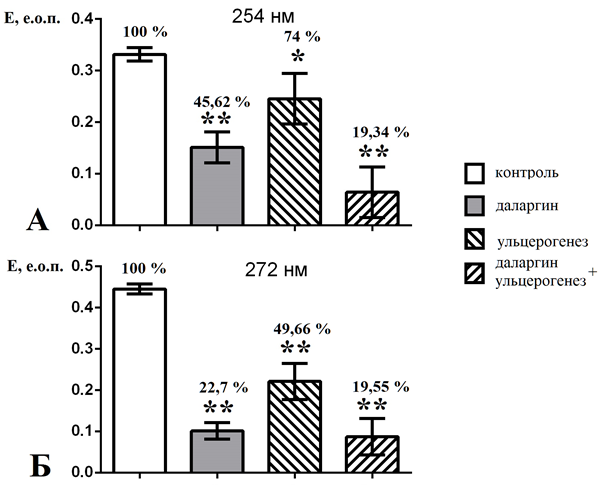
Анализ данных (рис. 1) показал, что при ИВ даларгин в дозе 0,2 мкг/кг по сравнению с контролем достоверно снижал уровень МСМ в сыворотке крови крыс как при λ 254 нм (на 54,38 %, n=8, p≤0,01), так и при λ 272 нм (на 77,3%, n=8, p≤0,01). Даларгин после доставки интраназальным путём через ГЭБ в ЦНС по принципу обратной связи в опиоидергической системе может тормозить синтез и секрецию энкефалинов, препятствуя процессам их накопления. В пользу этого мнения может свидетельствовать то, что опиоидные пептиды в физиологических условиях продуцируются нейронами опиоидергической системы гипоталамуса и секреторных клеток гипофиза, принадлежащих к основной центральной стресс-лимитирующей системе организма [12, С. 10–11].
Рис. 1 – Уровень МСМ при различных длинах волн регистрации в сыворотке крови крыс контрольной группы после препарата даларгин, СУ и при сочетанном воздействии СУ и даларгина:
а – уровень молекул средней массы при λ 254 нм; б – уровень молекул средней массы при λ 272 нм
Примечание: * – p≤0.05; *** – p≤0.001 – достоверность отличий показателя по сравнению с контролем (принят за 100 %); е.о.п. – единицы оптической плотности (экстинкция)
Следует отметить, что с химической точки зрения гексапептид даларгин в сыворотке крови сам легко удовлетворяет критериям молекул-представителей пула МСМ. Первичная структура даларгина включает фенилаланин и тирозин с пиками поглощения света при 257 и 272 нм. Кроме того, есть сведения, что даларгин препятствует увеличению пула МСМ при стрессе и снижает в этих условиях активацию процессов перекисного окисления липидов [13, С. 272–273].
Поскольку даларгин преимущественно снижал МСМ при λ 272 нм, чем при λ 254 нм, приведенные на рис. 1 (группа даларгин) согласно [4, С. 79–80] свидетельствуют, что этот препарат в основном снижает пул МСМ, включающий нуклеиновые кислоты, триптофан и их производные.
В условиях СУ направленность динамики уровня МСМ при λ 254 и 272нм сохранялась, но была значительно менее выражена. Из данных рис. 1 видно, что после СУ уровень МСМ в сыворотке крови крыс при λ 254 нм снижался на 26 % (n=8, p≤0,05), а при 272 нм – на 50,34 % (n=8, p≤0,01). Наблюдаемое на фоне СУ снижение уровня МСМ под влиянием даларгина очевидно свидетельствует о перестройке функциональной активности опиоидергической системы гипоталамуса и секреторных клеток гипофиза в качестве основных звеньев центральной стресс-лимитирующей системы организма. Указанные изменения динамики МСМ могут быть связаны и с образованием некоторыми МСМ крупных агрегатов с молекулярной массой более 5000 Да, которые осаждаются ТХУ и с помощью используемого метода не могут быть зарегистрированы. Известно, что пептидные агрегаты обнаруживаются и при конъюгации с продуктами, образующимися в условиях окислительного стресса, который часто сопровождает изменения патологического характера в организме [13, С. 272–273].
В отношении меньшей выраженности снижения МСМ при λ 254 нм, чем при λ 272 нм после воздействия СУ, мы полагаем, что она может быть связана с активацией процессов свободнорадикального окисления в условиях стресса, приводящих к накоплению молекул эндотоксинов [8, С. 139–145]. Следует отметить и регуляторную роль колебаний динамики некоторых МСМ при патологических процессах, например, инсулина при транзиторном функциональном диабете [14, С. 32–39].
При сочетанном воздействии СУ и даларгина в сыворотке крови крыс наблюдалось достоверное и одинаково выраженное уменьшение по сравнению с контролем содержания МСМ (рис. 1): при λ 254 нм – на 80,66 % (n=8, p≤0,01), а при λ 272 нм – на 80,45 % (n=8, p≤0,01). Такое неспецифическое снижение МСМ при исследуемых длинах волн согласно [4, С. 79–80] указывает на снижение как патологических (МСМ при λ 254 нм), так и регуляторных физиологических процессов (МСМ при λ 272 нм).
К сожалению, под влиянием курсового ИВ даларгина (0,2 мкг/кг) и СУ на основании полученных данных невозможно детально определить физиологические механизмы наблюдаемой динамики МСМ, однако для более объективного их объяснения следует учитывать неоднородность в распределении физико-химических свойств и функциональной активности МСМ, обусловленные структурными особенностями ввиду принадлежности к соединениям разного класса [8, С. 139–145].
Существующие мнения исследователей в отношении значимости МСМ для организма имеют крайне полярную направленность [5, С. 11–16], [6, С. 36–40]. В результате анализа существующих литературных данных и результатов собственных исследований о роли МСМ в организме [4, С. 79–80], [5, С. 11–16], [6, С. 36–40], [10, С. 21–29] было установлено, что эти соединения отражают статус нормы физиологических и биохимических составляющих постоянного динамического равновесия внутренней среды организма, тонко реагируя на воздействия и изменения внутренних и внешних факторов. Не исключено, что МСМ в целом или какая-то их часть являются важным связующим звеном в системе биорегуляции, отражая или определяя характер отклонений (сила и глубина воздействия на организм внешнего или внутреннего фактора), направленность изменений (отношение к какому-либо звену метаболизма) и их органо- и тканеспецифичность. В настоящее время показана возможность регуляции короткими пептидами функциональной активности организма на клеточном уровне и предприняты первые попытки рассмотрения зависимости тканеспецифического действия пептидов от количества аминокислот, входящих в их состав [15, С. 497–503].
Следует также отметить, что фракции МСМ включают агенты, являющиеся частью трансдуцирующей системы передачи сигнала в организме [5, С. 11–16], [8, С. 139–145], таким примером служит биологическая активность регуляторных соединений, входящих в пул МСМ и обладающих гормональной активностью (инсулин, гастрин, секретин и пептиды семейства секретина). Такие соединения участвуют в реализации многочисленных физиологических процессов, основанных на самых различных механизмах передачи сигнала [8, С. 139–145]. Кроме того, МСМ могут быть включены и в компенсаторные механизмы восстановления организма в качестве структурных блоков, недостающих элементов замещения в системе метаболизма или за счёт неспецифического увеличения своего сегмента. В случае замедленной элиминации МСМ могут стать одним из основных факторов интоксикации организма, что согласуется с широко распространённым мнением об этих соединениях, как маркере токсических процессов [4, С. 79–80], [[8, С. 139–145], [10, С. 21–29].
Итак, данные настоящей работы о наличии стресс-протекторных эффектов даларгина и результаты предыдущих исследований его анальгетических и антидепрессантных эффектов в малых дозах показали, что применение этого препарата в интраназальной форме перспективно для решения задач прикладной биомедицины. Заслуживает внимания и то, что интраназальный способ доставки препарата к биологическим мишеням является наиболее быстрым и обеспечивает ускоренное проявление физиологического эффекта лекарственных средств, а использование малых доз позволит минимизировать его побочные эффекты, характерные для терапевтических доз.
ЗаключениеДаларгин после курсового ИВ (0,2 мкг/кг) в сыворотке крови крыс достоверно (p≤0,01) снижает уровень МСМ при λ 254 нм на 54,38 %, а при λ 272 нм – на 77,3 %. В сыворотке крови крыс, подвергнутых СУ, после предварительного курсового ИВ физиологического раствора, достоверно снижается уровень МСМ, но менее выражено, чем после воздействия даларгина: при λ 254 нм на 26 % (p≤0,05) и при λ 272 нм на 50,34 % (p≤0,01). В сыворотке крови крыс, подвергнутых СУ, после превентивного курсового ИВ даларгина в малой дозе содержание МСМ снижается относительно контроля: при λ 254 нм – на 80,66 % (p≤0,01), а при λ 272 нм – на 80,45 % (p≤0,01). В данном случае снижение МСМ как индикаторов патологических и токсических процессов оказалось более мощным по сравнению с изолированным воздействием даларгина и СУ. Это свидетельствует о стресс-протекторном эффекте даларгина в малой дозе при превентивном курсовом ИВ на фоне СУ.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Титов М. И. Даларгин – пептидный препарат с цитопротективным действием / М. И. Титов, В. А. Виноградов, Ж. Д. Беспалова // Бюллетень ВКНЦ АМН СССР. – 1985. – №2. – С. 72–76.
- Коренюк И. И. Влияние даларгина в малых дозах на болевую чувствительность у крыс / И. И. Коренюк, Е. Н. Минина, Ю. В. Белоусова и др // Учёные записки Таврического национального университета имени В.И. Вернадского. Серия «Биология, химия». – 2014. – Т. 27, №4. – С. 43–51.
- Минина Е. Н. Влияние малых доз даларгина при интраназальном введении на поведение крыс в тесте Порсолта / Е. Н. Минина, И. В. Черетаев // Крымский журнал экспериментальной и клинической медицины. – 2016. – Т. 6, №4. – С. 22–26.
- Габриэлян Н. И. Ориентировочный тест для диагностики гнойно-септических процессов / Н. И. Габриэлян, О. А. Савостьянова // Лабораторное дело. – 1987. – №2. – С. 79–80.
- Громашевская Л. Л. «Средние молекулы» как один из показателей «метаболической интоксикации» в оpганизме / Л. Л. Громашевская // Лабораторная диагностика. – 1997. – №1. – С. 11–16.
- Мосина Л. М. Ульцерогенез и эндогенная интоксикация / Л. М. Мосина, О. И. Авдейкина // Экспериментальная клиническая гастроэнтерология. – 2008. – Вып. 6. – С. 36–40.
- Никольская В. А. Влияние экспериментальной гиперинсулинемии на уровень молекул средней массы в сыворотке крови лабораторных крыс / В. А. Никольская // Ученые записки Таврического национального университета имени В.И. Вернадского. Серия «Биология, химия». – 2012. – Т. 25, №1. – С.172–176.
- Никольская В. А. Биохимический аспект рассмотрения молекул средней массы в организме / В. А. Никольская, Ю. В. Данильченко, З. Н. Меметова // Учёные записки Таврического национального университета имени В.И. Вернадского. Серия «Биология, химия». – 2013. – Т. 26, №1. – С. 139–145.
- Porsolt R. D. Psychotropic screening procedures. In: Methods in Behavioral Pharmacology / R. D. Porsolt, R. A. McArthur, A. Lenegre. – Amsterdam: Elsevier, 1993. – Р. 23–52.
- Карякина Е. В. Особенности патогенетических механизмов эндогенной интоксикации у больных ревматоидным артритом / Е. В. Карякина, С. В. Белова // Научно-практическая ревматология. – 2001. – №1. – С. 21–29.
- Дубинина Е. Е. Окислительная модификация белков плазмы крови больных психическими расстройствами (депрессия, деперсонализация) / Е. Е. Дубинина, М. Г. Морозова, Н. В. Леонова и др. // Вопросы медицинской химии. – 2000. – Т. 46 (4). – С. 398–409.
- Губанова Е. И. Неспецифические механизмы развития болезней / Е. И. Губанова, Л. Н. Рогова, Н. Ю. Дзюбенко. – Волгоград: Изд-во ВолГМУ, 2011. – 76 с.
- Дубинина Е. Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико-биохимические аспекты / Е. Е. Дубинина. – С.-Пб.: Издательство «Медицинская пресса», 2006. – С. 272–273.
- Иванов В. В. Окислительный стресс: влияние на секрецию инсулина, рецепцию гормона адипоцитами и липолиз в жировой ткани / В. В. Иванов, Е. В. Шахристова, Е. А. Степовая и др. // Бюллетень сибирской медицины. – 2014. – Т.13, №3. – С. 32–39.
- Хавинсон В. Х. Зависимость тканеспецифического действия пептидов от количества аминокислот, входящих в их состав / В. Х. Хавинсон, Н. И. Чалисова, Н. С. Линькова и др. // Фундаментальные исследования. – 2015. – №2 (3). – С. 497–503.
Список литературы на английском языке / References in English
- Titov M. I. Dalargin – peptidnyj preparat s citoprotektivnym dejstviem [Dalargin-a peptide drug with cytoprotective action] / M. I. Titov, V. A. Vinogradov, Zh. D. Bespalova // Byulleten' VKNC AMN SSSR [Bulletin of the All-Union Cardiological Scientific Center of the USSR Academy of Medical Sciences]. – 1985. – №2. – P. 72–76. [in Russian]
- Koreniuk I. I. Vliyanie dalargina v malyh dozah na bolevuyu chuvstvitel'nost' u krys [The effect of dalargin in small doses on pain sensitivity in rats] / I. I. Koreniuk, E. N. Minina, Yu. V. Belousova et al. // Uchyonye zapiski Tavricheskogo nacional'nogo universiteta imeni V. I. Vernadskogo. Seriya «Biologiya, himiya». [Scientific Notes of Taurida V. I. Vernadsky National University. Biology. Chemistry] – 2014. – V. 27, №4. – P. 43–51. [in Russian]
- Minina E. N. Vliyanie malyh doz dalargina pri intranazal'nom vvedenii na povedenie krys v teste Porsolta [Influence of small doses of dalargin on the behavior of rats in the test of Porsolt when administered intranasall] / E. N. Minina, I. V. Cheretaev // Krymskij zhurnal eksperimental'noj i klinicheskoj mediciny [Crimea Journal of Experimental and Clinical Medicine]. – 2016. – V. 6, №4. – P. 22–26. [in Russian]
- Gabrielyan N. I. Orientirovochnyj test dlya diagnostiki gnojno-septicheskih processov [Indicative test for the diagnosis of purulent-septic processes] / N. I. Gabrielyan, O. A. Savost'yanova // Laboratornoe delo [Laboratornoe delo]. – 1987. – №2. – P. 79–80. [in Russian]
- Gromashevskaya L. L. «Srednie molekuly» kak odin iz pokazatelej «metabolicheskoj intoksikacii» v opganizme [“Middle molecules” as one of the indicators of “metabolic intoxication” in the body] / L. L. Gromashevskaya // Laboratornaya diagnostika [Laboratornaya diagnostika]. – 1997. – №1. – P. 11–16. [in Russian]
- Mosina L. M. Ul'cerogenez i endogennaya intoksikaciya / L. M. Mosina, O. I. Avdejkina [The ulcerogenesis and endogenous intoxication] // Eksperimental'naya klinicheskaya gastroenterologiya [Experimental and Clinical Gastroenterology]. – 2008. – V. 6. – P. 36–40. [in Russian]
- Nikol'skaya V. A. Vliyanie eksperimental'noj giperinsulinemii na uroven' molekul srednej massy v syvorotke krovi laboratornyh krys [Influence of experimental hyperinsulinemia is on the level of molecules of middle mass in the whey of blood of laboratory rats] / V. A. Nikol'skaya // Uchenye zapiski Tavricheskogo nacional'nogo universiteta imeni V. I. Vernadskogo. Seriya «Biologiya, himiya» [Scientific Notes of Taurida V. I. Vernadsky National University. Biology. Chemistry]. – 2012. – V. 25, №1. – P. 172–176. [in Russian]
- Nikol'skaya V. A. Biohimicheskij aspekt rassmotreniya molekul srednej massy v organizme [Biochemical aspects of the consideration of the role of high molecular mass in the body] / V. A. Nikol'skaya, Yu. V. Danil'chenko, Z. N. Memetova // Uchyonye zapiski Tavricheskogo nacional'nogo universiteta imeni V. I. Vernadskogo. Seriya «Biologiya, himiya» [Scientific Notes of Taurida V. I. Vernadsky National University. Biology. Chemistry]. – 2013. – V. 26, №1. – P. 139–145. [in Russian]
- Porsolt R. D. Psychotropic screening procedures. In: Methods in Behavioral Pharmacology / R. D. Porsolt, R. A. McArthur, A. Lenegre. – Amsterdam: Elsevier, 1993. – Р. 23–52.
- Karyakina E. V. Osobennosti patogeneticheskih mekhanizmov endogennoj intoksikacii u bol'nyh revmatoidnym artritom [Features of pathogenetic mechanisms of endogenous intoxication in patients with rheumatoid arthritis] / E. V. Karyakina, S. V. Belova // Nauchno-prakticheskaya revmatologiya [Rheumatology Science and Practice]. – 2001. – №1. – P. 21–29. [in Russian]
- Dubinina E. E. Okislitel'naya modifikaciya belkov plazmy krovi bol'nyh psihicheskimi rasstrojstvami (depressiya, depersonalizaciya) [Oxidative modification blood plasma proteinsin patients with mental disorders (depression and depersonalization)] / E. E. Dubinina, M. G. Morozova, N. V. Leonova et al. // Voprosy medicinskoj himii [Voprosy meditsinskoi khimii]. – 2000. – V. 46 (4). – P. 398–409. [in Russian]
- Gubanova E. I. Nespecificheskie mekhanizmy razvitiya boleznej [Non-specific mechanisms of disease development] / E. I. Gubanova, L. N. Rogova, N. Yu. Dzyubenko. – Volgograd: Publishing houseVolGMU, 2011. – 76 p. [in Russian]
- Dubinina E. E. Produkty metabolizma kisloroda v funkcional'noj aktivnosti kletok (zhizn' i smert', sozidanie i razrushenie). Fiziologicheskie i kliniko-biohimicheskie aspekty [Products of oxygen metabolism in the functional activity of cells (life and death, creation and destruction). Physiological and clinical and biochemical aspects] / E. E. Dubinina. – S.-Pb.: Publishing house «Medicinskaya pressa», 2006. – P. 272–273. [in Russian]
- Ivanov V. V. Okislitel'nyj stress: vliyanie na sekreciyu insulina, recepciyu gormona adipocitami i lipoliz v zhirovoj tkani [Oxidative stress: its role in insulin secretion, hormone reception by adipocytes and lipolysis in adipose tissue] / V. V. Ivanov, E. V. Shahristova, E. A. Stepovaya et al.. // Byulleten' sibirskoj mediciny [Bulletin of Siberian Medicine]. – 2014. – V. 13, №3. – P. 32–39. [in Russian]
- Havinson V. H. Zavisimost' tkanespecificheskogo dejstviya peptidov ot kolichestva aminokislot, vhodyashchih v ih sostav [The dependence of tissue-specific peptides activityon the number of amino acids in the peptides] / V. H. Havinson, N. I. Chalisova, N. S. Lin'kova et al. // Fundamental'nye issledovaniya [Fundamental Research]. – 2015. – №2 (3). – P. 497–503. [in Russian]