MARKETING ASPECT OF MEDICINES LABELING IN EUROPEAN UNION COUNTRIES AND RUSSIAN FEDERATION
МАРКЕТИНГОВЫЙ АСПЕКТ МАРКИРОВКИ ЛЕКАРСТВ В СТРАНАХ ЕВРОПЕЙСКОГО СОЮЗА И РОССИЙСКОЙ ФЕДЕРАЦИИ
Научная статья
Сидорчук Р.Р.1, Глазкова О.С.2, *
1, 2 Российский экономический университет имени Г.В. Плеханова, Москва, Россия
* Корреспондирующий автор (pianto[at]mail.ru)
АннотацияДанная работа содержит анализ основных принципов маркировки лекарственных средств в странах Европейского союза (ЕС), особенностей взаимодействия общеевропейской и национальных систем контроля лекарственных средств. Авторы провели сравнение российской и европейской систем отслеживания движения лекарств, выделили характерные особенности обеих систем с целью определения уровня влияния на удовлетворение конченых потребителей через изменения в маркетинговых каналах (функциональность, структуру).
Ключевые слова: маркетинговый канал, EMVO, EMVS, уникальный идентификатор, DataMatrix, сериализация.
MARKETING ASPECT OF MEDICINES LABELING IN EUROPEAN UNION COUNTRIES AND RUSSIAN FEDERATION
Research article
Sidorchuk R.R.1, Glazkova O.S.2, *
1, 2 Plekhanov Russian University of Economics, Moscow, Russia
* Corresponding author (pianto[at]mail.ru)
AbstractThis paper discusses the basic principles of medicines labeling in the countries of the European Union (EU), the main features of interaction between the pan-European and national medicines verification systems. The authors compared Russian and European medicines tracking systems, specified the outstanding characteristic of both systems with the purpose of definition the level of influencing on end consumers’ satisfaction through changes in marketing channels (functionality, structure).
Keywords: marketing channel, EMVO, EMVS, unique identifier, DataMatrix, serialization.
Каналы распределения (иногда в литературе их называют маркетинговыми каналами) являются важнейшим инструментом создания и управления потребительской ценностью. Если в середине ХХ века каналы распределения рассматривались только как “экономические системы”, то в последующем их стали рассматривать как симбиоз экономической и социальной систем. Важность маркетинговой работы в каналах распределения можно подчеркнуть словами П. Друкера, который в своей статье [6] писал о том, что маркетинговые каналы должны быть «основной заботой любого бизнеса и любой отрасли», и указал на необходимость прогнозирования изменений в них, в том числе с помощью исследования всех участников и процессов. В этом смысле, важным маркетинговым аспектом в каналах распределения является анализ и управление изменениями в системе функционирования каналов, ролях участников и т.п. В настоящий момент таким важным изменением является внедрение маркировки лекарственных средств.
В Российской Федерации полноценное внедрение процесса маркировки лекарственных средств было реализовано с 01 июля 2020 года, хотя пилотный проект по 7 основным нозологиям был запущен в октябре 2019 года [3]. При этом в странах Европейского союза аналогичный российскому процесс был внедрен на рынке в феврале 2019 года.
Безусловно, европейские страны начали работу над данным проектом раньше, чем он стартовал в России, но тем интереснее определить особенности другой системы отслеживания перемещения лекарств в сравнении с российской, в особенности, с учетом предположений, что одна из них будет прототипом для создания подобной системы для стран-участниц Евразийского экономического союза. Интересны особенности потоков товаров и информации, которые формируются в каналах распределения на рынках стран ЕС.
EMVO – European Medicines Verification Organization (Европейская организация по осуществлению контроля за лекарственными средствами) –основана для осуществления администрирования и контроля по исполнению Falsified Medicines Directive, постановления Европейской комиссии по предотвращению распространения фальсифицированных лекарственных средств, действует совместно с NMVOs – National Medicines Verification Organizations (Национальные организации по осуществлению контроля за лекарственными средствами), и является органом, ответственным за создание и развитие EMVS – European Medicines Verification System – европейской системы контроля за лекарственными средствами (рис.1) [1].
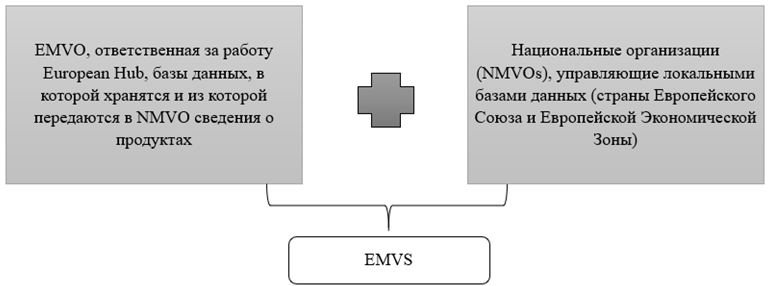
Рис. 1 – Структура EMVS
Основной миссией EMVO является предотвращение проникновения фальсифицированных лекарственных средств в европейские каналы поставок. Все коммуникации участников канала распределения с системой проходят через European Hub (EH) – хранилище данных, куда производители подгружают информацию о произведенных лекарственных средствах, и которое служит связующим звеном между производителями и национальными системами контроля.
Канал распределения маркированной продукции в европейских странах отражен на схеме (рис.2) [1].
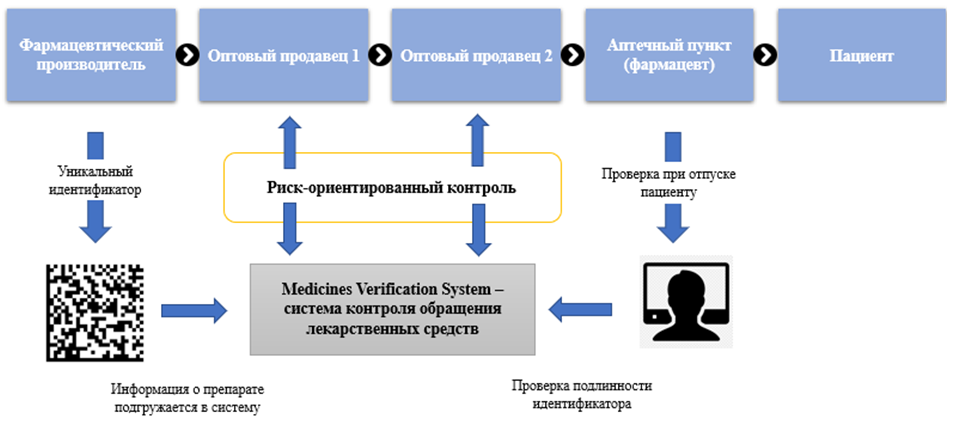
Рис. 2 – Движение маркированной продукции в странах ЕС
Производитель присваивает уникальный идентификатор каждой пачке лекарственного средства и обеспечивает наличие защиты от вскрытия на ней. Идентификатор шифруется в двухмерный штрих-код DataMatrix, который также наносится на пачку. С помощью данного кода в дальнейшем происходит проверка аутентичности идентификатора и соответственно подтверждается оригинальность каждой пачки лекарственного средства. При отпуске пациенту уникальный идентификатор подлежит деактивации во избежание возможности его повторного использования [1].
Стоит отметить, что европейским законодательством не установлено требование к оптовому продавцу проверять каждую полученную им упаковку лекарственного средства, если товар поступает от производителя или оптового торговца, являющегося держателем регистрационного удостоверения. То есть на этапе поставки лекарственного средства от производственной площадки или владельца регистрационного удостоверения нет необходимости проверять аутентичность кода и подлинность продукции. Однако при перепродаже от одного оптового дистрибьютора другому такая необходимость появляется.
Также EMVS предусматривает, в случае технических сложностей, возможность отпуска лекарственного средства с отложенной по времени деактивацией, то есть несмотря на сбои, покупатель сможет получить в аптеке необходимый товар, фармацевту в этом случае придется сохранить уникальный идентификатор и сразу после устранения неполадок проверить аутентичность и деактивировать уникальный идентификатор.
Следует отметить и этапы формирования и работы EMVS, определенные Директивой 2001/83/EC Европейского Парламента и регламентом Европейской Комиссии 2016/161 от 2 октября 2015 г. Создание, с обязательным этапом консультаций с производителями, дистрибьюторами, и обслуживание системы должно проводиться некоммерческими юридическими лицами, фармпроизводителями, учрежденными в ЕС и держателями регистрационных удостоверений. Участие коммерческих организаций в работе EMVO возможно на добровольной безвозмездной основе. Расходы на содержание хранилища данных несут производители лекарственных препаратов, при этом с участников системы взимается единоразовая оплата за подключение к EMVS, NMVO. Размер платы варьируется в зависимости от количества регистрационных удостоверений у каждого производителя. Также предусмотрены ежегодные взносы за пользование NMVO.
Вышеперечисленные особенности европейской системы важны, в особенности в качестве бенчмарков для оценки работы российской системы мониторинга движения лекарственных препаратов (МДПЛ), и для экстраполяции результатов сравнения в реперных точках на ситуацию с распределением лекарственных средств на территории Российской Федерации.
Таблица 1 – Сравнение систем мониторинга движения лекарственных средств в РФ и странах ЕС
| EMVO | МДЛП |
| End-to-End – в системе проверки задействованы в основном производители и аптека/медицинское учреждение, то есть проверка оригинальности препарата осуществляется на этапе входа и выхода товара из канала распределения | Track and trace (centralized) – каждый переход права собственности на препарат фиксируется в системе, то есть в системе создается своеобразный «след» от перемещения продукции по каналу распределения – от производителя до аптеки |
| Уникальный идентификатор генерируется производителем | Уникальный идентификатор по запросу производителя генерируется оператором системы |
| Некоммерческая организация | Коммерческая организация |
| Единовременная плата со стороны производителей, уполномоченных дистрибьюторов за «вход» в систему, ежегодные платежи за право пользования национальными базами данных | Оплачивается генерация уникального кода для каждой упаковки лекарственного средства (50 копеек), бесплатное пользование системой |
| Есть возможность реализации продукции в случае технических сбоев | Нет возможности реализации продукции в случае технических сбоев |
На основании указанных в таблице 1 особенностей появляются сомнения, что российская система, являясь частью Национальной системы цифровой маркировки, была создана исключительно для борьбы с контрафактной и фальсифицированной продукцией. Поскольку МДЛП владеет коммерческая организация, напрашивается вывод, что данная информационная система создана для получения прибыли, при чем не только для частных лиц, но и для государства, так как в ней отслеживается передвижение продукции от одного налогоплательщика к другому. Также косвенно это подтверждает тот факт, что первоначальным «владельцем» проекта разработки системы мониторинга была Федеральная налоговая служба, также участникам системы рекомендовано интегрировать свои товарно-учетные системы в МДЛП.
Сравнивания расходы производителей в европейской и российской системе контроля, стоит отметить, что расходы на маркировку в России прямо пропорциональны объемам производства и продаж, поскольку оплачивается генерирование кода для каждой упаковки лекарственного средства. При этом в странах ЕС при фиксированных оплатах за пользование системой расходы на маркировку одной пачки обратно пропорциональны объему производства. Очевидно, что стоимость лекарственных препаратов на российском рынке будет иметь тенденцию к росту. В совокупности с пересмотром государством предельных отпускных в сторону понижения, существует серьезный риск ухода с рынка ряда низкомаржинальных, в особенности из дешевого ценового сегмента, лекарственных препаратов.
При технических сбоях в работе российской системы доступность лекарств для потребителей становится маловероятной до момента устранения неполадок. Это безусловно, нарушает основной принцип эффективного распределения – доступность товара в нужном месте и в нужное время, что на национальном уровне может спровоцировать снижение качества жизни и угрозу здоровью населения.
В целом использование такого типа системы как «track and trace» изменяет структуру и длину канала распределения на российском рынке, появляется еще один независимый участник, от которого зависит процесс движения лекарств до конечного потребителя – оператор ООО «ЦРПТ» (Оператор) (рис.3).
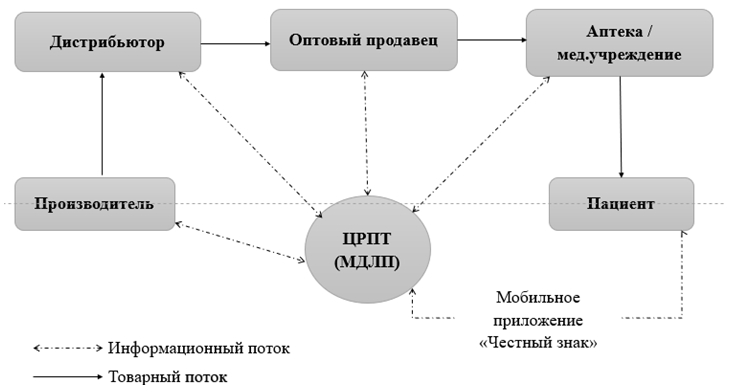
Рис. 3 – Схема канала распределения в РФ после внедрения маркировки
Таким образом, перед производителями лекарственных средств встает вопрос об организации каналов распределения маркированной продукции с учетом появления нового участника распределения, который непосредственно влияет на скорость движения продукции в каналах поставки, косвенно может оказывать влияние на изменение стоимости препаратов, а также управляет крайне важной частью канала распределения – информационными потоками, нарушение обмена которыми несет высокие риски для производителей.
Отслеживание скорости товародвижения является важной задачей маркетинга при поставке продукции до конечного потребителя. В некоторых случаях отсутствие препарата, либо невозможность его продажи/использования без «подтверждения» от системы мониторинга, могут привести к серьезным последствиям, например, при использовании препаратов в медицинских учреждениях, в особенности скоропомощных. Если потребитель не сможет найти/приобрести препарат в нужной аптеке, если придется искать препарат в других аптеках, возможно осложнение ситуации с лояльностью к определенному бренду, при условии существования на рынке большого количества аналогичных препаратов, это может привести к потере целевого потребителя.
Из-за обязательной коммуникации всех участников с МДЛП также замедляется динамика товарных потоков. При этом в случае задержки движения на стороне оптовых продавцов, аптечных пунктов, медицинских учреждений, производитель не имеет возможности управлять скоростью товарного потока, даже с применением поощрительных маркетинговых мероприятий (премии за оборот, поддержание ассортиментной матрицы). В конечном тоге, от замедления передвижения товаров по каналу распределения будет страдать конечный потребитель, что недопустимо с точки зрения организации эффективной и действенной маркетинговой стратегии компании.
С целью нивелирования возможных негативных последствий производители могут предпринять меры по поддержанию необходимого уровня лекарственного обеспечения потребителей:
1) увеличив товарные запасы и кратность поставок дистрибьюторам, оптовым продавцам и в аптеки, однако заранее следует оценить производственные мощности и финансовые риски, для иностранных производителей – также колебания валютных курсов;
2) усилить взаимосвязь с Оператором на техническом уровне с целью регулировать поток своей продукции до этапа конечного потребителя – возможная опция для проработки в будущем, требующая изменения законодательных актов;
3) установление «уведомительного» режима работы с МДПЛ (как это было допустимо до 01 февраля 2021 года) – отсутствие необходимости длительного ожидания ответа от системы мониторинга, возможность движения продукции на основании только уведомления системы о поступлении/выбытии лекарственных средств, позволяет ускорить динамику на всех этапах канала распределения.
Учитывая все более нарастающую интеграцию стран Евразийского экономического союза в особенности в области диджитализации процессов отслеживания движения товаров, услуг, цифровых активов между странами, опыт России в области маркировки товаров будет перениматься другими странами и имплементироваться на межнациональном уровне (уже сейчас ведется проработка пилотных проектов в Узбекистане, Казахстане) [4], [5]. Поэтому возможность дополнительной проработки и корректировки существующих процессов с ориентацией на модели в других странах с успешно внедренными системами позволит максимально безопасно и неощутимо для конечных потребителей провести модернизацию и изменения.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Commission delegated regulation (EU) 2016/161 of 02.10.2015. [Electronic resource]. URL: https://emvo-medicines.eu/new/wp-content/uploads/Delegated-Regulation-EU-2016-161.pdf. (accessed: 09.02.2021)
- Об утверждении положения о системе мониторинга движения лекарственных препаратов для медицинского применения / Постановление Правительства Российской Федерации от 14.12.2018г. №1556. [Электронный ресурс]. URL: https://честныйзнак.рф/upload/iblock/a40/PP-RF-ot-14.12.2018-_-1556-s-uchyetom-izmeneniy-1118_1.pdf. (дата обращения: 09.02.2021)
- Об особенностях внедрения системы мониторинга движения лекарственных препаратов для медицинского применения / Постановление Правительства Российской Федерации от 14.12.2018г. №1557. [Электронный ресурс]. URL: https://честныйзнак.рф/upload/iblock/1f8/PPRF12.18_1557_osobennosti_vnedreniya_7B3H.pdf. (дата обращения: 09.02.2021)
- Об утверждении правил маркировки лекарственных средств и медицинских изделий / Приказ Министра здравоохранения Республики Казахстан от 27.01.2021 №ҚР ДСМ-11. [Электронный ресурс]. URL: http://adilet.zan.kz/rus/docs/V2100022146#z9. (дата обращения: 09.02.2021)
- О введении системы обязательной цифровой маркировки отдельных видов товаров / Постановление кабинета министров Республики Узбекистан от 20.11.2020 №737. [Электронный ресурс]. URL: https://nrm.uz/contentf?doc=642914_postanovlenie_kabineta_ministrov_respubliki_uzbekistan_ot_20_11_2020_g_n_737_o_vvedenii_sistemy_obyazatelnoy_cifrovoy_markirovki_otdelnyh_vidov_tovarov&products=1_vse_zakonodatelstvo_uzbekistana. (дата обращения: 09.02.2021)
- Drucker, P. Manage by walking around–outside / P. Drucker // Wall Street Journal. 1990. 11. A12.
- Думанчук М. Защита лекарственных средств от фальсификации в ЕС в действии / М. Думанчук // Фармацевтическая отрасль. – 2019. – №2 (73). – С.88-91.
- Кудряшова М.Н. Маркировка лекарственных средств: теоретические и практические аспекты/ М.Н. Кудряшова, О.А. Судакова // Тверской медицинский журнал. – 2021. – №1. – С.84-89.
- Тезина Н.Н. Обзор нормативно-правового регулирования проекта ФГИС МДЛП / Н.Н. Тезина // Врач и информационные технологии. – 2020. – №S – С.39-42.
Список литературы на английском языке / References in English
- Commission delegated regulation (EU) 2016/161 of 02.10.2015. [Electronic resource] URL: https://emvo-medicines.eu/new/wp-content/uploads/Delegated-Regulation-EU-2016-161.pdf (accessed: 09.02.2021)
- Ob utverzhdenii polozhenija o sisteme monitoringa dvizhenija lekarstvennyh preparatov dlja medicinskogo primenenija. Postanovlenie Pravitel'stva Rossijskoj Federacii ot 14.12.2018 №1556 [About the Approval of Medicines Track System. Act of the Government of Russian Federation №1556 of 14.12.2018]. – [Electronic resource] – URL: https://честныйзнак.рф/upload/iblock/a40/PP-RF-ot-14.12.2018-_-1556-s-uchyetom-izmeneniy-1118_1.pdf. (accessed: 09.02.2021) [in Russian]
- Ob osobennostjah vnedrenija sistemy monitoringa dvizhenija lekarstvennyh preparatov dlja medicinskogo primenenija. Postanovlenie Pravitel'stva Rossijskoj Federacii ot 14.12.2018 №1557 [About the Specifics of Implementing of Medicines Track System. Act of the Government of Russian Federation №1556 of 14.12.2018]. – [Electronic resource] – URL: https://честныйзнак.рф/upload/iblock/1f8/PPRF_14.12.18_1557_osobennosti_vnedreniya_7B3H.pdf. (accessed: 09.02.2021) [in Russian]
- Ob utverzhdenii pravil markirovki lekarstvennyh sredstv i medicinskih izdelij. Prikaz Ministra zdravoohranenija Respubliki Kazahstan ot 27.01.2021 №ҚR DSM-11 [About the Approval of Labeling Rules of Medicines and Medical Devices. Order of the Minister of Health of Republic of Kazakhstan № KR DSM-11 of 27.01.2021]. – [Electronic resource] – URL: http://adilet.zan.kz/rus/docs/V2100022146#z9. (accessed: 09.02.2021) [in Russian]
- O vvedenii sistemy objazatel'noj cifrovoj markirovki otdel'nyh vidov tovarov. Postanovlenie kabineta ministrov Respubliki Uzbekistan ot 20.11.2020 №737 [About the Implementation of the System of Digital Labeling of Selected Types of Goods. Order of the Cabinet of Ministers of Republic of Uzbekistan №737 of 20.11.2020]. [Electronic resource] URL: https://nrm.uz/contentf?doc=642914_postanovlenie_kabineta_ministrov_respubliki_uzbekistan_ot_20_11_2020_g_n_737_o_vvedenii_sistemy_obyazatelnoy_cifrovoy_markirovki_otdelnyh_vidov_tovarov&products=1_vse_zakonodatelstvo_uzbekistana. (accessed: 09.02.2021) [in Russian]
- Drucker, P. Manage by walking around–outside / P. Drucker // Wall Street Journal. 1990. 11. A12.
- Dumanchuk M. Zashhita lekarstvennyh sredstv ot fal'sifikacii v ES v dejstvii [Protection of Medicines from Falsification in EU in Action] / M. Dumanchuk // Farmacevticheskaja otrasl [Pharmaceutical industry]. – – №2 (73). – P.88-91. [in Russian]
- Kudrjashova M.N. Markirovka lekarstvennyh sredstv: teoreticheskie i prakticheskie aspekty [Marking of Medicament: Theoretical and Practical Aspects] / M.N. Kudrjashova, O.A. Sudakova // Tverskoj medicinskij zhurnal [Tver Medical Journal]. – – №1. – P.84-89. [in Russian]
- Tezina N.N. Obzor normativno-pravovogo regulirovanija proekta FGIS MDLP [Review of regulatory environment of the project FGIS MDLP] / N.N. Tezina // Vrach i informacionnye tehnologii. – – №S1. – P.39-42. [in Russian]
