A COMPARISON OF DECOMPOSITION RATES OF CARBON DIOXIDE FROM THE EARTH'S ATMOSPHERE BY PHOTONS OF SUNLIGHT AND ITS UTILIZATION BY PLANTS
A COMPARISON OF DECOMPOSITION RATES OF CARBON DIOXIDE FROM THE EARTH'S ATMOSPHERE BY PHOTONS OF SUNLIGHT AND ITS UTILIZATION BY PLANTS
Abstract
Two processes of natural absorption of carbon dioxide were researched.
The first is the decomposition of carbon dioxide by photons of sunlight. Time of decomposition of 1 mg of carbon dioxide equals 17.7 days. In the second process – the absorption of 1 mg of carbon dioxide by plants takes 10.5 days.
Experiments were performed with carbon dioxide dissolved in water. The mass of carbon dioxide is 84.5 mg in 0.05 l of water. Chlorophyll was used as a catalyst, a 100 W incandescent lamp with a reflector was used as light. The estimated time to complete the reaction was 227 days. After evaporation of the solution, carbon crystals were obtained. It is concluded that the process of recycling carbon dioxide from the atmosphere by photosynthesis is slow. It is necessary to develop more effective ways to combat the increase of greenhouse carbon dioxide in the Earth's atmosphere.
1. Введение
С целью удержать прирост средней температуры на планете Земля ниже двух градусов из-за накопления углекислого газа в атмосфере, заключено в 2015 году Парижское соглашение. В него входят 159 стран мира.
Разрабатываются меры по снижению выбросов парниковых газов, способы утилизации вторичных энергоресурсов для выработки электроэнергии с целью уменьшения традиционных методов производства электроэнергии
.Рассматриваются возможные области применения углекислого газа в качестве рабочего тела для тепловых двигателей
.Однако мало уделяется внимания естественному процессу утилизации углекислого газа из атмосферы Земли под действием световой энергии – фотосинтеза. Совсем не уделяется внимание другому 3-х атомному газу – воде
. При сжигании углеводородного топлива вода образуется в газообразной форме, причем воды образуется больше, чем углекислого газа. Данная работа посвящена процессу утилизации только углекислого газа. Схемы разложения (поглощения) углекислого газа этими процессами приведены на рисунке 1.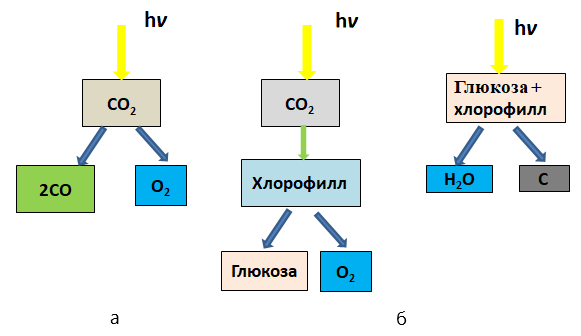
Рисунок 1 - Схема разложения поглощения углекислого газа фотонами солнечного света (а) и поглощения его биосферой (б)
2. Моделирование разложени углекислого газа под действием солнечного света
Разложение происходит по реакции .
Теплота, необходимая для осуществления реакции 1
где ∆Нi; кДж/кмоль – теплота образования i-го вещества . Реакция эндотермическая. В расчете на 1 мг СО2 теплота реакции (1)
Энергия 1 фотона
где h= 6,63∙10-34, Дж∙с – постоянная Планка;
v= с/λ, частота колебаний световой волны, Гц;
с=3∙108, м/с – скорость света в вакууме;
λ= 4∙10-7÷8∙10-7,м-длинна волны света с поверхности Солнца
.Энергия Фотона
Необходимое количество фотонов для утилизации 1 мг СО2 по реакции (1). Для этого делим теплоту реакции ∆Н на энергию фотона hv согласно закону сохранения энергии и степени черноты ε атмосферы Земли
.Период времени выхода одного фотона с Солнца .
Время, необходимое для осуществления реакции (1) в расчете на 1 мг углекислого газа.
Итак, для разложения 1 мг углекислого газа фотонами потребуется 17,1 суток. Поскольку плотность углекислого газа больше плотности воздуха в раза, то углекислый газ в атмосферном воздухе концентрируется около земной поверхности. Концентрация СО2 в атмосферном воздухе 0,034%÷0,036% 8,9.
3. Моделирование процесса превращения СО2 в атмосфере Земли в углерод и кислород в растениях
Основой поглощения углекислого газа растениями является процесс взаимодействия его с водой в присутствии хлорофилла под воздействием фотонов света от Солнца (фотосинтеза).
Реакция фотосинтеза взаимодействия углекислого газа с водой, в присутствии хлорофилла и фотонов солнечного света описывается уравнением реакции с образованием глюкозы и кислорода (вода находится в газообразном состоянии).
где C6H12O6 – глюкоза, μ=180 кг/кмоль. Кислород уходит в атмосферу Земли.
Теплота, необходимая для осуществления реакции (10)
.Реакция эндотермическая.
В расчете на 1 мг теплота реакции (10)
Энергия одного фотона hv=3,978∙10-19, Дж.
Необходимое количество фотонов для превращения 1 мг CO2 по реакции (10) в глюкозу и кислород с учетом степени черноты ε=0,05
.Период времени выхода одного фотона, см (8).
Время, необходимое для превращения 1 мг CO2 по реакции (10) в глюкозу.
Таким образом, при разложении 1 мг CO2 по реакции (10) потребуется 10,5 суток.
Далее следует разложить глюкозу C6H12O6 на углерод и воду, так же в присутствии хлорофилла и света по реакции (11). Тепловой эффект зависит лишь от начального и конечного состояний системы и не зависит от пути процесса, который пока не известен.
Образовавшийся углерод используется растениями для создания тела древесины, а кислород, образовавшийся по реакции 10) поступает в атмосферу Земли. Вода находится в газообразном состоянии.
Тепловой эффект экзотермической реакции (11).
В расчете на 1 мг исходного тепловой эффект реакции (11)
Энергия фотона Е = 3,978∙10-19, Дж, см (6).
Необходимое количество фотонов для осуществления реакции (11) в расчете на 1 мг CO2 с учетом степени черноты атмосферы ε=0,05
.Период времени выхода одного фотона, см. (8).
Время распада 1 мг глюкозы по реакции (11) на углерод и воду.
Реакция (11) следует за реакцией (10). Лимитирует процесс реакция (10), время которой равно 10,5 суток.
4. Экспериментальные исследования влияния фотосинтеза на превращение углекислого газа в кислород и углерод в растениях
Известно, что в воде мирового океана присутствует морская соль в разных количествах и разного состава, растворенные газы – сероводород и другие вещества. В речной воде растворены соли Ca и Mg.
Опыты проводились в колбе из кварцевого стекла объемом 75 мл. Массы загружаемых в колбу воды и хлорофилла измерялись электронными весамиВЛТЭ-150 с погрешностью 0,001 г. Для выпаривания раствора после завершения реакции использовалась электрическая печь СНОЛ-1,6.1,51/3,5-И9. Использовалась вода, насыщенная углекислым газом. Колба с жидкостью облучалась светом от электрической лампы мощностью 100 Вт с отражателем-концентратором света. При обработке результатов опытов учитывалась степень черноты системы.
При нормальных условиях в1 л воды растворяется 1689 мг CO2 при 20ºС и 1атм
Для эксперимента использовалась 0,05 л. воды, в которой растворено
gCO2=1689∙0,05=84,5 мг CO2.
Добавляем 0,01 г хлорофилла. Направляем свет от электрической лампы на колбу.
Образуется глюкоза по реакции (10). Масса образовавшейся глюкозы
Теплота для осуществления реакции (10), когда вода находится в жидком состоянии.
где ∆HH2O - для воды в жидком состоянии.
В расчете на 1 мг СО2 теплота реакции (10)
Необходимая теплота реакции на 1 мг СО2
Теплота для осуществления реакции (11), когда вода находится в жидком состоянии.
В расчете на 1 мг СО2 теплота реакции (11)
Необходимая теплота реакции (11)
Где gCO2=84,5 мг – масса CO2, растворенного в 0,05 л воды.
Необходимое количество фотонов для осуществления реакции (10)
Где εр – результирующая степень черноты системы
.где εc=0,9 - степень черноты стекла
, εв= 0,3 – степень черноты воды , εх = 0,25 – степень черноты хлорофилла.Время для осуществления реакции (10).
Необходимая теплота для осуществления реакции (11).
Необходимое количество фотонов для разложения 1 мг глюкозы по реакции (11) под действием фотонов (фотосинтеза) с учетом степени черноты εр=0,16.
Время, необходимое для разложения глюкозы по реакции (11).
Необходимое время выдержано в эксперименте. Колба помещалась в печь. После выпаривания на дне сосуда появляются хлопья углерода. Масса углерода.
На рисунке 2 представлена фотография результатов преобразования углекислого газа в твердый углерод в водном растворе с хлорофиллом.
Масса углерода определена по разности массы колбы после выпаривания и чистой колбы, замеренной до эксперимента и равна 25,5 мг, в том числе 2,5 мг минеральная составляющая.
На относительную ошибку эксперимента по определению массы образовавшегося углерода, оказывает определение массы gCO2 в растворе. Погрешность эксперимента рассчитывается по методике, изложенной в работе
.Абсолютная погрешность результата косвенных измерений для функции нескольких переменных ∆Z=F(a,b,…)определяется из выражения
Относительная погрешность, %
где - среднее значение результата косвенных измерений Мс =23 мг.
Пусть ∆ - величина абсолютной погрешности измерения массы СО2 в растворе
∆a= ∆gCO2 =2мг.
Масса углерода
где МC6 H12 O6 - масса глюкозы.

Рисунок 2 - Фото кристаллов углерода
5. Заключение
1. Моделирование показало: время разложения 1 мг углекислого газа из атмосферы Земли фотонами солнечных лучей равно 17,1суток; время поглощения 1 мг углекислого газа из атмосферы Земли растениями при помощи фотонов в присутствии хлорофилла составляет 10,5 суток.
2. Эксперименты подтвердили п механизм образования глюкозы из углекислого газа и воды и последующим её разложением на углерод и воду. Общее время расходования 84,5 мг углекислого газа под действием фотонов света равно 224 суткам.
3. Процесс поглощения углекислого газа естественным путем из атмосферы очень медленный. Необходимо искать более эффективные пути борьбы с накоплением парниковых газов в атмосфере.
