A STUDY OF THE EFFECT OF CARBON MONOXIDE ON THE FUNCTIONAL STATE OF THE TRIGEMINAL NERVE
A STUDY OF THE EFFECT OF CARBON MONOXIDE ON THE FUNCTIONAL STATE OF THE TRIGEMINAL NERVE
Abstract
Carbon monoxide (CO) is a member of a family of gaseous mediators, along with nitric oxide (NO) involved in both the regulation of vascular function and the nociceptive process associated with migraine, according to recent literature data. The activity and expression of haemoxygenase, an enzyme that plays a key role in the endogenous release of CO, was increased in various models of neuropathic pain, and administration of inhibitors of this enzyme contributed to the reduction of pain-associated behaviour
. In addition, inhalation administration of CO induced headache in human studies, and expression of haemoxygenase-2 has been shown in 60% of trigeminal ganglion neurons, which is one of the most important nociceptive structures associated with migraine , , . However, the molecular mechanisms of CO involvement in the pathogenesis of migraine are understudied. Therefore, the aim of the work was to identify the mechanisms of CO influence on the nociceptive activity of trigeminal nerve. The electrophysiological method of registration of action potentials (AP) of the rat trigeminal nerve innervating the dura mater in the rat half-cranium preparation was used. It was found that application of CO donor (CORM-2, 30 μM) or CO-saturated solution leads to a significant increase in the activity of trigeminal afferents. Application of a CO synthesis blocker (ZnPP, 10 μM) had no effect on the baseline frequency of nociceptive impulses. Application of a soluble guanylate cyclase inhibitor (ODQ, 10 μM) led to a levelling of the pro-nociceptive effect of CORM-2. The obtained data contribute to the understanding of the role of CO in pain signalling within the pathogenesis of migraine.1. Введение
Ранее, монооксид углерода (CO) считался лишь токсичным газом, но в последние десятилетия появилось множество свидетельств, указывающих на выполнение им ряда физиологических функций. На настоящий момент установлено, что монооксид углерода (CO) является эндогенно продуцируемым сигнальным газотрансмиттером, вовлеченным в ноцицептивный процесс, нейротрансмиссию, церебральную гемодинамику и сосудистый тонус , .
Эндогенный биосинтез CO происходит при разложении гема, осуществляемого специализированным ферментом гемоксигеназой (HO), существующей в двух изоформах: индуцибельной HO-1 и конститутивной HO-2 . Под воздействием любой изоформы этого фермента гем гидролизируется на Fe II (свободное железо), биливердин и угарный газ . HO-1 мало экспрессируется в нервной системе, её активация происходит под воздействием гипоксии, теплового шока и эндотоксинов . HO-2, напротив, широко распространена в нервной системе, экспрессия данной изоформы фермента обнаруживается в коре головного мозга, базальных ганглиях, гиппокампе, гипоталамусе, мозжечке, стволе мозга и спинном мозге, в таких структурах периферической нервной системы как тройничный, клиновидно-небный, верхний шейный и задний корешковый ганглии, которые считаются важными частями ноцицептивной системы, а также в эндотелиоцитах, гладкомышечных клетках и астроцитах , . Примечателен тот факт, что согласно данным, полученным методами иммуногистохимии, экспрессия HO-2 найдена в 60% нейронов тройничного ганглия, активация афферентов которого считается источником болевого сигнала при мигрени , . Также, HO-2 широко экспрессируется в ядре тройничного нерва спинного мозга совместно с НАДФН-диафоразой (является общим маркером для всех трех изоформ NOS), при этом интерес представляют и данные о ко-локализации HO-2 и NOS непосредственно в тройничном ганглии , . Анатомическое распределение HO в структурах ноцицептивных путей, а также его взаимосвязь с «ключевой молекулой» в патогенезе мигрени – оксидом азота (NO), указывают на то, что HO/CO действительно может участвовать в ноцицептивной передаче, что подтверждается фармакологическими, электрофизиологическими и иммуногистохимическими исследованиями. Было показано, что мыши с knock-out по HO-2 демонстрировали сниженное болевое поведение в ответ на инъекцию альгогенов, что проявлялось и в случае мышей, которым был предварительно введен ингибитор гемоксигеназы . Кроме того, системное введение ингибиторов гемоксигеназы приводило к снижению болевых проявлений в ряде моделей боли, таких как воспалительная, нейропатическая и послеоперационная боль , . Имеются и немногочисленные исследования воздействия CO на головную боль у людей. Так, ингаляция монооксида углерода в низкой концентрации испытуемым достоверно приводила к возникновению головной боли по сравнению с контрольной группой . В недавнем исследовании сообщается о развитии у пациентов с мигренью приступов головной боли с большей продолжительностью и интенсивностью (по сравнению со здоровыми добровольцами) вследствие ингаляции CO . Также интересным является тот факт, что у пациентов с мигренью обнаружены повышенные уровни NO и CO в околоносовых пазухах в сравнении со здоровым контролем .
Одним из предполагаемых механизмов вовлечения CO в ноцицептивный процесс при мигрени – это индукция состояния гипоксии . Известно, что состояние гипоксии может провоцировать мигренеподобные боли: под ее воздействием отмечаются индукция головной боли у здоровых добровольцев, и также приступы мигрени у пациентов с мигренью с аурой . Также про-ноцицептивное действие CO может быть связано с активацией сигнального пути рГЦ с последующим синтезом цГМФ . Другой возможный механизм действия CO в менингиальных афферентах – активация сигнального пути рАЦ-цАМФ, тем более что показана способность данного газомедиатора связываться с аденилатциклазой, а аденозиновые рецепторы активно экспрессируются в менингеальных структурах , .
Однако в литературе недостаточно данных о механизмах влияние CO на активность афферентов тройничного нерва. В связи с этим, целью настоящей работы являлся анализ влияния монооксида углерода на ноцицептиную активность тройничного нерва и выявление возможных механизмов такого влияния.
2. Методы и принципы исследования
Электрофизиологическая методика регистрации электрической активности афферентов тройничного нерва (регистрация потенциалов действия)
Экспериментальные процедуры были проведены согласно методике, опубликованной нами ранее в ряде работ , . В качестве экспериментальных животных использовались самцы крыс Wistar, возраст которых составлял ~1,5 месяца (P 40-45, где P – день от начала постнатального развития животного). Использованные экспериментальные протоколы не противоречат этическим нормам по гуманному обращению с животными, принятыми в КФУ, и были официально одобрены Локальным этическим комитетом КФУ (протокол №33 от 25.11.2021). Для локального изучения электрических сигналов, возникающих в периферическом отделе тройничного нерва, использовали препарат изолированного черепа крысы, представляющий собой половину черепа с удаленным головным мозгом , , . После декапитации экспериментального животного (проводится при ингаляционной анестезии изофлураном 3%), производилось тщательное очищение черепной коробки крысы от мягких тканей. Далее череп разделяли продольным (саггитальным разрезом), производили аккуратное извлечение головного мозга при помощи пинцета, оставляя неповрежденной твердую мозговую оболочку (dura mater). Ветви тройничного нерва (nervus spinosus), иннервирующие среднюю менингеальную артерию, также сохраняли нетронутыми в твердой мозговой оболочке. Препарат постоянно перфузировался физиологическим раствором следующего состава (в мМ): NaCl 120, KCl 2.5, CaCl2 2, MgCl2 1, глюкоза 11, Na2HPO4 1, NaHCO3 24, рН 7.1–7.3 с постоянной аэрацией карбогеном (O2 95%/CO2 5%). Регистрирующие электроды были изготовлены из боросиликатных заготовок фирмы «Sutter Instruments», диаметр наконечников электродов составлял 150 мкм. Перед началом эксперимента стеклянный электрод закрепляли в манипуляторе, подключенному к усилителю электрического сигнала. При визуальном осмотре периферическая часть тройничного нерва - nervus spinosus (ветвь V1 тройничного нерва), иннервирующая среднюю менингеальную артерию, отсекалась от твердой мозговой оболочки и помещалась в стеклянный регистрирующий электрод. Потенциалы действия (ПД) регистрировались с помощью усилителя DAM 80 (World Precision Instruments, Sarasota, FL, USA). Регистрировалась начальная (базовая) электрическая активность тройничного нерва. Затем в область расхождения средней менингеальной артерии вводили интересующие нас активные вещества и регистрировали их действие в течение 20-40 мин. Далее происходила оцифровка полученных сигналов на ПК с использованием платы NI PCI6221 (National Instruments, Austin, TX, США). Визуализация и анализ сигналов производились с использованием программного обеспечения WinEDR v.3.2.7 (University of Strathclyde, Glasgow, Великобритания). Данная модель регистрации периферических ноцицептивных сигналов показала свою эффективность и достоверность во множестве проведенных нами исследований , . Кроме того, ее неоспоримыми достоинствами являются сохранность морфологии менингеальных тканей, возможность точного контроля аппликации исследуемых веществ, а также регистрация исключительно периферической ноцицептивной импульсации, что позволяет получать достоверные и точные данные о возможных молекулярных механизмах, вовлеченных в патогенез мигрени , . Частота рассчитывалась как количество ПД за 5 мин.
Компьютерная и статистическая обработка экспериментальных данных
Данные обрабатывались с помощью программы MATLAB (MathWorks, США). Ориентиром для определения ПД служит форма и параметры сигнала (двухфазный сигнал, длительностью в пределах 0.3-1.5 мс и амплитудой от 20 до 150 мкВ). Для того чтобы выявить краткосрочный эффект действия веществ во время статистической обработки, полученные экспериментальные данные разделялись на 2 и 5 мин интервалы. В качестве контроля для сравнения с эффектом вещества использовались данные, записанные непосредственно перед подачей вещества.
Статистический анализ проводили с помощью программного обеспечения Origin Pro (OriginLab Corporation, Northampton, MA, США), MATLAB (The MathWorks, Inc., Natick, MA, США) и GraphPad Prism 4.0 (GraphPad Software, Inc., San Diego, CA, США). Нормальность распределения выборки определяли при помощи F-теста Фишера и критерия Шапиро-Уилка. Достоверность различий оценивали с помощью t-критерия Стьюдента. Различия считали статистически значимыми при р <0.05; n – количество животных. В тексте данные представлены как среднее и SE, где SE – стандартная ошибка.
3. Основные результаты
Многочисленные данные указывают на то, что головные боли при мигрени возникают в результате активации окончаний тройничного нерва в мозговых оболочках с последующей сенсибилизацией нейронов . Для анализа роли экзогенного CO в регуляции активности тройничного нерва использовали химический экзогенный донор, CORM-2 (30 мкМ) и физиологический раствор Кребса, насыщенный CO путем аэрации. В отдельной серии экспериментов была проведена аппликация блокатора гемоксигеназы, цинка протопорферина, ZnPP, с целью выявления роли эндогенного CO в базовой электрической импульсации афферентов тройничного нерва.
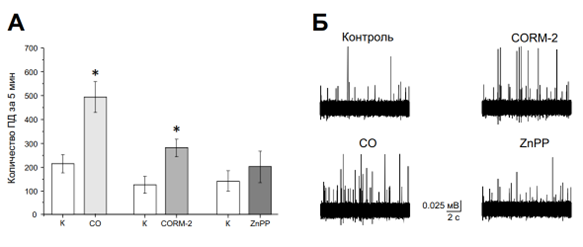
Рисунок 1 - Влияние экзогенного CO и блокатора синтеза CO на частоту потенциалов действия в афферентах тройничного нерва крысы
Примечание: А – средняя частота ПД за 5 минут в контроле и после аппликации CORM-2 в концентрации 30 мкМ; после применения физиологического раствора, насыщенного CO; после аппликации блокатора HO (гемоксигеназы) ZnPP в концентрации 10 мкМ; Б – примеры записи ПД в контроле и при использовании исследуемых соединений в вышеуказанных концентрациях; (p<0.05, t-test)
Предварительная инкубация в растворе, содержащем цинк протопорферин, ZnPP, показала, что эндогенный синтез СО не участвует в формировании базовой активности в афферентах тройничного нерва крысы. В контроле частота составила 141.25±43.9 ПД за 5 мин; после аппликации ZnPP на пятой минуте частота составила – 195.6±72.5 ПД за 5 мин; на 10 минуте – 201.6±66.6 ПД за 5 мин; на 15 минуте – 125.6±40.9 ПД за 5 мин (n=5; см. рисунок 1).
Для выявления роли рГЦ-цГМФ и рАЦ-цГМФ сигнальных путей в активизирующем действии CO на афференты тройничного нерва был использован ингибитор гуанилатциклазы, ODQ (10 мкМ), c последующей аппликацией CORM-2 (30 мкМ), а также специфический ингибитор аденилатциклазы, MDL 12,330A (10 мкМ), c последующей аппликацией CORM-2 (30 мкМ).
Было показано, что ODQ (10 мкМ) не оказывает влияния на базовую импульсацию в афферентах тройничного нерва крысы. Базовая частота ПД в тройничном нерве составила 187.5±86.2 ПД за 5 мин и 172.5±30.1 ПД за 5 мин после 20 минутной инкубации в ODQ (10 мкМ) (n=4; р> 0.05). Последующее добавление CORM-2 (30 мкМ) не вызывало достоверного изменения частоты ПД и к 10 мин аппликации частота ПД составила 145.2±47.3 ПД за 5 мин и к 15 мин – 129.7±50.8 ПД за 5 мин; 20 мин 127.1±40.3 ПД за 5 мин (n=4; p > 0.05; см. рисунок 2).
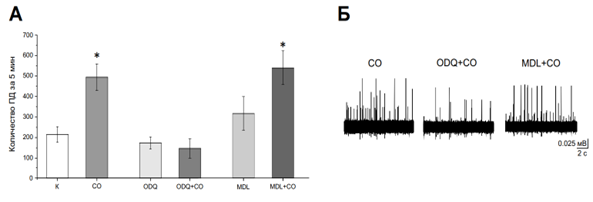
Рисунок 2 - Сравнение действия экзогенного донора CO в контроле и на фоне ингибиторов растворимой гуанилатциклазы и аденилатциклазы
Примечание: А – средняя частота ПД за 5 минут в контроле и после аппликации CORM-2 (30 мкМ) на фоне ингибитора гуанилатциклазы ODQ в концентрации 10 мкМ или на фоне ингибитора аденилатциклазы MDL в концентрации 10 мкМ; Б – примеры записи ПД в контроле и при использовании исследуемых соединений в вышеуказанных концентрациях; (p< 0.05, t-test)
4. Обсуждение
Исследование периферических механизмов мигрени играет важную роль в последующей разработке новейших методов терапии, для которых характерно специфическое и направленное действие непосредственно в место генерации болевого сигнала. Структуры тройнично-сосудистой (тригемино-васкулярной) системы, такие как менингеальные сосуды, твердая оболочка головного мозга, чувствительные окончания тройничного нерва и тучные клетки являются перспективным объектом для изучения ввиду их фундаментальной роли в возникновении ноцицептивных сигналов при мигрени и других головных болях. В нашей работе, мы фокусируемся на исследовании активности афферентов тройничного нерва в твердой мозговой оболочке – по современным представлениям, именно они в большей степени отвечают за возникновение изначального болевого сигнала при мигрени и осуществляют сбор, анализ и обработку ноцицептивной информации от черепных структур, а потому являются перспективной мишенью для лекарственного и терапевтического воздействия с целью профилактики/лечения мигрени , . Известно, что электрическая стимуляция области тригеминоцервикального комплекса сопровождается увеличением частоты ПД и возникновением мигренеподобных головных болей , . Таким образом, в используемой нами методике, частота ПД в афферентах тройничного нерва соотносится с болевой импульсацией, а увеличение частоты ПД – с про-ноцицептивными эффектами исследуемых веществ , .
1. Монооксид углерода реализует про-ноцицептивный эффект в афферентах тройничного нерва крысы. СО, угарный газ, является представителем семейства газомедиаторов, наряду с NO, оксидом азота, и H2S, сероводородом, роль которых в физиологических функциях и ноцицептивных процессах активно изучается на протяжении последних десятилетий. Однако, среди газомедиаторов, CO является наименее изученным, и особенный недостаток доступных литературных данных отмечается в контексте роли CO в возникновении головных болей. Однако, ряд источников указывает на участие CO, и эндогенного фермента его биосинтеза, гемоксигеназы (HO) в формировании болевых сигналов, что было продемонстрировано на различных специфических моделях боли. Кроме того, немногочисленные исследования указывают и на возможное вовлечение CO в патогенез мигрени.
Исследование возможного участия HO и продуцируемого ей CO в ноцицептивном процессе началось в 90-е годы 20-го столетия. Тогда было выявлено, что интратекальное введение неспецифического ингибитора HO, цинка протопорфирина ZnPP приводило к уменьшению механической аллодинии в задних лапах крыс индукции воспаления внутриподошвенной инъекцией зимозана или интратекальной инъекцией агонистов глутаматных рецепторов, либо введения формалина в задние лапы , . В начале 00х годов 21-го века, было показано, что ингибирование HO способствовало анти-ноцицептивным эффектам в таких моделях боли, как воспалительная, нейропатическая и послеоперационная, кроме того, выявлено, что анальгетическое влияние ингибирования гемоксигеназы опосредовано центральными, а не периферическими механизмами , , , .
Немалый интерес представляют и данные, полученные на рекомбинантных мышах с knock-out по HO-2 (гемоксигеназе-2). Фокус внимания на именно гемоксигеназе-2 обусловлен предположением, что продуцируемый HO-2 CO оказывает про-ноцицептивные эффекты, тогда как CO, происходящий из HO-1 демонстрирует анальгезирующие и анти-воспалительные эффекты во множестве исследований .
В пользу участия CO в патогенезе мигрени свидетельствует следующий немногочисленный ряд исследований. Во-первых, у пациентов с мигренью обнаружены повышенные уровни NO и CO в околоносовых пазухах в сравнении со здоровым контролем . Во-вторых, ингаляция CO (22% карбоксигемоглобин) в течение 2‑х дней на протяжении 10 минут вызывает длительную головную боль сочетаемую с увеличением кровотока кожи лица у здоровых добровольцев с частотой 83%, что аналогично эффективности индукции головной боли донором NO – нитроглицерином (данный метод является широко используемым и высокоэффективным при исследовании мигрени) , . Однако, отмечена разница в головной боли, вызванной CO и NTG - головная боль от CO усилилась через 3,5–6 часов после последней ингаляции CO, а средняя продолжительность головной боли составила 3,5 часа (диапазон от 20 минут до 11 часов). Напротив, GTN вызывает только немедленную головную боль во время 20-минутной инфузии у здоровых добровольцев и отсроченную мигренеподобную головную боль у пациентов с мигренью , , . В-третьих, при ингаляции CO (22% карбоксигемоглобин) у пациентов с мигренью также развивалась либо более сильная головная боль, по сравнению с применением плацебо, либо мигренеподобные приступы, однако, эти приступы головной боли не соответствовали критериям мигрени .
В нашем исследовании, и применение физиологического раствора, насыщенного CO, и аппликация донора CO CORM-2 (30 мкМ) достоверно увеличивали электрическую активность афферентов тройничного нерва, в то время как применение ингибитора HO ZnPP не оказывало влияние на базовую частоту электрических сигналов. Полученные данные свидетельствует о том, что ферментные системы синтеза эндогенного СО не вносят вклад в базовую электрическую активность в афферентах тройничного нерва, тогда как экзогенный СО проявляет про-ноцицептивные свойства в системе тройничного нерва крысы. Это согласуется с описанными выше исследованиями, демонстрирующими про-ноцицептивную роль CO в различных моделях боли и его способность вызывать мигренеподобные приступы или головную боль как у здоровых добровольцев, так и у пациентов с мигренью.
2. Про-ноцицептивный эффект CO в афферентах тройничного нерва реализуется посредством активации сигнального пути гуанилатциклазы. Сигнальный путь рГЦ/цГМФ известен своим вовлечением в патологические механизмы боли, особенно в контексте про-ноцицептивных эффектов NO . Однако, по некоторым данным, эффекты CO также могут быть обусловлены активацией им гуанилатциклазы с последующим синтезом цГМФ. Во-первых, в глутаматной модели боли, в которой после инъекции глутамата наблюдается повышение экспрессии цГМФ в спинном мозге, применение ингибитора HO приводило к нивелированию повышения экспрессии цГМФ, аналогичный эффект наблюдался и у нокаутных по HO-2 мышей . Во-вторых, ряд исследований с применением химических методов анализа непосредственно демонстрирует способность CO эффективно связываться с рГЦ, хоть в меньшей степени, чем это делает NO , . В-третьих, морфологические исследования показывают, что нейроны, экспрессирующие HO-2, экспрессируют высокие уровни растворимой гуанилилциклазы (sGC) во многих областях мозга , . CO может увеличивать выработку цГМФ в срезах спинного мозга и тем самым регулировать высвобождение глутамата , . В-четвертых, схожие эффекты на сосудистый тонус (вазодилатация), оказываемые двумя газообразными мессенджерами – CO и NO, указывают на возможность одинакового механизма действия и вовлечения одного и того же сигнального пути .
Действительно, в нашем исследовании, применение селективного ингибитора гуанилатциклазы ODQ нивелировало про-ноцицептивный эффект донора CO, CORM-2; в то время как на фоне применения ингибитора аденилатциклазы MDL активизирующий эффект CORM-2 на электрическую импульсацию афферентов тройничного нерва оставался неизменным. Полученные данные согласуются с вышеперечисленными данными и демонстрируют, что про-ноцицептивный эффект CO в афферентах тройничного нерва в менингеальных оболочках крысы реализуется через активацию рГЦ с последующим синтезом цГМФ, который вовлечен в пути проведения боли .
5. Заключение
В нашем исследовании мы показали про-ноцицептивную роль монооксида углерода (СО) в механизмах мигрени, которая, возможно, связана с прямой активацией рГЦ. Представленный механизм может способствовать повышению возбудимости в периферических афферентах тройничного нерва, и, как следствие обеспечивать длительную болевую импульсацию в тройничном нерве. Выявленные нами молекулярные механизмы действия СО могут быть использованы в качестве терапевтических мишеней для разработки препаратов для лечения и/или профилактики мигрени.
