A CLUSTER ANALYSIS OF ARTICULAR CARTILAGE TISSUE STRUCTURES IN EXPERIMENTAL OSTEOARTHRITIS IN RATS
A CLUSTER ANALYSIS OF ARTICULAR CARTILAGE TISSUE STRUCTURES IN EXPERIMENTAL OSTEOARTHRITIS IN RATS
Abstract
Osteoarthritis is a common degenerative joint disease. The use of clustering algorithms in studies of both articular cartilage and other tissues can increase the accuracy and objectivity of experimental results. Therefore, the aim of this work was to conduct a pilot study on the use of cluster analysis to identify tissue structures of articular cartilage in normal and experimental osteoarthritis in rats. Pilot experiments using cluster analysis of articular cartilage chondrocytes identified statistically significant changes in cells in the calcified zone, as well as changes in their spatial organization throughout the cartilage tissue of the tibial plateau between the intact state and experimental osteoarthritis. Visualization of the cluster analysis results also showed that there was a spatial redistribution in experimental osteoarthritis compared to the intact state.
1. Введение
Остеоартроз (ОА) является одним из самых распространённых заболеваний, им страдает свыше 200 миллионов человек в мире и наблюдается неуклонная тенденция к возрастанию частоты ОА , , . В настоящие время активно разрабатываются методы и способы лечения ОА , . . Одним из этапов доказательности результатов той или иной технологии является проведение морфологического анализа суставного хряща коленного сустава для оценки эффективности. Традиционно такая оценка производится экспертным методом, что может вносить значительную субъективность и человеческий фактор при интерпретации результатов.
В настоящее время актуальной является разработка алгоритмов применяемых к изображениям гистологических препаратов с целью повышения эффективности их анализа . Одним из таких подходов является компьютерная кластеризация с помощью которой можно унифицировано разделить суставной хрящ на зоны и выделить клеточные элементы. В независимости от метода кластеризации обязательным является правильный подбор параметров, которые могут описывать как сам объект, так и его окружение с учетом специфики ткани. Возможность использования комбинации флуоресцентных красителей и конфокальной микроскопии позволяет получать высококонтрастные изображения, где клеточные элементы и тканевые структуры легко идентифицируются за счет выраженных границ . Это в свою очередь упрощает получение количественных параметров для кластерного анализа и его работы. При этих достоинствах, конфокальная микроскопия является очень дорогостоящей и трудоемкой. В большинстве гистологических лабораторий применяют «стандартные» методы окраски. В связи этим в данной работе акцент сделан на применении кластерного анализа для изучения тканевых структур на примере хрящевой ткани при окраске гематоксилином и эозином.
Целью данной работы стало проведение пилотного исследования по использованию кластерного анализа для выявления тканевых структур суставного хряща в норме и при экспериментальном ОА у крыс.
2. Методы и принципы исследования
Образцы суставного хряща были взяты у 12 белых крыс самцов линии Wistar, массой 250–300 г. Все манипуляции проводили в соответствии с этическими нормами, изложенных в «Правилах проведения работ с использованием экспериментальных животных» и директиве 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях. Выведение животных осуществляли с помощью внутрибрюшинного введения десятикратной дозы препарата «Рометар», Россия (200 мг/кг массы). В работе было сформировано 2 группы по 6 животных: интактная (интакт) и с экспериментальным ОА (ОА3), моделирование которого осуществлялось путем внутрисуставного введения суспензии стерильного медицинского талька («АГАТ-МЕД», Россия) . Животных из эксперимента выводили через 3 недели. Все работы с материалом, включая окраску гематоксилином и эозином, осуществлялись по общепринятому протоколу. Фотопротоколирование микроскопических изменений производили с использованием микроскопа Микмед-5 при увеличении 20х, специализированной камеры ToupCam и программного обеспечения ToupCamView. Анализ изображений участков суставного хряща шириной 100 мкм осуществляли с использованием программы в свободном доступе Fiji v. 2.14.0 (National Institutes of Health, США) . Для оценки степени развития ОА использовали бальную шкалу OARSI .
Для выявления зональной структуры и группировки хондроцитов на кластеры учитывали их площадь, периметр, длину, ширину и положение центра по X и Y осям, с целью определения локализации этих клеток относительно глубины суставного хряща. При подсчете этих параметров суставной хрящ располагался так, чтобы поверхностная зона находилась снизу, а его глубокая зона – сверху. Так, наименьшие значения по оси Y принимали центры тех клеток, которые располагались ближе к поверхности хряща. Для кластеризации был использован метод к-средних. Все клетки, в пределах участка шириной 100 мкм, разделялись на 4 кластера, которые представляли собой 4 зоны суставного хряща: 1 — поверхностная; 2 — промежуточная; 3 — глубокая; 4 — кальцинированная. Кластеризацию проводили по всем измеряемым параметрам. Для начального положения центров кластеров задавали значение k-means++ и проводили 12 итераций. Полученные кластеры каждого участка визуализировали по трем параметрам с помощью библиотеки matplotlib.
Количественные данные обрабатывали с помощью программы Statistica 12.0 (StatSoftInc., США) с расчетом медианы, 1-ого квартиля и 3-ого квартиля. Для оценки достоверности различий был применен критерий Манна-Уитни (p <0,05).
3. Основные результаты и обсуждение
У интактных крыс отсутствовали какие-либо повреждения суставного хряща, а именно суставные поверхности имели гладкий рельеф и четкие границы всех исследуемых зон (оценка по шкале OARSI — 0 баллов). Через три недели после введения медицинского талька выявлялись значительные повреждения суставного хряща коленного сустава. Было зафиксировано частичное или полное разрушение хрящевой ткани, множество гипертрофированных хондроцитов, а также сильное изменение рельефа суставной поверхности, а также образование новых Гаверсовых каналов (оценка по шкале OARSI — 2–3 балла).
В результате анализа изображения суставного хряща в норме и при экспериментальном ОА были получены значения каждого из исследуемых параметров для каждого кластера. Статистический анализ показал достоверные различия у ряда параметров 4 кластера между суставным хрящом интактной группы и экспериментального ОА (рис. 1). В других кластерах статически значимых различий параметров клеточных элементов обнаружено не было (p >0,05).

Рисунок 1 - Исследуемые параметры 4 кластера (кальцинированной зоны) суставного хряща в норме и при экспериментальном ОА через 3 недели
После проведения кластеризации, выявленные кластеры и клеточные элементы, включенные в них, сравнивали по качеству распределения и соответствия структурным зонам суставного хряща (рис. 2).
У большинства интактных животных распределение на кластеры соответствовало нормальной пространственной организации клеток в зонах суставного хряща. При экспериментальном ОА нарушалась слоистая структура хряща и кластеры распределялись неравномерно, а также наблюдалось их перемешивание. Этому могло способствовать разрушение суставного хряща, его кальцификация и гибель хондроцитов с характерным фенотипом. В результате алгоритм кластеризации распределял оставшиеся клеточные элементы на четыре кластера, в то время как четвертый кластер, соответствующий кальцинированной зоне, имел значительные изменения.
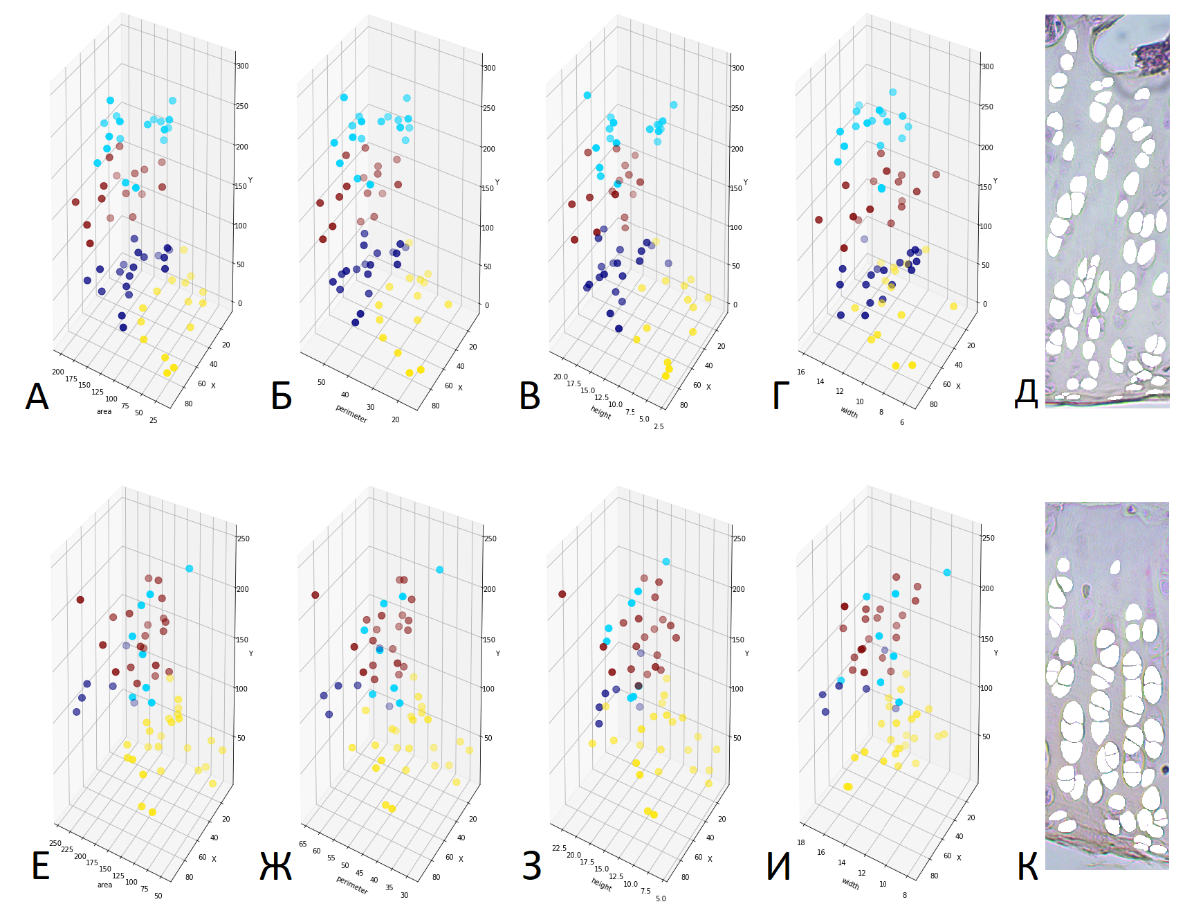
Рисунок 2 - Кластеризация хондроцитов суставного хряща тибиального плато крыс интактной группы (А-Д) и группы с ОА (Е-К) на 4 структурные зоны по параметрам X и Y положения центра клеток, площади, периметра, высоты и ширины клеток с визуализацией в трех плоскостях
Примечание: А и Е - ось X – это площадь клеток, ось Y – положение клеток по оси Y в суставном хряще, а ось Z – положение клеток по оси X в суставном хряще; Б и Ж - ось X – это периметр клеток, ось Y – положение клеток по оси Y в суставном хряще, а ось Z – положение клеток по оси X в суставном хряще; В и З - ось X – это высота клеток, ось Y – положение клеток по оси Y в суставном хряще, а ось Z – положение клеток по оси X в суставном хряще; Г и И - ось X – это ширина клеток, ось Y – положение клеток по оси Y в суставном хряще, а ось Z – положение клеток по оси X в суставном хряще; Д – участок суставного хряща тибиального плато интактной группы в увеличении 20х, с которого были получены и представлены данные по указанным параметрам (А-Г); К – участок суставного хряща тибиального плато при ОА в увеличении 20х, с которого были получены и представлены данные по указанным параметрам (Е-И). Голубым цветом обозначены кластеры кальцинированной зоны; красным – глубокой; синим – промежуточной; желтым – поверхностной
Принципиальный вклад в распределение на кластеры вносили те параметры, значения которых значительно отличались друг от друга среди объектов. Так, если из большого количества объектов только несколько имели высокое значение площади, они выносились в отдельный кластер, поэтому включение такого параметра могло привести к отрицательным результатам.
4. Заключение
Таким образом, в ходе исследования проведены пилотные опыты по использованию кластерного анализа для выявления структурных изменений суставного хряща тибиального плато в норме и при экспериментальном остеоартрозе. В результате были выявлены изменения параметров хондроцитов четвертого кластера, соответствующего кальцинированной зоне суставного хряща. Визуализация результатов кластерного анализа показала, что при экспериментальном остеоартрозе через 3 недели происходит изменение кластеров и их пространственного распределения по сравнению с интактным состоянием.
Результаты пилотного исследования применения кластерного анализа могут быть использованы для дальнейшего изучения суставного хряща и других тканей, с учетом применения или оптимизации уже существующих алгоритмов в зависимости от целей и задач исследования.
