STUDY OF THE FERRITIZATION PROCESS IN OXIDE SYSTEMS Fe2O3-NiO-CoO-MoO3 AND TECHNOLOGY DEVELOPMENT OF COMPLEX OXIDES
STUDY OF THE FERRITIZATION PROCESS IN OXIDE SYSTEMS Fe2O3-NiO-CoO-MoO3 AND TECHNOLOGY DEVELOPMENT OF COMPLEX OXIDES
Abstract
Maraging steels are ultrapure alloys and are characterized by a precise chemical composition, absence of impurities and defined structures. These steels can be produced by using alloyed steel powders and their further compaction, and compaction should be carried out with techniques that promote diffusion processes and prevent the presence of residual porosity in the structure.
It is shown that all existing methods, except the synthesis of complex oxides and subsequent reduction, are not suitable for obtaining maraging steel powders. The mechanism and kinetics of ferritization in Fe2O3-NiO-CoO-MoO3 oxide system at interaction of different quantities of components were revealed by derivatographic method. The process of synthesis of complex oxides was justified and the efficient technology for obtaining alloyed oxide powders with solid solution structure which can be a raw material for obtaining martensitic aging steel powders with ultrapure chemical composition, the required structure and high mechanical and technological properties was developed.
1. Введение
Развитие современной техники диктует необходимость создания материалов с требуемыми свойствами, особенно высокой прочностью и пластичностью. Особую роль здесь играет ударная вязкость как структурно-чувствительное свойство. При наличии комплекса указанных свойств повышаются предел текучести материала, усталостная прочность, а также способность работать при переменных нагрузках. К числу таких перспективных материалов относятся мартенситно-стареющие стали, которые используются в транспортной технике, приборостроении, атомной энергетике, военной промышленности и т.д. [1], [2], [3], [4]. В отличие от углеродистых сталей, мартенситно-стареющие стали более устойчивы к хрупкому разрушению, особенно при отрицательных температурах. Эти стали хорошо поддаются обработке резанием, легко деформируются и подвергаются термической обработке [2], [3], [5], [7].
Получение сталей мартенситного старения наиболее целесообразно методами порошковой металлургии, что объясняется не только их технико-экономическими показателями, но и возможностью получить мелкозернистую структуру, высокие физико-механические, технологические и эксплуатационные свойства. Проблема в том, что при производстве этих сплавов традиционными металлургическими методами он загрязняется вредными примесями, особенно углеродом, водородом, кислородом, азотом, серой и фосфором. Кроме того, в процессе кристаллизации в нем формируется слоистая структура, что и является основным препятствием для широкого применения этих сплавов. Однако ограниченность производства порошков легированных металлов, в первую очередь на основе железа, не позволяет расширить количество порошковых композиционных материалов, которое в общем объеме производства металлических порошков составляет 2,5% (в СНГ) [4].
Республика Армения богата полиметаллическими минералами, наличие которых является основой для производства металлических порошков и порошковых композиционных материалов на их основе, в том числе мартенситно-стареющих порошковых сталей. Исключительную ценность представляют минералы молибдена, содержащие не только железо, но и природные легирующие элементы, в частности рений.
Исходя из вышеизложенного, целью работы является исследование механизма и кинетики процесса ферритизации в оксидной системе Fe2O3–NiO–CoO–MoO3 и разработка технологии получения сложных оксидов с целью получения высокопрочных мартенситно-стареющих стальных порошков.
2. Постановка задачи и обоснование методики
Мартенситно-стареющие стали относятся к группе сверхчистых сплавов, т.е. характеризуются точным химическим составом, отсутствием полостей и определенной структурой [8]. С этой точки зрения, выбор технологии получения мартенситно-стареющих сталей должен способствовать решению следующих требований:
1) получение легированных металлических порошков, а не механическое смешение компонентов с целью получения однородной структуры;
2) уплотнение легированных металлических порошков путем получения продукции, что способствует диффузионным процессам и предотвращает наличие остаточной пористости в структуре.
Известно [5], [6], [7], [9], что твердые растворы оксидов могут быть получены из оксидных соединений, если они изоморфны и металлы имеют одинаковые ионные радиусы. В целом синтез оксидов возможен, если один из них кислотный (Fe2O3, Cr2O3, TiO2, MoO3, Re2O7 и т.д.), а другой - щелочной (CuO, FeO, NiO, CoO, ZnO и т.д.). Щелочной оксид двухвалентного металла и кислотный оксид трехвалентного металла могут взаимодействовать друг с другом с образованием особых соединений: ферритов, молибденитов, титанидов, хромитов и т.д.
Ферриты представляют собой ионные соединения, в которых анионом является кислород (O2-). Они располагаются в узлах кристаллических сеток, а внутри них - положительно заряженные катионы (Me2+, Fe3+). При твердофазных реакциях происходит диффузия катионов Me2+, Fe3+, а анионы O2- остаются неподвижными [4], [9].
Для мартенситно-стареющих сталей большой интерес представляетсистема Fe2O3-NiO,которая также является основой ряда магнитомягких сплавов. На рис. 1 представлена диаграмма состояния этой системы, согласно которой шпинельный диапазон находится между точками 68,1% Fe2O3 и 31,9% NiO вне пределов стехиометрии. Отсюда можно сделать вывод, что избыточные компоненты системы растворяются в NiFe2O4, который синтезируется выдержкой при 1250...1300°С в течение 3 часов (рис. 2). Как видно, N и Fe2O3не образуют твердого раствора NiFe2O4. Феррит NiFe2O4 содержит 25,1 % Ni, а после восстановления - 34,5 % Ni.
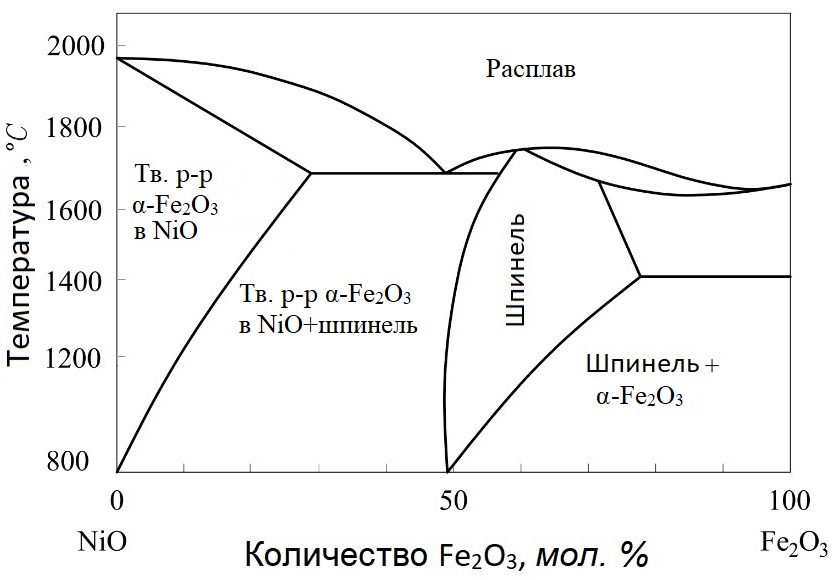
Рисунок 1 - Диаграмма состояния компонентов NiO-Fe2O3
В результате синтеза оксидов Fe2O3 и CoO, который проводился при температурах 1100...1200°С в течение 3...4 часов, был получен феррит CoFe2O4. Данный синтез очень похож на синтез компонентов Fe2O3-NiO. Так как содержания Ni и Co в системах NiFe2O4 и CoFe2O4 достигают 25,1%, а в сплавах Fe-Ni и Fe-Co - 34,5%, следовательно, для получения гомогенного сплава Fe2O3-NiO-CoO необходимо брать 31,9% NiO+CoO. Это обеспечит 34,5%-ное суммарное содержание Ni и Со в системе Fe-Ni-Co. Как известно из [2], [3], концентрация Ni в мартенситно-стареющих сталях колеблется в пределах 15...20%, а концентрация Со - 5...15%. Эти композиции, безусловно, можно получить с помощью технологии синтеза сложных оксидов.
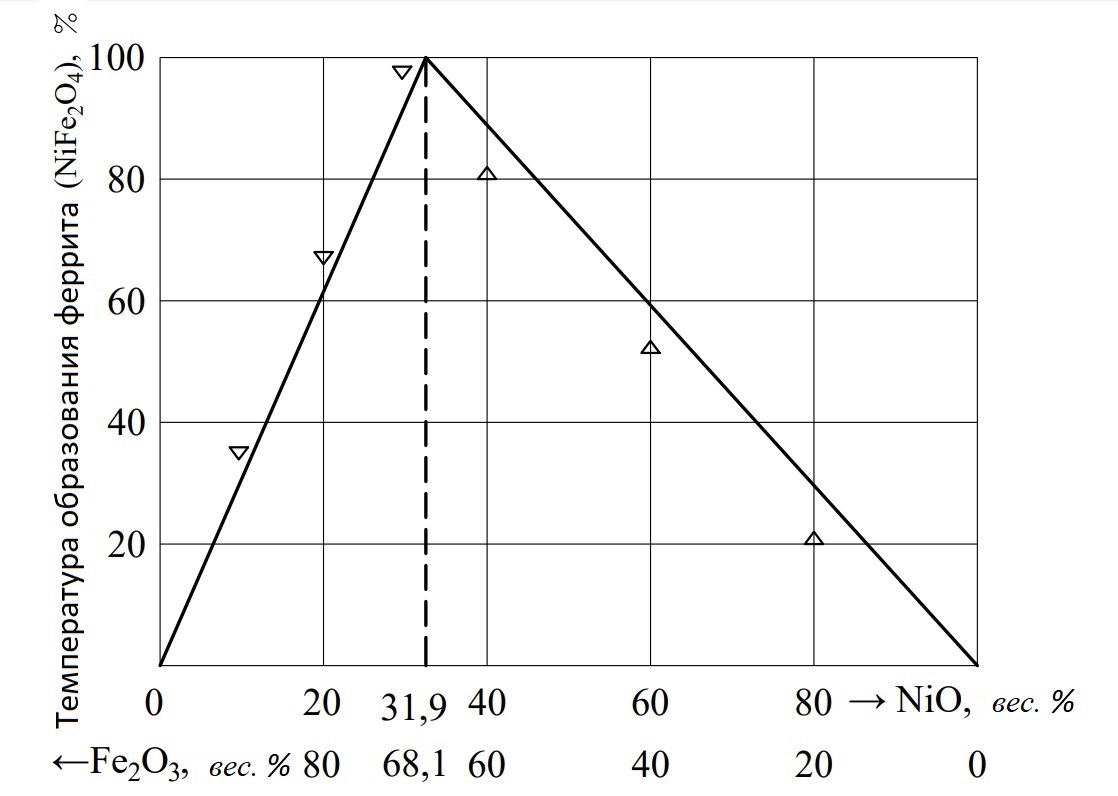
Рисунок 2 - Зависимость степени ферритообразования NiFe2O4 от соотношения NiO/Fe2O3
Примечание: сплошная линия - расчетная, а точки - экспериментальные
Поскольку оксиды Fe2O3 и MoO3 являются кислотными, синтез системы, составленной из них, представляет определенные трудности [10]. В [11], [12] представлен механизм образования двойных оксидов Fe и Мо, где изучено возможное протекание реакций
Массы оксидов Fe и Mo рассчитывали по стехиометрическим количествам, затем смешивали, после чего подвергали синтезу в среде аргона. Ферритизацию проводили при 650...900°С в течение 6...9 часов. Процесс протекал по реакции (1), приводя к 100% ферритизации. Ферритизация протекает быстрее при температурах 800...850°С, что связано с плавлением MoO3. В результате экспериментов не удалось получить молибденит по реакции (2). Также был проведен синтез оксидов Fe2O3-MoO3 и получены те же результаты, что и в случае FeO+MoO3. Аналогичные результаты были получены и в работах [5], [13]. Синтез проводили в течение 3...4 часов в интервале температур 600...1000°С. Исследован диапазон MoO3 до стехиометрического состава (до 47,4% MoO3). Степень ферритизации составила 3...6%, которую можно повысить за счет увеличения степени чистоты сырья, создания и наличия микропокрытий.
В результате исследований установлено, что синтез компонентов в системе Fe2O3-CoO-NiO-MoO3-NH4Cl осуществляется по простой схеме: газофазный метаболизм реализуется в присутствии NH4Cl, что, в свою очередь, способствует ферритообразованию. Также происходит процесс превращения оксидов в оксихлориды, который повышает реакционную способность последних и, следовательно, активизирует процесс синтеза. Наряду с основными реакциями протекают и вторичные реакции, в ходе которых образуются твердые растворы. Такими реакциями являются
где CoMoO4 - природный минерал цеолит, а Me - Ni+Co.
Для оценки реакций, протекающих в исследуемой системе, были проведены термодинамические расчеты. По формуле рассчитана энергия Гиббса для нормальных условий. Полученные результаты подтверждают, что в исследованном интервале температур протекают реакции хлорирования и происходит синтез оксидов. В результате образуются твердые оксидные растворы и сложные шпинельные оксиды:
3. Результаты исследования
С целью обоснования температурного диапазона, синтеза и выявления кинетики сложных оксидов системы Fe2O3-CoO-NiO-MoO3 были проведены комплексные термогравиметрические (ТД) исследования. Исследования проводились с учетом возможных вариантов оксидов в системе. Количество компонентов (оксидов) исходной шихты подбирали таким образом, чтобы в результате восстановления сложного оксида, полученного после синтеза, был получен мартенситно-стареющий стальной порошок состава 18%Ni+10%Co+5%Mo+Feостаток. Результаты экспериментов представлены на рис. 3 - 7. Все эксперименты проводились с при одних и тех же режимах, включая T=293...1473K, TG = 500 и 250 мкВ, DTG = 1 мкВ, DTA = 100 мкВ, VT = 7,5 и 150C/мин.
Перед изучением процесса синтеза сложного оксида были исследованы его отдельные компоненты и их взаимодействие друг с другом. На рис. 3 представлены результаты термогравиметрических исследований NH4Cl, в которых заметны эндотермические эффекты. Они проявляются на кривой DTA в интервалах температур 160...2150C и 260...4920С и имеют точки минимума, соответствующие 1850C и 352°С.
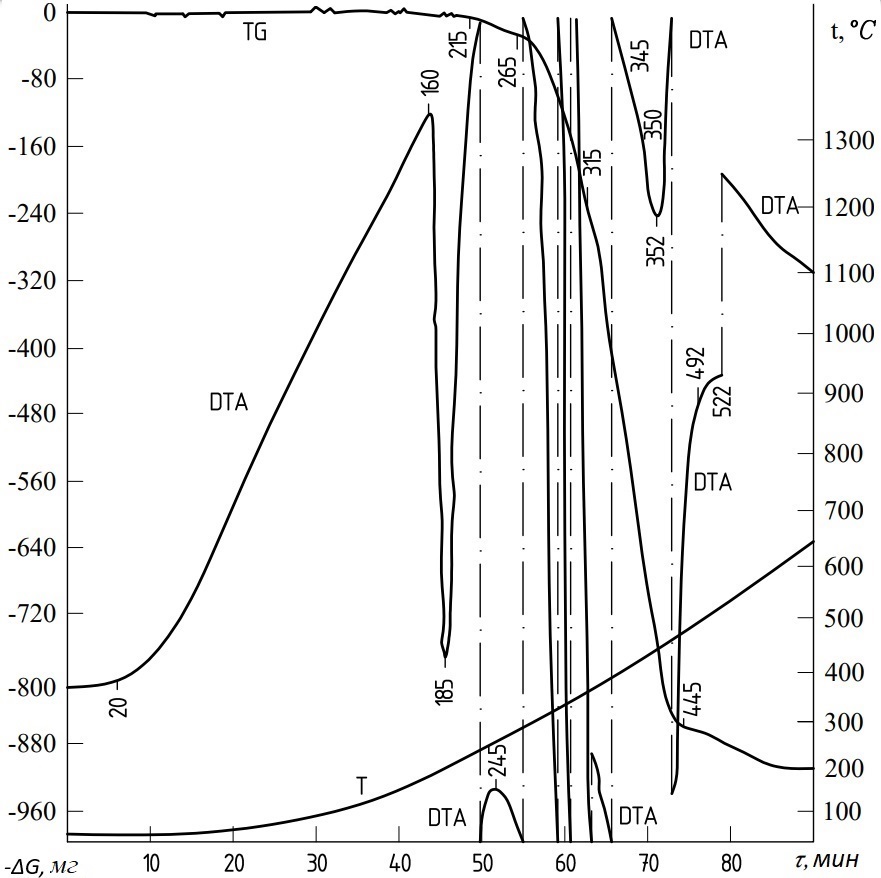
Рисунок 3 - Дериватограмма NH4Cl
Глубокая энтропия, появляющаяся на кривой в интервале температур 160...2150С, соответствует фазовому превращению λ→β NH4Cl, что обосновывается постоянной массой NH4Cl; кривая в данном интервале прямолинейна, и газообразные продукты отсутствуют. В интервале температур 260...492°С происходит разложение NH4Cl по реакции NH4Cl→NH3+HCl с потерей массы 94%, что связано с сильной эндотермией в этом интервале. При температуре 600°С удаляются все продукты, образующиеся при разложении NH4Cl. () реакции NH4Cl→NH3+HCl приведена в табл. 1.
Таблица 1 - Изменение термодинамического потенциала (Дж/мол) NH3 в зависимости от температуры
Реакция | Температура, K | ||||
298 | 400 | 500 | 1000 | 1500 | |
NH4Cl→NH3+HCl NH4→1/2N2+3/2H2 | 91523 16747 | - 6699 | - -5024 | -88601 -61965 | -199765 -120998 |
На рис. 4 и 5 показано взаимодействие Fe2O3, NiO, CoO и MoO3 с NH4Cl. По экзотермическим и эндотермическим эффектам, присутствующим на кривых DTA, можно сделать вывод, что происходит довольно быстрое хлорирование.
Рисунок 4 - Дериватограммы систем Fe2O3-NH4Cl (а) и NiO-NH4Cl (б)
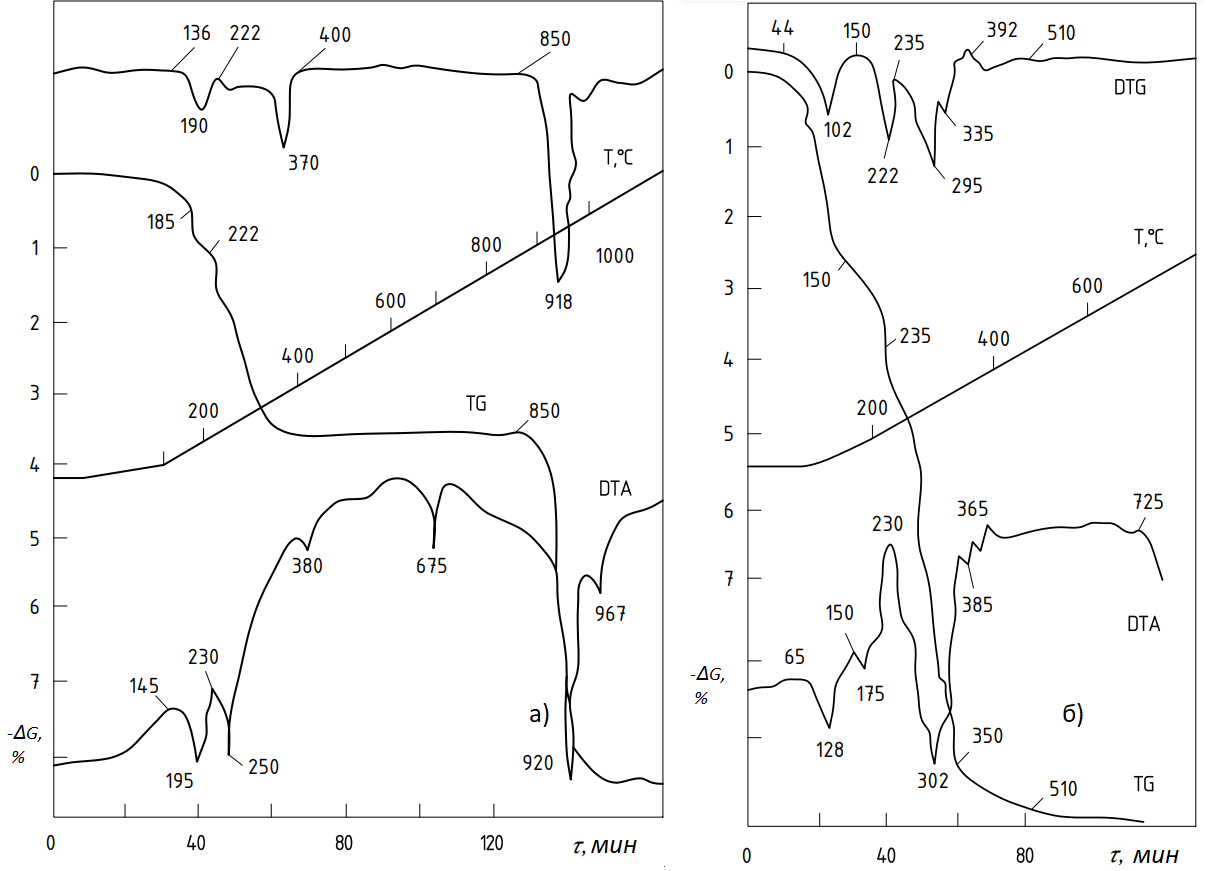
Рисунок 5 - Дериватограммы систем CoO-NH4Cl (а) и MoO3-NH4Cl (б)
которое проявляется уменьшением массы на кривой TG. При повышении температуры хлорирование обычно протекает по следующей реакции:
продуктом которой является оксихлорид. Одновременно протекают непропорциональные реакции
которые сопровождаются испарением газа Cl2. На кривой DTA это ощущается в виде глубокой эндотермии (с экстремумом 7980С при 672...8280С).
Механизм взаимодействия компонентов системы NiO-NH4Cl (рис. 4б) очень похож на механизм системы Fe2O3-NH4Cl. В этом случае кривая TG тоже не имеет больших провалов, а также протекают реакции хлорирования:
Как известно из [14, 15], NiCl2 активно взаимодействует с NH3, особенно при высоких температурах 1200С:
Однако соединение NiCl2∙NH3 термодинамически неустойчиво и разлагается при температурах 330...350°С, что сопровождается испарением NH3 (экстремум 3300С на кривой DTA).
В диапазоне высоких температур хлорирование протекает по следующей реакции:
в результате чего происходит образование оксихлоридов. В интервале температур 810...9200С (с экстремумом 9050С) часть NiCl2 (Ткип=9750С) испаряется, что фиксируется на кривых TG и DTG, а энтропия - на кривой DTA.
Дериватограммы систем CoO-NH4Cl (рис. 5а) и MoO3-NH4Cl (рис. 5б) отличаются от систем Fe2O3-NH4Cl и NiO-NH4Cl. Левая часть дериватограммы системы CoO-NH4Cl такая же, как у NiO-NH4Cl. С повышением температуры на кривой DTA отмечен эндотермический эффект (с экстремумом 675°С) без потери массы, при этом кривая TG ортогональна. Следовательно, происходит фазовый переход, сопровождающийся образованием оксихлоридов
Второй термический эффект, возникающий при температуре 8580С (с экстремумом 9200С), характеризуется резким падением кривых DTA и TG, возможным только при термическом разложении соединений. Как известно из [16], технический субоксид кобальта (СоО) содержит субоксид-оксид кобальта (Co3O4), диссоциирующий при температуре 9000С - Co3O4→CoO+O2. Энтропия этой реакции фиксируется на кривой DTA, а потеря O2 – на кривой TG.
Дериватограмма системы MoO3-NH4Cl (рис. 5б) характеризуется непрерывной потерей массы и, следовательно, непрерывным снижением кривой TG, вплоть до температуры 350°С. Термическое разложение NH4Cl происходит в интервале температур 230...365°С и фиксируется на кривой DТА с глубокой энтропией с температурным экстремумом 302°С. Фактически на этом процесс заканчивается, так как основная масса NH3 и HCl, еще не вступившая в реакцию, частично удаляется.
Хлорирование происходит по следующей реакции:
При температурах до 510°С наблюдается интенсивное испарение МоО3, которое зафиксировано хроматографическим анализом (табл. 2). Как известно [10], испарение MoO3 фактически происходит в интервале температур 600...8000С. Это означает, что процесс хлорирования ускоряет испарение, перемещая его в область более низких температур.
Особый интерес представляет процесс синтеза многокомпонентных систем. В системе Fe2O3-NiO-CoO-NH4Cl (рис. 6а) процесс хлорирования активизируется (особенно до температуры 455°С), что фиксируется на кривой DTA. Потеря массы образца незнаительна, кривая TG почти ортогональна. Поэтому завершенность процесса реакции наибольшая. Дериватограмма системы Fe2O3-NiO-MoO3-NH4Cl (рис. 6б) практически не отличима от системы Fe2O3-NiO-CoO-NH4Cl. Однако в этом случае кривая TG имеет глубокие провалы, как и в случае системы MoO3-MH4Cl (рис. 5б). Потеря массы высокая (50%MoO3). Данные показатели получены из-за наличия MoO3 и его испарения. Однако в этом случае температура испарения MoO3 сдвинута вправо, т.е. в диапазон температур 515...8000С, что можно объяснить ингибирующим свойством NiO. Процесс изменения “потеря массы-энтропия” фиксируется на кривых TG и DTA. На кривой DTA регистрируется глубокий эндотермический эффект, находящийся в интервале температур 515...655°С (с экстремумом 598°С).
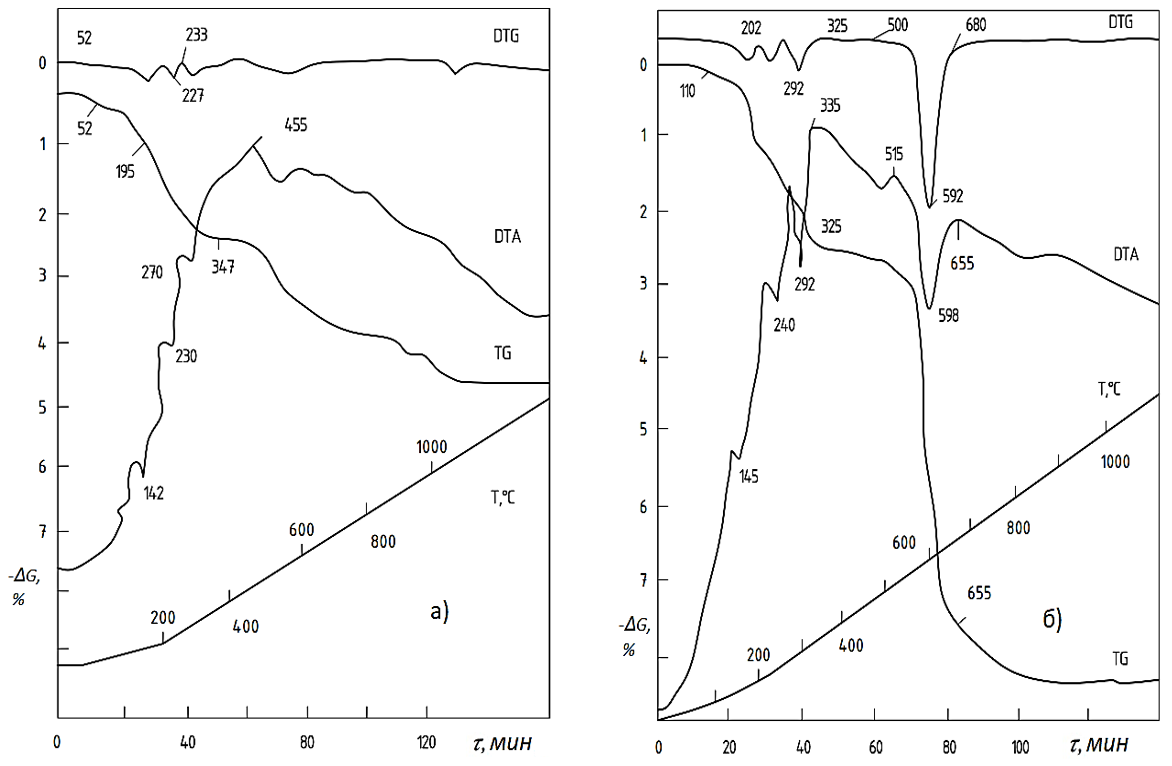
Рисунок 6 - Дериватограммы систем Fe2O3-NiO-CoO-NH4Cl и Fe2O3-NiO-MoO3-NH4Cl
Анализ продуктов реакции (табл. 2) показывает, что синтез оксидов осуществляется по объемному механизму, а именно:
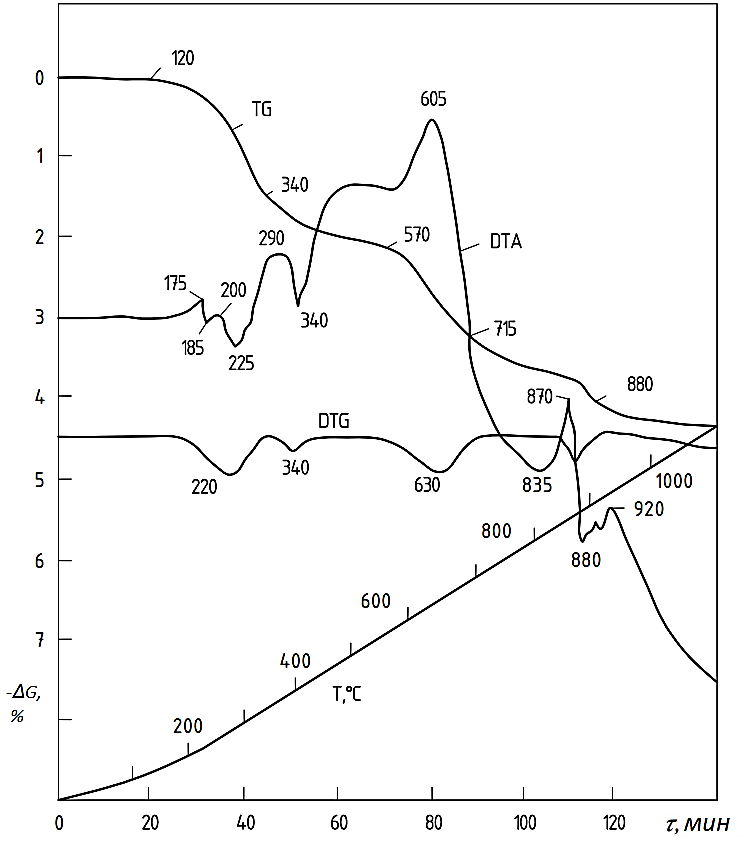
Рисунок 7 - Дериватограммы систем Fe2O3-NiO-CoO-MoO3-NH4Cl
Наряду с этими реакциями протекают и твердофазные реакции
Последней стадией синтеза являются вторичные реакции
где Me, Me', Me''– Ni, Co и Mo – металлы; γ - кислородный параметр.
Таблица 2 - Результаты химического, газового, магнитного и рентгеноструктурного анализов продуктов реакции
Система | T, 0C | Состав твердой фазы | Состав газовой фазы |
Fe2O3-NH4Cl
| 170 290 420 | Fe2O3, NH4Cl Fe2O3, NH4Cl, FeCl3 Fe2O3, FeOCl | H2O NH3, HCl, H2O NH3, FeCl3 |
NiO-NH4Cl | 210 280 420 | NiO, NH4CL NiO, NH4CL, NiCl2 NiO, NiCl2, Ni2OCl2 | H2O NH3, HCl, H2O NH3, |
CoO-NH4Cl | 220 390 | CoO, NH4Cl CoO, CoCl2, Co2OCl2 | - NH3, HCl, H2O |
MoO3-NH4Cl | 230 350 | MoO3, NH4Cl MoO3, MoO2Cl | H2O, NH3, NCl, H2O, MoO2Cl, MoOCl4 |
Fe2O3-NiO- -CoO-NH4Cl,
| 400 650 800 1080 | Fe2O3, NiO, CoO, ферритная фаза Fe2O3, NiO, ферритная фаза NiO ферритная фаза Ферритная фаза | NH3 - FeCl3 - |
Fe2O3-NiO- -MoO3-NH4Cl | 550 1050 | Fe2O3, NiMoO4, ферритная фаза Ферритная фаза | NH3 - |
Fe2O3-NiO- -CoO-MoO3- -NH4Cl | 550
1050 | Fe2O3, NiO, CoO, MoO3 ферритная фаза Ферритная фаза | NH3
- |
Таким образом, в присутствии NH4Cl протекают как газообразные, так и твердофазные гетерогенные реакции, продуктами которых являются сложные оксиды, образующиеся в виде шпинельных и твердых растворов.
С целью усовершенствования режимов получения ферритов (Т, τ) были проведены комплексные исследования. Шихту 68,5%Fe2O3+16,4%NiO+9,7% CoO+5,4%MoO3+2%NH4Cl перемешивали в вибрационной мельнице в течение 1,0...1,5 ч, что обеспечивало однородность состава и дисперсность зерен компонентов размером 1...10 мкм. Для ускорения процесса ферритизации шихту подвергали уплотнению в виде прессов (до 0,1 кг) с пористостью 50...60%, после чего проводили синтез. Результаты эксперимента представлены на рис. 8.
Степень ферритизации (Ф, %) оценивали химическим, рентгенометрическим и магнитным анализами. Целью фазового анализа было определение наличия свободных оксидов, которые не вступали в реакцию и не трансформировались. Результаты химического и рентгенометрического анализов контролировались магнитным анализом, так как исходные оксиды (Fe2O3, NiO, CoO, MoO3) парамагнитны, а синтезированные оксиды ферромагнитны. Исходя из изложенного, синтезированные ферриты после дисперсионного измельчения (1...5 мкм) в жидкой среде (воде) подвергались мокрой магнитной сепарации на трубчатом магнитном анализаторе типа 25Б-С3.
В ходе синтеза был проведен качественный анализ газов, образующихся в результате реакции. Газовые продукты реакции, особенно хлориды, охлаждались и конденсировались, а затем подвергались фазовому анализу. Углеводороды и другие соединения были определены на хроматографе типа ХТ-2, который претерпел определенные изменения. Концентрация компонентов газа регистрировались термохимическим детектором с помощью потенциометра типа ЭПИ-09. Небольшие количества были измерены с помощью чувствительной шкалы. Анализ проводился методом отбора тестового образца [17]. К сожалению, примерный подбор сорбентов и отсутствие методики не позволили детально изучить газовую фазу и правильно определить компоненты для таких специфических экспериментов. Химический анализ показал наличие хлоридов и оксихлоридов, которые указаны в табл․ 2, а хроматографический метод – наличие H2, NH3 и N2. Полученные результаты подтверждают, что процесс химических взаимодействий протекает не только с твердофазными реакциями оксидных контактов, но и с газовой фазой с интенсивным массопереносом. Этим объясняется высокая скорость реакций ферритизации в присутствии NH4Cl. Результаты хроматографического анализа показывают, что сначала образуются хлориды и оксихлориды, а затем следуют объемные и твердофазные реакции ферритизации.
На рис. 8 представлены результаты исследования в зависимости от температуры (Т, 0С) и продолжительности выдержки (τ, ч), которые являются основными параметрами. Степень ферритизации (Ф, %) обоснована по количеству немагнитной фракции. Как видно из рис. 8а, полный процесс ферритизации не обеспечивается при выдержке τ=2 ч, а 100% ферритизация происходит при Т=1100°С и τ =3,5...4,0 ч (рис. 8б).
По результатам экспериментов были выбраны следующие режимы синтеза и получения ферритов для системы Fe2O3-NiO-CoO-MoO3-NH4Cl: температура нагрева - 0C, время выдержки - 3,5... 4,0 ч.
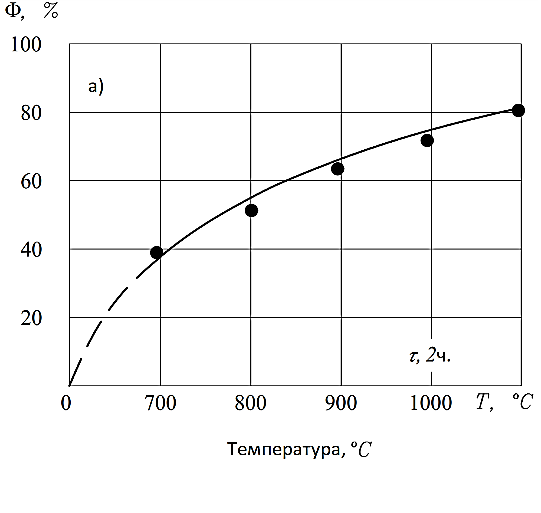
Рисунок 8 - Влияние температуры на степень получения ферритов
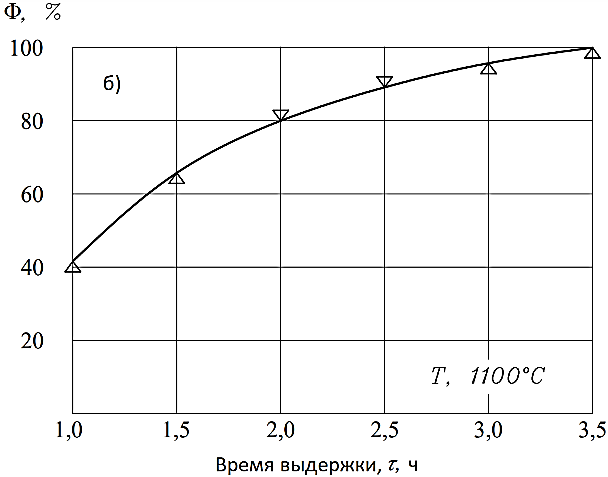
Рисунок 9 - Влияние времени выдержки на степень получения ферритов
4. Заключение
Дериватографическим методом выявлены механизм и кинетика ферритизации в оксидной системе Fe2O3–NiO–CoO–MoO3 при взаимодействии различных количеств компонентов, согласно которым:
· процесс ферритизации протекает поэтапно. Сначала происходит хлорирование оксидов, затем следуют объемные и вторичные реакции;
· синтез оксидной системы с участием NH4Cl осуществляется по механизму гетерогенных реакций как в газовой, так и в твердой фазах, продуктами которых считаются сложные оксиды типа шпинельного (MeFe2O4, MeO Fe2(MoO4)3) и твердого (NiFe2O4 CoMoO4) растворов;
· в системе Fe2O3–NiO–CoO–MoO3 субоксид кобальта (CoO) соединяется с MoO3 и образует соединение CoMoO4, тем самым препятствуя сублимации MoO3 Fe2O3, практически не взаимодействуя с MoO3. Переход оксидов в оксихлориды повышает их реакционную способность, что не только активизирует процессы ферритизации, но и дает возможность синтезировать как кислотные, так и щелочные оксиды;
· при синтезе оксидов исключается азотирование, поскольку процессы ферритообразования протекают в условиях высокого кислородного потенциала;
· подтверждены следующие режимы ферритизации: Tф=1100500C, ф=3,5…4,0 ч.
