SECOND LAW OF THERMODYNAMICS – THE MOST IMPORTANT LAW OF NATURE
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ – ВАЖНЕЙШИЙ ЗАКОН ПРИРОДЫ
Обзор
Кузнецова А.И.1, Медведева Г.А.2, *
1, 2 Казанский государственный архитектурно-строительный университет, Казань, Россия
* Корреспондирующий автор (medvedevaga79[at]mail.ru)
АннотацияСтатья посвящена второму закону термодинамики. Ученые считают, что он устанавливает существование энтропии как функции состояния системы. Однако исходя из последних исследований можно поставить под сомнение трактовку данного закона. Применим ли он в настоящее время? В статье рассмотрены его основные формулировки, представлены формулы для вычисления энтропии, выявлена связь второго начала термическим КПД. На основе полученной информации сделан вывод о значение второго начала термодинамики и его роли в современной науке.
Ключевые слова: второй закон термодинамики, процесс, цикл.
SECOND LAW OF THERMODYNAMICS – THE MOST IMPORTANT LAW OF NATURE
Review
Kuznetsova A.I.1, Medvedeva G.A.2, *
1, 2 Kazan State University of Architecture and Engineering, Kazan, Russia
* Corresponding author (medvedevaga79[at]mail.ru)
AbstractThe paper is devoted to the second law of thermodynamics. Scientists believe that it establishes the existence of entropy as a function of the state of the system. However, based on recent studies, the interpretation of this law can be called into question. Is it currently applicable? The article discusses its main formulations, presents formulas for calculating entropy, and reveals the relationship of the second law to thermal efficiency. Based on the information received, the authors draw a conclusion on the importance of the second law of thermodynamics and its role in modern science.
Keywords: second law of thermodynamics, process, cycle.
ВведениеВсе живые организмы подчиняются законам природы. Мы не можем преодолеть гравитацию точно так же, как и не можем остановить старение. Однако это не означает, что человек не стремится познать законы. Ежегодно ученые делают невероятные открытия. Например, в этом году швейцарцы Дидье Келоз и Мишель Майор получили нобелевскую премию за теоретические открытия в физической космологии. К сожалению, не все теории ученых подтверждаются на практике. Так люди на протяжении столетий верили в возможность самозарождения жизни. До двадцатого века главной причиной перемещения материков считалось расширение Земли. А химики считали, что атом имеет форму куба. Позднее данные теории были опровергнуты. Безусловно, существуют базовые, основополагающие законы, на которых строятся последующие исследования.
Одним из таких законов является второй закон термодинамики (ТД). Почему без знания второго закона ТД нельзя обойтись в современном мире? Действительно ли он является базовым законом?
Соберем информацию о сущности второго закона, его применении и на основе полученной информации выявим его значения для развития науки.
Чем так важен 2 закон термодинамики?
Для большинства природных процессов свойственна направленность и необратимость. Например, при теплообмене между телами или при диффузии. Мы легко можем распылить духи по комнате. Произойдет диффузия, перемешивание молекул воздуха и аромата. Собрать молекулы духов обратно во флакон мы не сможем. 1-ое начало термодинамики (ТД) гласит, что в протекающие в природе процессы, не противоречат закону сохранения энергии. Однако оно не объясняет все процессы, например, оно не отрицает переход тепла от более нагретого тела к менее нагретому. Для того, чтобы мы могли предсказать результат химической реакции, нам важно направление реакции.
Наблюдения ученых над тепловым двигателем показывают, что I-ый з-н ТД не сможет полностью объяснить явления преобразования энергии. Превращение механической энергии во внутреннюю происходит без соблюдения каких-либо условий. Другими словами энергия полностью превращается в теплоту. При обратном превращении останется частичка ΔU, не превращенной в механическую. Обобщая полученную информацию, в любом протекающем процессе возрастает степень неупорядоченности рассматриваемого объекта, то есть в мире происходит усиление беспорядка. Данный вывод представляет собой простейшую формулировку второго закона термодинамики. Величина, являющаяся мерой этого беспорядка, называется энтропией (S) [1].
II-й з-н ТД является результатом обобщения многих экспериментов и опытов. Он устанавливает возможный lim превращения теплоты (Q) в энергию, а также указывает какое у теплового потока направление.
Круговые циклы
Как мы знаем, многие процессы в природе цикличны. Движение планет, незатухающие колебания маятника являются яркими примерами. Также круговые циклы прекрасно иллюстрируют процессы преобразования энергии во втором законе ТД. Для того, чтобы лучше разобраться в происходящих процессах, рассмотрим цикл: (см. рисунок 1):
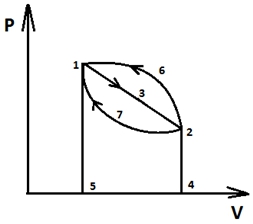
Рис. 1 – Круговой цикл
Из расширения тела по кривой 1-3-2 следует, что оно производит работу. Данную работу можно вычислить как площадь под графиком (плоскость 1-3-2-4-5 или по формуле работы L=P∆V). Для дальнейшего производства работы (L) тело должно вернуться в точку 1. По графику это можно сделать тремя путями:
- 2-3-1. L расширения газа равна работе сжатия (так как площади под прямыми равны). Это значит, что ΔL будет равно 0;
- 2-6-1. Кривая 261 находится над кривой 132, а значит, на сжатие 2-6-1 затрачивается больше работы, чем получено при расширении;
- 2-7-1. Кривая 271 располагается под кривой 231. В данном круговом процессе работа сжатия будет наименьшей. ΔL будет положительно и равняться площади 13271.
После того, как мы разобрались в механизме процессов, рассмотрим более подробно сам второй закон термодинамики.
Формулировка второго закона термодинамики
Для того, чтобы понять II-й з-н ТД, рассмотрим основные его формулировки:
- Карно утверждал, что «повсюду, где есть разность температур, может возникать движущая сила. Она может зависеть только от температуры тела, между которыми происходит перенос теплоты».
- Более обобщенную формулировку закона дал Клаузиус, немецкий физик. «Если единым результатом в процессе может быть передача Q от холодного тела к нагретому, то данный процесс не будет происходить».
- Одновременно с Клаузисом Томсоном была высказана похожая формулировка: «Невозможен процесс, единственным результатом которого является совершение работы за счет охлаждения одного тела».
- Современные же ученые считают, что II-ой з-н ТД является законом об S, то есть устанавливает ее существование как функции состояния системы» [2].
Энтропия как важная часть второго закона
Что такое энтропия (S)? Чем она так важна? Больцман говорил «S – показатель неупорядоченности системы». На примере воды рассмотрим ее работу. В твердом состоянии молекулы упорядочены, так как находятся в составе кристаллической решетки. В жидком же состоянии они перемещаются хаотично, то есть вода представляет собой неупорядоченную структуру. Соответственно мера беспорядка, энтропия, воды будет больше, чем льда. Больцман утверждал, что без изменения внешних условий вода не сможет превратиться в лед [3]. В замкнутых системах S не может уменьшаться. Мы знаем, что при уменьшении температуры (T) системы уменьшается скорость движения молекул, а значит, увеличивается упорядоченность системы. Если отвести Q от системы, S уменьшится.
В конечном итоге система стремится к состоянию, в котором:
- Вся полезная работа превратилась в теплоту;
- У всех тел системы одинаковая T;
- Произошло выравнивание давление и концентрация.
В данном состоянии энтропия достигает своего максимального значения, системе больше нет смысла изменяться.
Не менее важным является факт, что энтропия определяет возможность самопроизвольного протекания реакций. Система стремится к понижению энергии, а значит, самопроизвольно протекают процессы, которые увеличивают степень беспорядка или энтропии [4].
Для определения степени неупорядоченности системы вычисляют энтропию. Все реальные процессы протекают под действием конечной разности температур или концентраций, из чего следует:
где dS – изменение энтропии;
dQ – изменение теплоты;
Т – температура в кельвинах [5].
Точную величину значения энтропии вычисляют, например, для химических реакций. Она позволяет найти условия равновесия в реакциях, что является необходимым для дальнейшего проведения эксперимента.
Интересный факт: в настоящее время ведутся споры, являются ли черные дыры наибольшим источником энтропии или хаос передается в окружающее пространство не в столь значительных количествах благодаря мощным гравитационным силам [6].
Термический КПД
Как мы выяснили, II-й закон ТД указывает направление энергетических превращений. Для данных превращений используют огромное множество различных машин. Как же понять, какая машина работает лучше? Мы знаем, что не существует идеальных машин, которые могут работать без потери энергии. Максимизировать вырабатываемую энергию − одна из основных задач ученых. Так как они определяют степень совершенства машин?
Одной из характеристик является кпд. КПД − коэффициент полезного действия. Он показывает, какую часть теплоты машина может преобразовать в L. Соответственно, чем выше КПД, тем выше эффективность [7].
Рассмотрим круговой процесс (см. рисунок 1), рассчитаем L и удельное количество теплоты (q).
- 172: тело расширяется, следовательно, за счет теплоты q172 совершается положительная работа L172. Часть теплоты получается от тепло отдатчика, часть за счет внутренней энергии ∆U. По первому закону термодинамики q172= L172 + ∆U;
- 261: тело сжимается, то есть затрачивается работа − L261. Одна часть идет на увеличение внутренней энергии ∆U, другая часть − q261 отводится в теплоприемник. По I-ому закону ТД − q261=- L261 + ∆U [7].
Мы рассмотрели прямой цикл, в результате которого тело отдает работу: Lцикла= L172 - L261
Исходя из 1 з-на ТД=∆U+L
q= q172 - q261=∆U + (L172 - L261)
Так как тело пришло в начальное состояние, следовательно, ∆U=0. Отсюда получим формулу: q172-q261= Lцикла.
Существует общая формула для расчета кпд [4]:
![]()
Проанализируем формулу. По формуле КПД находится в прямой зависимости от количества теплоты, которое было преобразовано. Как было сказано ранее, ни одна машина не может полностью превращать всю энергию в работу, часть ее отводится в окружающую среду. Следовательно, КПД всегда < 1 [8].
Таким образом, КПД используют для определения производительности машин. А второй закон термодинамики необходим для создания электродвигателей.
Наиболее эффективный цикл − цикл Карно
Стремясь максимизировать КПД, французский физик Карно нашел круговой цикл, из которого можно получить максимальную работу. В 1824 он рассмотрел его в своем сочинении (см. рисунок 2):
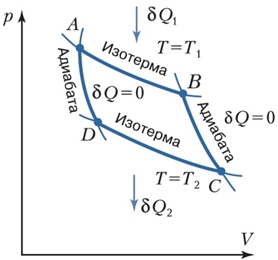
Рис. 2 – Цикл Карно
Рассмотрим цикл детально:
- Точка A: телу подводится теплота Q1 от источника тепла;
- Точка B: тело изолируется от источника с адиабатным расширением, снижается его температура;
- Точка C: тело сообщается с холодным источником, отводится теплота Q2;
- Точка D: тело идет к начальному состоянию в результате адиабатного сжатия.
Подведенное и отведенное количество теплоты можно вычислить по изотермам [9]:
Q1=RT1lnVA/ VB
Q2=RT2lnVC/ VD
Почему были выбраны именно данные процессы? В адиабатном процессе ∆Q=0, то есть, нет потерь энергии. В изотермическом вся полученная Q превращается в L.
Так как КПД цикла Карно больше КПД других циклов, он служит своеобразным образцом при оценке тепловых двигателей. При сравнении с циклом Карно можно сделать вывод о степени совершенства тепловой машины. К сожалению, в реальных двигателях его осуществить невозможно из-за практических трудностей [10].
Значение II-ого з-на ТД в настоящее время
Проанализировав собранную информацию, можно выделить следующие значения:
- Указывает направления протекания процессов, фактически выделяя возможные среди них;
- Определяет состояние равновесия при данных условиях, определяя количество полученной L;
- Устанавливает предел возможного самопроизвольного протекания процессов;
- Позволяет найти максимум энергии, которая может быть использовано;
- Устанавливает наиболее эффективные способы использования теплоты, определяя максимальный КПД;
- С помощью него можно выстроить температуру шкал, которая не будет зависеть от выбора устройства для измерения температуры.
Все это имеет очень большое значение, как для исследования теоретических проблем физической химии, так и для решения различных задач прикладного характера.
Заключение
Таким образом, в сравнении с I-ым з-ом, II-ой закон обладает менее обширной областью применение. Он применим лишь к системам из большого числа частиц, так как носит статистический характер. Несмотря на это, второй закон имеет огромное значение: охватывает почти все естествознание. На нем основан весь спектр анализов, то есть большая часть астрофизики, вся теоретическая и физическая химия. Везде, где встречается превращение энергии молекул и атомов в механическую или электрическую энергию, необходим рассмотренный закон. А также применяемая в новейшее время с таким удивительным успехом гипотеза квант является естественным отпрыском второго начала термодинамики. Безусловно, прогресс не стоит на месте. В последних экспериментах ученые добились того, что тепло может начать переходить от холодного атома к горячему. Однако в данных исследованиях рассматривается квантовый мир, в котором действуют далеко не все законы физики.
II-ой закон ТД действительно является базовым законом, так как на нем базируются многие гипотезы, теоремы, а также базируются устройства различных приборов. Развитие современной науки не было бы возможно без данного закона.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Дикерсон Р. Основные законы химии / Р. Дикерсон, Г. Грей, Дж. Хейт. – М.: Мир, 1982. − Том 1. − 652 с.
- Печенкин А.А. Второй закон термодинамики и его соотношение с христианской теологией [Электронный ресурс] / Печенкин А.А. // Новые идеи в философии: материалы II Междунар. науч. конф. (г. Казань, май 2016 г.). − Казань: Бук, 2016. − С. 36-43. − URL https://moluch.ru/conf/philos/archive/175/10417/ (дата обращения: 14.12.2019).
- Нащокин В.В. Техническая термодинамика и теплопередача/ В.В. Нащокин - Изд. 2-е, перераб. и доп. − М.: Высшая Школа, 1975. – 469 с.
- By Lisa Zyga. Jan 10, 2011 [Электронный ресурс]. – URL: http://phys.org/news/ (дата обращения: 10.03.2014).
- Хохрин С.Н. Физическая химия. Термодинамика химических реакций: Учебное пособие / С.Н. Хохрин, К.А. Рожков, И.В. Лунегова. – СПб.: Лань, 2015. – 112 c.
- Шапиро С.Л. Черные дыры, белые карлики и нейтронные звезды / Шапиро С.Л., Тьюколски С. А. / пер. с англ. под ред. Я. А. Смородинского. М.: Мир, 1985.
- Бондарев Б.В. Курс общей физики. В 3-х т. Т. 3. Термодинамика. Статистическая физика. Строение вещества: Учебник для бакалавров / Б.В. Бондарев. – М.: Юрайт, 2013. – 369 c.
- Ковалева Т.Ю. Механика. Молекулярная физика и термодинамика / Т.Ю. Ковалева. – М.: КноРус, 2012. – 952 c.
- Морачевский А.Г. Физическая химия. Термодинамика химических реакций: Учебное пособие / А.Г. Морачевский, Е.Г. Фирсова. – СПб.: Лань, 2015. – 112 c.
- Кузнецов С.И. Курс физики. Часть I. Механика. Молекулярная физика. Термодинамика / С.И. Кузнецов. – СПб.: Лань, 2014. – 464 c.
Список литературы на английском языке / References in English
- Dickerson R. Osnovnye zakony himii [Basic laws of chemistry] / R. Dickerson, G. Gray, J. Haight. − M.: Mir, 1982. − Volume 1. − 652 p. [in Russian].
- Pechenkin A. A. Vtoroj zakon termodinamiki i ego sootnoshenie s hristianskoj teologiej [The second law of thermodynamics and its relationship with Christian theology] [Electronic resource] // New ideas in philosophy: materials of the II Intern. scientific conf. (Kazan, May 2016). − Kazan: Buk, 2016. − Р. 36-43. − URL https://moluch.ru/conf/philos/archive/175/10417/ (accessed: 14.12.2019) [in Russian].
- Nashchokin V.V. Tekhnicheskaya termodinamika i teploperedacha [Technical thermodynamics and heat transfer] / V.V. Nashchokin − Ed. 2nd, rev. and add. − M.: Higher School, 1975. − 469 p. [in Russian].
- By Lisa Zyga. Jan 10, 2011 [Electronic resource]. URL: http://phys.org/news/ (accessed: 03/10/2014). [in Russian].
- Khokhrin S.N. Fizicheskaya himiya. Termodinamika himicheskih reakcij: Uchebnoe posobie [Physical chemistry. Thermodynamics of chemical reactions: Textbook] / S.N. Khokhrin, K.A. Rozhkov, I.V. Lunegova. − St. Petersburg: Doe, 2015. − 112 p. [in Russian].
- Shapiro S.L. Chernye dyry, belye karliki i nejtronnye zvezdy [Black holes, white dwarfs and neutron stars] / Shapiro S. L., Tjukolski S. A. / trans. from English under the editorship of J. A. Smorodinsky. M.: World, 1985. [in Russian].
- Bondarev B.V. Kurs obshchej fiziki [General physics course]. In 3 vols. V. 3. Thermodynamics. Statistical Physics. The structure of the substance: Textbook for bachelors / B.V. Bondarev. − M.: Yurayt, 2013 . − 369 p. [in Russian].
- Kovaleva T.Yu. Mekhanika. Molekulyarnaya fizika i termodinamika [Mechanics. Molecular Physics and Thermodynamics] / T.Yu. Kovaleva. − M.: KnoRus, 2012. − 952 p. [in Russian].
- Morachevsky A.G. Fizicheskaya himiya. Termodinamika himicheskih reakcij: Uchebnoe posobie [Physical chemistry. Thermodynamics of chemical reactions: Textbook] / A.G. Morachevsky, E.G. Firsova. − St. Petersburg: Doe, 2015. − 112 p. [in Russian].
- Kuznetsov S.I. Kurs fiziki. Chast' I. Mekhanika. Molekulyarnaya fizika. Termodinamika [Physics course. Part I. Mechanics. Molecular physics. Thermodynamics] / S.I. Kuznetsov. − St. Petersburg: Doe, 2014. − 464 p. [in Russian].
