INFLUENCE OF LOW CONCENTRATIONS OF NOOPEPT ON EXCITABILITY OF THE NEURONAL MEMBRANE OF THE VINEYARD SNAIL
INFLUENCE OF LOW CONCENTRATIONS OF NOOPEPT ON EXCITABILITY OF THE NEURONAL MEMBRANE OF THE VINEYARD SNAIL
Abstract
This work is dedicated to the study of the effect of noopept, one of the nootropic drugs, on the nervous system. The mechanisms underlying the occurrence of a bell-shaped type of the dose-dependent curve of the incoming acetylcholine current when the noopept concentration changes in the range of 10-11-10-9M are examined. On the basis of the proposed model of acetylcholine receptor dynamics, the schemes of possible processes involving proteinphophatase 2A are analysed and the experimental data corresponding to these schemes are discussed. Possible targets of noopept mediated effects as an inhibitor of proteinphosphatase 2A are defined, from which it is necessary to take into account the detected effect of low concentrations of the drug for humans.
1. Введение
В настоящее время в регулировании ряда когнитивных процессов (таких как внимание, обучение, память и др.) широко используется один из ноотропный препарат – ноопепт. Профиль активности ноопепта в целом сходен с таковым для другого распространенного препарата – пирацетама (дипептидным аналогом которого он является), но активность ноопепта проявляется в дозах значительно меньших. Поэтому выяснение механизмов его воздействия на нервную систему является одной из задач изучения влияния лекарственных препаратов на живой организм.
Как показали исследования, этот препарат преимущественно влияет на процессы, связанные с долговременными изменениями в нейронах , уменьшает фосфорилирование тау-белков и ослабляет апоптоз . Также ноопепт может взаимодействовать с находящимися на мембране нейронов специфическим местами связывания , а в диапазоне концентраций 10-11–10-9М увеличивает амплитуду деполяризации на микроапликацию ацетилхолина (АХ) у нейронов виноградной улитки . Проведенные нами ранее исследования воздействия различных концентраций ноопепта на входящий АХ-ток на командных нейронах виноградной улитки выявили усиление АХ-тока при концентрациях препарата в области 0.1–10 нM . Дозозависимая кривая имеет колоколообразный вид с достижением максимального значения при концентрации препарата 1нМ. На основании расчетов, выполненных с помощью математической модели, было высказано предположение, что колокообразный вид дозовой кривой может являться следствием влияния ноопепта или на сами никотиновые АХ-рецепторы, или на внутриклеточные процессы, приводящие к увеличению на мембране количества АХ-рецепторов. Дальнейшая конкретизация механизмов холинопозитивного воздействия препарата была осуществлена по средствам анализа амплитуды вызванного АХ-тока с помощью математической модели, описывающей основные процессы возникновения АХ-тока: диффузию медиатора, переход рецепторов в открытое состояние при взаимодействии с медиатором, десенситизизацию рецепторов . Исследования показали, что ноопепт может влиять на увеличение количества АХ-рецепторов на мембране нейронов в результате действия на процессы эндо/экзоцитоза рецепторов. При исследовании воздействия препарата на депрессию вызванного входящего АХ-тока на командных нейронах виноградной улитки было обнаружено, что при концентрации ноопепта 1нМ наблюдалось усиление депрессии . Сравнение характеристик смоделированной кривой при концентрации ноопепта 1нМ с характеристиками ранее полученных экспериментальных кривых депрессии АХ-тока при воздействии различных ингибиторов позволило выделить кривую, соответствующую смоделированной по характеру поведения, скорости выработки и уровню депрессии (с учетом разброса значений). Такой кривой оказалась кривая депрессии АХ-тока, полученная при воздействии эндотала, специфического ингибитора протеинфосфатазы 2А (РР2А) . На основании соответствия кривых было сделано предположение о возможном ингибировании ноопептом РР2А.
Согласно существующим экспериментальным данным РР2А влияет на многие внутриклеточные процессы в клетке. Поскольку взятые для исследования на командных нейронах виноградной улитки концентрации препарата актуальны также для человека – в диапазоне концентраций ноопепта 0.01нМ–10мкМ наблюдается увеличение жизнеспособности нейронов гиппокампа , то необходима дальнейшая конкретизация механизмов влияния ноопепта, связанных с активностью этой протеинфосфатазы.
2. Методы и принципы исследования
Анализ литературных данных о влиянии РР2А на процессы эндо- и экзоцитоза рецепторов позволяет выделить ключевые процессы, ответственные за формирование экспериментальной колокообразной кривой, а расчеты, произведенные с помощью математической модели этих процессов, уточнить сделанные предположения. Общая схема динамики рецепторов (переход во внутриклеточное пространство с мембраны и обратно) с участием РР2А, составленная на основании имеющихся данных (которые обсуждаются далее), представлена на рисунке 1.
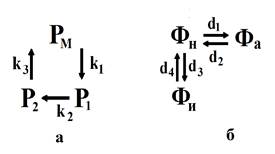
Рисунок 1 - Общая схема примембранной динамики рецепторов (а) и активации РР2А (б)
Примечание: где Рм - количество рецепторов на мембране; Р1 – количество рецепторов в везикулах, транспортируемых с мембраны; Р2 – количество рецепторов в везикулах, транспортируемых на мембрану; Фн, Фа, Фи – неактивное, активное и ингибированное состояния РР2А, соответственно; k1, k2, k3, d1, d2, d4 – константы скорости перехода между различными состояниями рецепторов и протеинфосфатазы, соответственно, а d3 зависит от количества ингибитора N
dPM/dt = k3×P2 – k1×PM
dP1/dt = k1×PM – k2×P1
dP2/dt = k2×P1 – k3×P2
dФа/dt = d1×Фн – d2×Фa
dФи/dt = d3×Фн – d4×Фи
dФн/dt = d2×Фа + d4×Фи – (d1+ d3)×Фн
В случае, когда суммарное количество рецепторов в рассматриваемом объеме не изменяется, т.е. РМ+Р1+Р2=Р0 (рассматриваемый отрезок времени меньше времени синтеза рецепторов и их доставки) и аналогично Фн+Фа+Фи=Ф0, и dQ/dt =0 (Q=PM,P1,P2,Фа,Фн,Фи), т.е. в стационарном случае, соответствующем рассматриваемым экспериментам, Ра=Р0/(1+k1/k3+k1/k2) и Фа=Ф0/(1+(1+d3/d4)×d2/d1), где d3=d30×N, N – количество ингибитора. Поскольку в приведенной схеме 1А рассматриваются возможные процессы с участием РР2А (Фа в модели), то в случае зависимости констант перехода между различными состояниями k1, k2,k3 от Фа: k1=k10× (1+a×Фа), k2=k20× (1+g×Фа), k3=k30× (1+b×Фа). Такая зависимость k1 и k3 от Фа позволяет учитывать возможность транспортировки везикул с рецепторами из и на мембрану без участия РР2А, а k2 от Фа отражает данные о роли РР2А в дефосфорилировании рецепторов, находящихся на везикулах, после чего осуществляется их экзоцитоз.
Поскольку в наших исследованиях по воздействию ноопепта на депрессию вызванного входящего АХ-тока на командных нейронах виноградной улитки рассматривалось нормированное отношение тока (тока при наличии ноопепта к току в контроле) и полагалось, что входящий ток пропорционален количеству рецепторов, находящихся на мембране , в дальнейших расчетах также рассматривалось нормированное отношение Ра(N) – количества рецепторов на мембране при наличии ноопепта к Ра(0) – количеству рецепторов на мембране без воздействия ингибитора РР2А (Фа). Таким образом, рассматривается отношение R(N) = Pa(N)/Pa(0) = G(0)/G(N), где
G(0) = 1 + g1× (1+a×Фа(0))/( 1+b×Фа(0)) + g2×(1+a×Фа(0))/( 1+g×Фа(0))
G(N) = 1 + g1× (1+a×Фа(N))/( 1+b×Фа(N)) + g2×(1+a×Фа(N))/( 1+g×Фа(N))
Фа(0) = Ф0/(1+d2/d1)
Фа(N) = Ф0/(1+(1+d30× N /d4)×d2/d1)
g1 = k10/ k30, g2 = k10/ k20.
Зависимость Фа(N) – обратно пропорциональная и при возрастании N Фа(N) монотонно уменьшается. Зависимость полученного отношения R(N) от концентрации ингибитора рассматривалась при его воздействии на разные стадии изменения состояний рецепторов. В случае существования влияния ингибитора на константу скорости переход между состояниями рецепторов, полагалось, что для этой стадии Фа=Фа(N), а для остальных – Фа=Фа(0).
3. Основные результаты
Была проанализированы зависимости R(N) для всех возможных сочетаний влияния ингибитора на k1, k2, k3. Результаты вычислений представлены в Таблице 1.
Таблица 1 - Зависимость отношения R(N) от концентрации ингибитора
Переходы с участием РР2А | Вид констант переходов при воздействии ингибитора | Зависимость количествамембранных рецепторов от концентрации ингибитора – R(N) | Вид переменных в зависимости R(N) от констант переходов, описанных в модели | Поведениефункции R(N) |
из PM в P1 | k1=k10× (1+a×Ф0/ (1+d* × (1+d**× N)) d*=d2/d1 d**=d30/d4 | F×(1-h1/(N+h2)) | F=G(0)/(1+g1+g2) h1=a×Ф0/((d*× d**)× ×(1+g1+g2)) h2=(1+ d*)/( d*× d**)+h1 | при увеличении N R(N) монотонно возрастает |
из P1 в P2 или из P2 в PM | k2=k20× (1+g×Ф0/ (1+d* ×(1+d**× N)) или k3=k30× (1+b×Ф0/ (1+d* × (1+d**× N)) d*=d2/d1 d**=d30/d4 | F×(1+h3/(N+h4)) F×(1+h5/(N+h6)) | F=G(0)/(1+g1+g2) h3=a×Ф0× g2/((d*× d**)× ×(1+g1+g2)) h4=(1+ d*)/( d*× d**)+ +h3×(1+g1)/g2 h5=a×Ф0× g1/((d*× d**)× ×(1+g1+g2)) h6=(1+ d*)/( d*× d**)+ +h5×(1+g2)/g1 | в обоих случаях при увеличении N R(N) монотонно убывает |
из PM в P1 и из P2 в PM или из PM в P1, далее из P1 в P2 или из P1 в P2, далее из P2 в PM или из PM в P1, далее из P1 в P2, далее из P2 в PM | вид k1 и k3 представлен выше вид k1 и k2 представлен выше вид k2 и k3 представлен выше вид k1, k2 и k3 представлен выше | во всех этих случаях зависимость имеет вид F×(N2+a1×N+a2)/ (N2+b1×N+b2) | Коэффициенты a1,a2, b1, b2 зависят от k1, k2, k3, d1, d2, d4, d30 | При определенных значениях коэффициентов a1, a2, b1, b2 во всех этих случаях имеет колокообразный вид |
Как следует из представленных результатов вычислений, зависимость R(N) имеет колокообразный вид (аналогичный экспериментальной кривой) в случаях влияния ингибитора РР2А на следующие процессы:
1) эндоцитоз и экзоцитоз рецепторов;
2) эндоцитоз рецепторов и их дефосфорилирование в примембранных везикулах;
3) дефосфорилировани рецепторов в примембранных везикулах и их экзоцитоз;
4) на транспортные процессы рецепторов и их дефосфорилирование.
Таким образом, в случае ингибирования ноопептом РР2А, она должна играть существенную роль в этих процессах.
4. Обсуждение
Рассмотрим имеющиеся экспериментальные данные, позволяющие уточнить мишени РР2А в процессах эндоцитоза и экзоцитоза рецепторов, их транспортировки и трансформации в примембранных везикулах.
Как эндоцитоз лиганд-рецепторного комплекса с поверхности плазматической мембраны, так и их транспорт к поверхности плазматической мембраны осуществляются в везикулах. Было показано, что фосфорилирование b2-адаптина коррелирует с ингибированием клатрин-опосредованного эндоцитоза рецепторов, а его дефосфорилирование осуществляется РР2А . Следовательно, ингибирование РР2А будет приводить к возрастанию уровня фосфорилирования b2-адаптина, уменьшению эндоцитоза рецепторов и к увеличению их количества на мембране.
Влияние РР2А на экзоцитоз рецепторов может осуществляться вследствие ее воздействия на комплекс экзоцисты, участвующий в направлении транспорта везикул к определенным местам мембраны и стыковке с ней. Полученные экспериментальные данные позволяют предположить, что именно РР2А ответственна за дефосфорилирование субъединицы Sec5 экзоцисты необходимой для последующей фазы слияния везикулы с плазматической мембраной. РР2А может дефосфорилировать t-SNARE (SNAP-25), являющийся одним из белков комплекса SNARE, который, как было показано, участвует в процессе слияния мембран везикул в случае синаптического выброса .
Транспорт везикул внутри нервных клеток к их периферии и вдоль мембраны осуществляется миозином V по примембранному актиновому цитоскелету . Как следует из экспериментов с гладкомышечной тканью, длительное (тоническое) сокращение миоцита связано с уменьшением в несколько раз скорости диссоциации мостика миозина с актиновой нитью, если он не подвергается дефосфорилированию . Одним из основных регуляторных факторов MLCP (фосфатазы легких цепей миозина) является CPI17, фосфорилирование которого ингибирует ее активность, что приводит к усилению сокращения гладких мышц, а дефосфорилирование СРI7 PP2A вызывает их расслабление. Таким образом, ингибирование РР2А вызовет уменьшение скорости примембранной транспортировки везикул с рецепторами.
Наличие в модели двух разных внутриклеточных состояний рецепторов (Р1 и Р2) отражает существование в везикулярной фракции рецепторов в фосфорилированном и дефосфорилированном состояниях, поскольку рецепторы на плазматической мембране более фосфорилированы, чем в примембранной фракции, и РР2А дефосфорилирует находящиеся в эндосомах рецепторы при увеличении рН внутри везикул, что способствует возврату рецепторов на плазматическую мембрану . Известно, что РР2А участвует в дефосфорилировании G-белок-связанных рецепторов на этапе их рециклирования , в частности рециркуляция mGluR5 полностью зависит от активности PP2A . В ресенситизации гистаминовых H2-рецепторов в COS7-трансфицированных клетках дефосфорилирование РР2А является решающим этапом, поскольку ингибирование PP2A подавляет восстановление гистаминовых Н2-рецепторных мембранных сайтов .
Таким образом, поскольку во всех рассматриваемых процессах транспортировки и изменения состояния рецепторов (Таблица 1) существуют мишени РР2А, то наиболее вероятной является схема динамики АХ-рецепторов, учитывающая опосредованное воздействие ноопепта на все скорости перехода между различными состояниями рецепторов (представленные на рисунке 1). Однако, поскольку константы скоростей реакций ряда рассматриваемых биохимических процессов с участием РР2А точно не определены, без дальнейших экспериментальных исследований исключить возможность представленных (в Таблице 1) других схем динамики АХ-рецепторов, когда зависимость R(N) имеет колокообразный вид, нельзя.
5. Заключение
Нахождение мишений опосредованного воздействия ноопепта (как ингибитора РР2А) в результате проведенных вычислений и имеющихся экспериментальных данных позволит при воздействии на эти мишени специфических ингибиторов уточнить, какие из них в большей степени подвержены такому воздействию, и является ли действительно ноопепт ингибитором РР2А. Ответ на этот вопрос достаточно важен, поскольку PP2A является одним из наиболее распространенных ферментов в головном мозге, и в случае воздействия ноопепта на аналогичные процессы у человека это необходимо учитывать при уменьшении концентрации принимаемого препарата.
