СТЕРИЧЕСКИЙ АСПЕКТ В ТРЕХСТАДИЙНОМ СИНТЕЗЕ ПОЛОВОГО ФЕРОМОНА КОМНАТНОЙ МУХИ (MUSCA DOMESTICA L.) ЦИС-9-ТРИКОЗЕНА
СТЕРИЧЕСКИЙ АСПЕКТ В ТРЕХСТАДИЙНОМ СИНТЕЗЕ ПОЛОВОГО ФЕРОМОНА КОМНАТНОЙ МУХИ (MUSCA DOMESTICA L.) ЦИС-9-ТРИКОЗЕНА Научная статья Падалка С.Д.1, *, Фотина Н.С.2, Подварко А.Т.3, Беседина Е.Н.4, Балахнина И.В.5, Савва А.П.6, Есипенко Л.П.7
1 ORCID: 0000-0001-8478-5332; 2 ORCID: 0000-0001-9253-8999; 3 ORCID: 0000-0002-2709-3425; 4 ORCID: 0000-0002-9976-5614; 5 ORCID: 0000-0002-2326-221x; 6 ORCID: 0000-0003-1159-9197; 7 ORCID: 0000-0002-9457-2223, 1, 2, 3, 4, 5, 6, 7 ФГБНУ Всероссийский научно-исследовательский институт биологической защиты растений, Краснодар, Россия * Корреспондирующий автор (scientistchem[at]inbox.ru)
Аннотация Комнатная муха Musca domestica L относится к синантропным насекомым и представляет большую опасность для здоровья человека и домашних животных. Половые феромоны насекомых активно используются для разработки и создания эффективных средств защиты. Изучен нетривиальные подходы тонкого органического синтеза, позволяющий сократить количество стадий при получении феромонов. Опробован трехстадийный подход к синтезу цис-9-трикозена, полового феромона комнатной мухи Musca domestica L [1, C. 2792]. Осуществлен синтез (хинолин-8-ил)-цис-9-октадеценоата и изучены его физико-химические свойства. Проведен анализ стерических препятствий при получении кетонов из сложных эфиров и реактивов Гриньяра. Ключевые слова: цис-9-трикозен, половой феромон комнатной мухи, Musca Domestica L., мускалюр, реактив Гриньяра, (хинолин-8-ил)-цис-9-октадеценоат, цис-14-трикозен-6-он.
STERIC ASPECT IN THREE-STAGE SYNTHESIS OF SEX PHEROMONE OF HOUSEFLY (MUSCA DOMESTICA L.) CIS-9-TRICOZENE
Research article Padalka S.D.1, *, Fotina N.S.2, Podvarko A.T.3, Besedina E.N.4, Balakhnina I.V.5, Savva A.P.6, Yesipenko L.P.7 1 ORCID: 0000-0001-8478-5332; 2 ORCID: 0000-0001-9253-8999; 3 ORCID: 0000-0002-2709-3425; 4 ORCID: 0000-0002-9976-5614; 5 ORCID: 0000-0002-2326-221x; 6 ORCID: 0000-0003-1159-9197; 7 ORCID: 0000-0002-9457-2223. 1, 2, 3, 4, 5, 6, 7 FSBU All-Russian Research Institute of Biological Plant Protection, Krasnodar, Russia * Corresponding author (scientistchem[at]inbox.ru)
Abstract The housefly Musca domestica L is a synanthropic insect and is very dangerous to human health and pets. Sex pheromones of insects are actively used to develop and create effective means of protection. The article studies non-trivial approaches of fine organic synthesis, which allows reducing the number of stages in the preparation of pheromones. A three-stage approach to the synthesis of cis-9-tricozenes, the sex pheromone of the housefly Musca domestica L, was tested [1, P. 2792]. Synthesis of (quinolin-8-yl) -cis-9-octadecenoate is carried out and its physicochemical properties are studied. The analysis of steric hindrances in the preparation of ketones from esters and Grignard reagents was conducted. Keywords: cis-9-tricozenes, sex pheromone of the housefly, Musca Domestica L., muscular, Grignard reagent, (quinolin-8-yl) -cis-9-octadecenoate, cis-14-tricozene-6-on.
Половые феромоны насекомых являются видоспецифичными биологически активными веществами, вызывающими у воспринимающих их особей этого же вида специфическую ответную реакцию. У большинства насекомых зрительная информация гораздо меньше влияет на поведение, чем химическая коммуникация. Это открывает возможности управления поведением насекомых с помощью химических соединений определенной структуры, половых феромонов. Актуально разрабатывать методы получения и осуществлять синтез этих соединений [2, C. 5], [3, С. 63]. Как правило, феромоны насекомых представляют собой достаточно летучие не токсичные органические соединения, действующие на расстоянии до нескольких сотен метров от источника запаха. Поэтому половые феромоны используются как эффективные аттрактанты в феромонных ловушках против фредных насекомых. В 1971 г. Карлсоном был выделен и идентифицирован половой феромон комнатной мухи Musca domestica L., цис-9-трикозен (мускалюр) [4, С. 77]. Испытания мускалюра показали его аттрактивную способность [5, С. 555]. В настоящее время это вещество широко используется как инсектицид в средствах дезинсекции. В литературе описаны различные подходы к синтезу мускалюра [8, С. 2049], [9, С. 1723], [10, С. 628], [11, С. 718], [12, С. 3971]. Мы изучали описанную японскими учеными трехстадийную схему синтеза [1, С. 2792], которая заключалась в синтезе сложного эфира (хинолин-8-ил)-цис-9-октадеценоат, получении пентилмагнийбромида и их сочетании с последующим восстановлением в цис-9-трикозен гидразингидратом (рис. 1). Была проведена методика низкотемпературного синтеза цис-14-трикозен-6-она и исследованы продукты этой реакции.
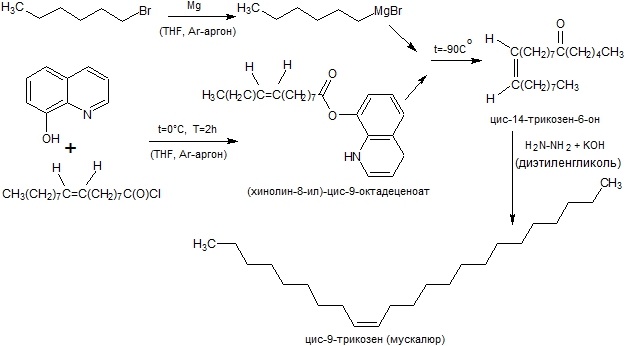
Рис. 1 – Трехстадийная схема синтеза цис-9-трикозена (мускалюра)
С помощью вакуумной перегонки было выделено 7.2 г бесцветной жидкости. Идентичность вещества по ИК спектру, записанному в жидкой пленке, соответствует олеиновой кислоте. Кубовый остаток, представляющий собой третичный спирт, перегнать при 1.2 мм рт. ст. не удалось. В ИК спектре валентному колебанию карбонильной группы олеиновой кислоты соответствует интенсивное поглощение при 1709 см-1 без расщепления полосы; около 3000 см-1 наблюдаются колебания алифатического углеродного скелета, а выше 3000 см-1 колебания двойной цис-связи. В сложном эфире (хинолин-8-ил)-цис-9-октадеценоате поглощение карбонильной группы смещается до 1763 см-1 (рис. 2). В 1H ЯМР спектре (хинолин-8-ил)-цис-9-октадеценоата наблюдаются полосы поглощения алифатических и ароматических ядер. В области 5-6 м.д. имеются пики, относящиеся к этиленовой системе. Значение константы спин-спинового взаимодействия 3JHH, которой составило 10,16 Гц, что подтверждает цис-геометрию двойной связи.
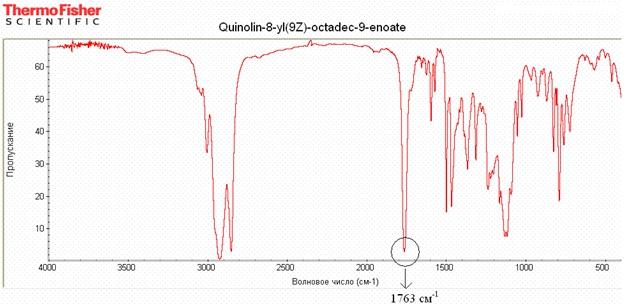
Рис. 2 – ИК спектр (хинолин-8-ил)-цис-9-октадеценоата
Таким образом, низкотемпературной реакцией взаимодействия (хинолин-8-ил)-цис-9-октадеценоата с пентилмагнийбромидом были получены: олеиновая кислота, 8-пентилхинолин и соответствующий третичный спирт. Эти данные соотносятся с открытой Шлоссером реакцией аллильных ацетатов с реактивом Гриньяра. Действительно, нормальная реакция сложных эфиров с реактивами Гриньяра приводит к получению третичных спиртов и является синтетическим методом. Для завершения реакции на 1 моль сложного эфира требуется 2 моль магнийорганического соединения. Использование реактивов Гриньяра для синтеза кетонов из сложных эфиров сильно ограничено из-за высокой электрофильности углерода в кетоне и доступности этого реакционного центра в реакции. Все это, как правило, приводит к образованию третичных спиртов [13, С. 750]. Поэтому в реакцию вводят стерически затрудненные сложные эфиры. Под стерическим затруднением следует понимать доступность карбонильного центра для соответствующего нуклеофильного реагента. Сложный эфир, (хинолин-8-ил)-цис-9-октадеценоат, по мнению японских авторов, является стерически затрудненным [1, С. 2792]. Способы создания стерического затруднения в сложных эфирах были детально изучены нами в нашей работе. Собранный литературный материал позволил выявить, что под стерическим затруднением чаще всего понимают наличие заместителей в сложном эфире со стороны кислотного остатка [14, С. 5], [15, С. 450], [16, С. 2875], [17, С. 3444], [18, С. 804], [19, С. 1162], [20, С. 2362]. Отличие стерически затрудненных сложных эфиров от нормальных сложных эфиров заключается в том, что они могут останавливать реакцию взаимодействия реактива Гриньяра на стадии образования кетона. В литературе описаны способы получения ароматических, алициклических и разветвленных алифатических кетонов. Выходы кетонов находятся в районе 30-70%. Порядок добавления реагентов и понижение температуры до -15°C незначительное влияние на выходы кетонов [30, С. 1137], [31, С.3368], [32, С. 1749], [33, С. 608], [34, С. 255]. Не имеет большого значения, где находится стерическое затруднение: в реактиве Гриньяра или со стороны карбонильной группы. В нашем случае, для получения неразветвленной алифатической цепи стерическое затруднение должно было находиться в сложном эфире со стороны спиртового, или феноксильного остатка. Таким образом, для изучения возможности синтеза цис-9-трикозен-6-она был синтезирован (хинолин-8)-ил-цис-9-октадеценоат; доказано его строение; осуществлено низкотемпературное взаимодействие с реактивом Гриньяра. Реакция идет по схеме (рис. 3):
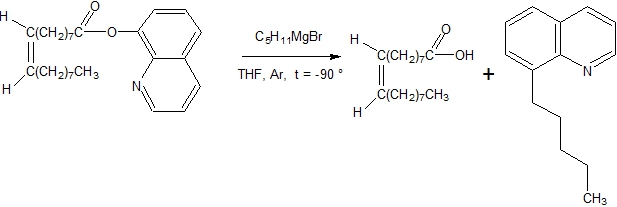
Рис. 3 – Низкотемпературное взаимодействие (хинолин-8-ил)-цис-9-октадеценоата с пентилмагнийбромидом
Синтез (хинолин-8-ил)-цис-9-октадеценоата В трехгорлую колбу на 500 мл, оборудованную механической мешалкой, капельной воронкой с байпасной трубкой, подводом сухого аргона и гидравлическим затвором на вазелиновом масле поместили 200 мл абсолютного тетрагидрофурана, в котором при перемешивании было растворено 23,9 г (0,2 моль) 8-оксихинолина. Полученный желтый раствор охладили внешней баней до 0 °C; одной порцией добавили 9,6 г (0,2 моль) мелкогранулированного гидроксида натрия. В посветлевший раствор, поддерживая температуру около 0 °C, прикапали 66,2 мл (60,2 г, 0,2 моль) хлорангидрида олеиновой кислоты. Реакционная масса на некоторое время загустевает так, что ее становится трудно размешивать; при дальнейшем добавлении хлорангидрида происходит однородное смешивание; перемешивают 1 час при 0 °C и, не убирая баню, оставляют стоять на ночь. На следующий день реакционную массу вылили в воду со льдом и трижды экстрагировали диэтиловым эфиром. Органические фазы объединили, промыли 1 %-ным водным раствором гидроксида натрия и 100 мл насыщенного раствора хлорида натрия. Высушили над безводным Na2SO4. Растворитель был отогнан на роторном испарителе, повышая вакуум до 1 мм рт. ст., что привело к 59,3 г жидкости цвета заваренного чая. Выход сырого вещества составил 72 %. Наличие сложноэфирной связи было доказано по ИК, а присутствие ароматического и алифатического остатков - по 1H ЯМР спектрам. Отдельно записаны 1H и 13C ЯМР спектры в областях δ для непредельной цис-связи. Низкотемпературное взаимодействие (хинолин-8-ил)-цис-9-октадеценоата с пентилмагнийбромидом. В трехгорлую колбу, оборудованную механической мешалкой с затвором, капельной воронкой с байпасом, подводом аргона и охлаждающей баней с гексаном, поместили 19,9 г (0,048 моль) (хинолин-8-ил)-цис-9-октадеценоата в 80 мл абсолютного дихлорметана. При интенсивном перемешивании охладили до -90°C и по каплям прибавили раствор пентилмагнийбромида, полученный из 8,13 мл (9,9 г, 0,066 моль), 1,76 г (10%-ый избыток по молям) в 66 мл абсолютного диэтилового эфира. Реакционную массу оставили на ночь нагреваться до комнатной температуры. Прозрачный раствор слили с желтоватых твердей, промыли 1 М раствором соляной кислоты и высушили над безводным сульфатом натрия. Удаление растворителя на роторном испарителе и разгонка в вакууме позволила получить масло m=7,2 г с Ткип.=171-177°C при 0,8 мм рт. ст. ИК спектр синтезированного вещества полностью соответствует олеиновой кислоте.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Abe K. The Studies of the Activated Compound. III. A Synthesis of Muscalure:(Z)-9-Tricosene / K. Abe, T. Yamasaki, N. Nakamura, T. Sakan // Bulletin of the Chemical Society of Japan. – 1977. – V. 50. – №. 10. – P. 2792.
- Одиноков В. Н. Синтез феромонов насекомых / В. Н. Одиноков, Э. П., Серебряков // Уфа: Гилем. – 2001. –372 с.
- Падалка С. Д. Синтез геранилбутирата и применение его для борьбы с проволочником на посевах пропашных, овощных и бахчевых культур / С. Д. Падалка, Н. С. Фотина, В. Я. Исмаилов // Национальная ассоциация ученых (НАУ): ежемесячный научный журнал. - 2015. - № 9. - Ч. 4. - С. 61-64.
- Carlson D. A. Sex attractant pheromone of the house fly: isolation, identification and synthesis / D. A. Carlson et al. // Science. – 1971. – V. 174. – №. 4004. – P. 76-78.
- Carlson D. A. evaluations of (Z)-9-tricosene, a sex attractant pheromone of the house fly / D. A. Carlson, M. Beroza // Environmental Entomology. – 1973. – V. 2. – № 4. – P. 555-560.
- Odinokov V. N. Insect pheromones and their analogues. XIV. The synthesis of muscalure as a sex pheromone of Musca domestica. / V. N. Odinokov, G. Y. Ishmuratov, G. G. Balezina and others // Khim. Prir. Soed. - 1985. - V. 21. - № 3. - P.401-403.
- Verba G. G. Synthesis of muscalure – the pheromone of Musca Domestica. / G. G. Verba, V. S. Abdukakharov, A. A. Abdukakhabov // Khim. Prir. Soed. - 1975. - V. 21. - № 5. - P. 698-700.
- Kovalev B. G. Synthetic studies of attracting substances (sexual attractants) of insects. III. Convenient method of preparing higher dialkylacetylenes. Synthesis of muscalure, the attractant of the housefly Musca Domestica / B. G. Kovalev, V. V. Stan, T. K. Antoch, V. P. Konyukhov, S. F. Nedopekina // Zh. Org. Khim. - 1977. - V. 13. - № 10. - P. 2049-2052.
- Naoshima Y. Convenient synthesis of muscalure, the housefly sex pheromone. / Y. Naoshima, H. Ozawa, Y. Takenami and others // Agril. Biol. Chem. - 1981. - V. 45. - № 7. - P. 1723-1724.
- Kim M. Practical and scalable synthesis of (Z)-9-tricosene, the housefly sex pheromone. / M. Kim, A. Pitchaiah, N-J. Park and others // Letters in Org. Chem. - 2012. - V. 9. - № 9. - P. 628-631.
- Dhillon R. S. Pheromones via organoboranes. IV. Synthesis of (Z)-9-tricosene (muscalure). / R. S. Dhillon, R. P. Singh // Ind. J. Chem. - 1995. - V. 34B. - P. 718-721.
- Cargill R. L. Synthesis of the housefly sex attractant. / R. L. Cargill, M. G. Rosenblum // J. Org. Chem. - 1972. - V. 37. - № 24. - P. 3971.
- Gilman H. The reaction between carboxylic acid halides and organomagnesium halides / H. Gilman, R. E. Fothergill, H. H. Parker // Recueil des Travaux Chimiques des Pays-Bas. - 1929. - V. 48. - № 7. - P. 748-751.
- Бартон С. Д. Общая органическая химия: в 12-ти т. Карбоновые кислоты и их производные. Соединения фосфора / С. Д. Бартон, В. Д. Оллис. - М.: Химия, 1983. - 728 с. – 4 т.
- Huet F. Formation d’enolates cetoniques par action d’organomagnesiens mixtes dans l’hexamehylphosphorotriamide sur des esters / F. Huet, G. Emptoz, A. Jubier // Terahedron. - 1973. - V. 29. P. 479-485.
- Arnold R. T. Mechanism of the reaction between hindered carbonyl compounds and the Grignard reagent / R. T. Arnold, R. W. Liggett // J. Am. Chem. Soc. - 1942. - V. 64. - № 12. - P. 2875-2877.
- Arnold R. T. Resonance and the hindered carbonyl-Grignard reaction / R. T. Arnold, H. Bank, R. W. Liggett // J. Am. Chem. Soc. - 1941. - V. 63. - № 252. - P. 3444-3446.
- Smith L. I. The enolizing action of methylmagnesium iodide upon hindered ketones / L. I. Smith, C. Guss // J. Am. Chem. Soc. - 1937. - V. 59. - № 5. - P. 804-806.
- Gilman H. Metallic derivatives of acetomesitylene / H. Gilman, R. G. Jones // J. Am. Chem. Soc. - 1941. - V. 63. - № 4. - P. 1162-1163.
- Fuson R. C. Reactions of bromomagnesium enolates of mesityl ketones. II. Condensation / R. C. Fuson, W. O. Fugate, C. H. Fisher // J. Am. Chem. Soc. - 1939. - V. 61. - № 9. - P. 2362-2365.
- Fuson R. C. The reduction of mixed hindered benzils / R. C. Fuson, P. E. Hoch // J. Am. Chem. Soc - 1949. - V. 71. - № 5. - P. 1585-1586.
- Ross W. E. The action of methylmagnesium bromide on 2,4,6-trichlorobenzoyl chloride / W. E. Ross, R. C. Fuson // J. Am. Chem. Soc. - 1937. - V. 59. - № 8. - P. 1508-1510.
- Лапкин И. И. Пространственные препятствия при магнийорганических реакциях. 9. О получении кетонов взаимодействием галоидангидридов кислот с магнийорганическими соединениями / И. И. Лапкин, А. В. Любимова // Журнал Органической Химии. – 1949. - Ч. 19. - № 4. - С. 707-716.
- Gilman H. The preparation of ketones from acid halides and the Grignard reagent / H. Gilman, M. L. Mayhue // Recueil des Travaux Chimiques des Pays-Bas. - 1932. - V. 51. - № 1. - P. 47-50.
- Cole W. A study of the 22-ketosteroids / W. Cole, P. L. Julian // J. Am. Chem. Soc. - 1945. - V. 67. - № 8. - P. 1369-1375.
- Helferich B. Synthese und eigenschaften eines δ-oxy-aldehyds / B. Helferich, T. Malkomes // Berichte der deutschen chemischen Gesellschaft (A and B Series). - 1922. - V. 55. - № 3. - P. 702-708.
- Rupe H. Untersuchungen über den einfluβ der constitution auf das drehungsvermögen optisch aktiver substanzen. Ketoderivate des 1,2,2-trimethylcyclopentan-3-carbonsäure / H. Rupe // Eur. J. Org. Chem. - 1922. - V. 428. - № 2-3. - P. 164-188.
- Cook N. C. Grignard reactions. XX. 1 effect of cuprous chloride on the reaction of t-butylmagnesium chloride and trimethylacetyl chloride / N. C. Cook, W.C. Percival // J. Am. Chem. Soc. - 1949. - V. 71. - № 12. - P. 4141-4142.
- Stehman C. J. Grignard reactions. XIX. 1 preparation of 2,4,4-trimethyl-3-pentanone / C. J. Stehman, N. C. Cook, F. C. Whitmore // J. Am. Chem. Soc. - 1949. - V. 71. - № 4. - P. 1509-1510.
- Schmidlin J. Triphenylmethyl, triphenylacetaldehyd und triphenylacetanhydrid / J. Schmidlin // Berichte der deutschen chemischen Gesellschaft. - 1910. - V. 43. - № 1. - P. 1137-1144.
- Fordyce C. R. Branched chain aliphatic acids. Isomyristic, isopalmitic and isostearic acids / C. R. Fordyce, J. R. Johnson // J. Am. Chem. Soc. - 1933. - V. 55. - № 8. - P. 3368-3372.
- Davies L. A. The structures of convolvulinolic and jalapinolic acids. Synthesis of 11-hydroxypentadecanoic and 11-hydroxyhexadecanoic acids / L. A. Davies, R. Adams // J. Am. Chem. Soc. - 1928. - V. 50. - № 6. - P. 1749-1755.
- Darzens G. Sur quelques délvés du butilcyclohexane / G. Darzens, H. Rost // CR Acad. Sci., Paris. – 1911. - V. 152. - P. 608.
- Meerwein H. Über ringveränderungen bei der wasserabspaltung aus alicyclischen alkoholen / H. Meerwein // Justus liebigs annalen der chemie. - 1918. - V. 417. - № 2-3. - P. 255-277.
