СИНТЕЗ ДИОКСИМА ДЕКАГИДРОАКРИДИНДИОНА
СИНТЕЗ ДИОКСИМА ДЕКАГИДРОАКРИДИНДИОНА
Научная статья
Северо-Осетинский государственный университет им. К. Л. Хетагурова, Владикавказ, Россия
* Корреспондирующий автор (example[at]mail.ru)
АннотацияВ работе рассмотрены реакции оксимирования 9-(3,5-ди-трет-бутил-4-гидроксифенил)-3,3,6,6-тетраметил-3,4,6,7,9,10-гексагидроакридин-1,8(2H,5H)-диона. Установлено, что атака нуклеофильных реагентов на карбонильные группы в гексагидроакридин-1,8(2H,5H)-дионах протекает с сохранением 1,4-дигидропиридинового фрагмента и образованием моно- и дизамещенных производных. Структура исходного 9-(3,5-ди-трет-бутил-4-гидроксифенил)-3,3,6,6-тетраметил-3,4,6,7,9,10-гексагидроакридин-1,8(2H,5H)-диона и его диоксима подтверждена методом ЯМР 1Н спектроскопии.
Ключевые слова: 3,4,6,7,9,10-гексагидроакридин-1,8(2H,5H)-дион, оксимирование, диоксим акридиндиона, пространственно-затрудненный фенол.
SYNTHESIS OF DECAHYDROACRIDINION DIOXIME
Research article
Chigorina T.M. *
North Ossetian State University named after. K.L. Khetagurov, Vladikavkaz, Russia
* Corresponding author (example[at]mail.ru)
AbstractThe work considers the reactions of oximatization of 9- (3,5-di-tret-butyl-4-hydroxyphenyl)-3,3,6,6-tetramethyl-3,4,6,7,9,10-hexahydroacridine-1,8(2H, 5H)-dione. It was found that the attack of nucleophilic reagents on carbonyl groups into hexahydroacridin-1,8(2H, 5H)-diones proceeds with preservation of the 1,4-dihydropyridine fragment and the formation of mono- and disubstituted derivatives. The structure of the starting 9- (3,5-di-tret-butyl-4-hydroxyphenyl) -3,3,6,6-tetramethyl-3,4,6,7,9,10-hexahydro-acridine-1,8 (2H, 5H)-dione and its dioxime confirmed by 1H NMR spectroscopy.
Keywords: 3,4,6,7,9,10-hexahydroacridine-1,8 (2H, 5H)-dione, oximation, acridinedione dioxime, spatial-obstructed phenol.
1,8-Диоксодекагидроакридины обладают широким спектром практически полезных свойств, важнейшими из которых являются биологическая активность и открытая в последние годы возможность их использования в качестве лазерных красителей [1], [2], [3].
Реакции нуклеофильного замещения карбонильных групп в декагидроакридин-1,8-дионах на оксимные под действием солянокислого гидроксиламина сопровождается пиридинизацией гетерокольца (для NH-акридиндионов), образованием пиридиниевого цикла (для 10-R-замещенных субстратов) и, что наиболее важно, протекает с сохранением 1,4-дигидропиридинового фрагмента (для 9,10-дизамещенных субстратов).
В литературе мало приведено сведений, касающихся реакций декагидроакридин-1,8-дионов с участием карбонильных функциональных производных. Примером может служить работа [4], в которой отмечается, что образование диоксимов незамещенного в положениях 9-арилзамещенных декагидроакридин-1,8-дионов сопровождается окислением 1,4-дигидропиридинового фрагмента.
Данная работа посвящена изучению реакции оксимирования 9-(3,5-ди-трет-бутил-4-гидроксифенил)-3,3,6,6-тетраметил-3,4,6,7,9,10-гексагидроакри-дин-1,8 (2H,5H)-диона и последующего восстановление образующегося диоксима до соответствующего диамина – 9-(3,5-ди-трет.-бутил-4-гидроксифенил)-декагидро-1,8-диаминоакридина, а также изучению физико-химических свойств синтезированных соединений.
Диоксим декагидроакридиндиона получен реакцией оксимирования, путем взаимодействия спиртовых растворов декагидроакридиндиона (0,01 моль) и хлоргидрата гидроксиламина (0,02 моль), в присутствии тригидрата ацетата натрия (Схема 1).
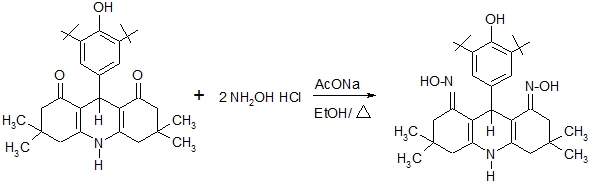
Рис. 1 – Схема реакции получения диоксима декагидроакридиндиона
Полученное вещество сушили и перекристаллизовывали из гексана. Выход 80-82% с т. пл. 172-173 0С.
Cпектр ЯМР 1Н (δ, м. д., CDCl3): 0,96 (HCH3); 1,39 (Нt-Bu); 2,27-2,55 (HСН2); 3,84 (Hгетерокольца при С9); 6,85 (HAr); 9,67 (Нон).
Известно, что при действии гидроксиламина, соединения, которые содержат дигидропиридиновиый цикл, окисляются до пиридиновых производных [5], [6], [7]. Очевидно, наличие заместителей в 9-м и 10-м положениях акридинового цикла соединений повышает стойкость гетероцикла к окислению.
В спектрах ПМР диоксима 9-(3,5-ди-трет.-бутил-4-гидроксифенил)-декагидроакридин-1,8-диона наиболее характерными являются сигналы протонов трет-бутильных групп при 1,35-1,52 м.д. (фрагмент пространственно-затрудненного фенола в положении С-9). Химические сдвиги протонов ОН-групп проявляются в виде уширенных синглетов в области 11,54-11,64 м.д. В ПМР спектрах исходного 9-(3,5-ди-трет.-бутил-4-гидроксифенил)-декагидроакридин-1,8-диона наиболее характерными, за исключением сигналов трет.-бутильных групп фрагмента пространственно-затрудненного фенола при С-9, являются сигналы метиленовых в области 3,40-3,45 м.д, метинового протона при 4,04 м.д. и в области 4,65-5,56 м.д. (9-арилзамещенные). Химические сдвиги протонов N-H группы присутствуют в области 7,29-7,32 м.д.
Возможный механизм образования октагидроакридиндиона представлен на схеме 2.
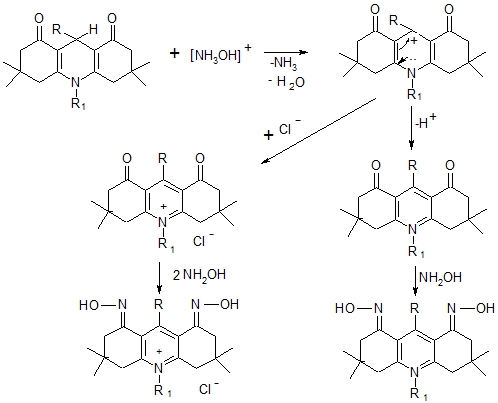
Рис. 2 – Предполагаемый механизм образования октагидроакридиндион
Полизамещением гетероцикла, создающим стерические препятствия в акте межмолекулярного гидрид-переноса, объясняется устойчивость 1,4-дигидропиридинового цикла в 9,10-замещенных декагидроакридиндионах к окислению при оксимировании [8], [9], [10]. Атака нуклеофильных реагентов на карбонильные группы в гексагидроакридин-1,8 (2H,5H)-дионах протекает с сохранением 1,4-дигидропиридинового фрагмента и образованием моно- и дизамещенных производных.
Кипячением раствора декагидроакридиндиона с гидрохлоридом гидроксиламина в пиридине (или с ацетатом натрия в спирте) в течение 2-3 часов с обратным холодильником получен диоксим 9-(3,5-ди-трет-бутил-4-гидроксифенил)-декагидроакридин-1,8-диона.
Структура исходного 9-(3,5-ди-трет.-бутил-4-гидроксифенил)-дека-гидроакридин-1,8-диона и его диоксима подтверждена методом ЯМР1Н спектроскопии.
Наличие в молекулах 1,8-диоксодекагидроакридинов таких реакционных центров, как карбонильные группы, дает возможность использовать их в реакциях нуклеофильного замещения и получать ряд новых соединений.
На основании выше изложенного можно сказать, что нами разработаны препаративные методы получения производных декагидроакридин-1,8-дионов - оксимов. Установлено, что замещение карбонильных групп нуклеофильными реагентами в декагидроакридин-1,8-дионах протекает с сохранением 1,4-дигидропиридинового фрагмента с образованием моно- и дизамещенных производных.
В заключении, нами сделаны следующие выводы:
- оксимированием 9-(3,5-ди-трет-бутил-4-гидроксифенил)-3,3,6,6-тетраметил-3,4,6,7,9,10-гексагидроакридин-1,8(2H,5H)-диона синтезирован его диоксим. Показано, что проведение реакции в пиридине с хлоргидратом гидроксиламина или в присутствии ацетата натрия в спиртовом растворе не сказывается на выходе диоксима (выходы сопоставимы).
- установлено, что 9-(3,5-ди-трет.-бутил-4-гидроксифенил)-1,8-диамино-декагидроакридиндион образует хорошо кристаллизующиеся соли с минеральными кислотами. В щелочном спиртовом растворе дает темно-красное окрашивание (характерная реакция на 1,4-дигидропиридиновую структуру).
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы/ References
- Rollas S. Biological activities of hydrazone derivatives. / S. Rollas, S. Güniz Küçükgüzel. // – 2007. -Vol. 12. - № 6. – P. 1910-1932.
- Chigorina T.M. Synthesis and Properties of Oligoazomethines Based on Decahydroacridinedione. / T. M. Chigorina, A. A. Arutyunyants, E. A. Chigorina. // Russian Journal of Organic Chemistry. – 2015. - Vol. 51. - № 10. - pp. 1505–1507.
- Chigorina T.M. Synthesis and properties of oligoazomethines based on decahydroacridinedione. / Chigorina T.M., Egorov D.I., Chigorina E.A. //9th International Symposium "Molecular mobility and order in polymer systems" – Saint Petersburg. (9-й Международный Симпозиум "Молекулярная Подвижность и Порядок в Полимерных Системах», Санкт-Петербург. – 2017. – P. 132.
- Чигорина Т.М. Синтез и исследование редокс-реакций в ряду пространственно-затрудненных кетоперимидинов. / Чигорина Т.М., Гузитаева М.Ф. // Актуальные проблемы гуманитарных и естественных наук. - 2016. - № 1-5. - С. 7-9.
- Villa M. Material science for the support design: a powerful challenge for catalysis. / Villa, M. Schiavoni, L. Prati, // Catal. Sci. Technol. – 2012. – 2. – pp. 673–682.
- Pyrko A.N. Synthesis and Transformations of New 1,2,3,4,5,6,7,8,9,10-Decahydroacridine-1,8-dione Derivatives. / A. N. Pyrko. //Russian Journal of Organic Chemistry. - 2008. - vol. 44. - № 8. - pp. 1215–12.
- Yang C.P. Thermally Stable, Organosoluble, and Colorless Poly(ether imide)s Having Ortho-Linked Aromatic Units in the Main Chain and Trifluoromethyl Pendent Groups. / Yang C.P. Wang J.-M., Su Y.Y. and others // Macromol Chem Phys. – 2006. – Vol. 207 (12). - P. 1049–1061.
- Чигорина Т.М. Синтез и окислительно-восстановительные реакции декагидротетраазаакридина с фрагментом пространственно-затрудненного фенола. / Чигорина Т.М., Горбунов А.И., Егоров Д.И. //Химическая наука: современные достижения и историческая перспектива. - ИП Синяев Д. Н.- Казань, 2015. - С. 142-144.
- Tsai C.L. Highly Transparent Polyimide Hybrids for Optoelectronic Applications. / Tsai C.L., Yen H.J., Liou G.S. // Funct. Polym.- 2016. –Vol. 108. – P. 2-30.
- Половков Н.Ю. Предварительная химическая модификация полимеров с концевыми амино-группами для исследования методом масс-спектрометрии с источником МАЛДИ / Половков Н.Ю., Борисов Р.С. // Сборник тезисов XVIII международной научной конференции студентов, аспирантов и молодых учёных «Ломоносов-2010». - Москва. - C. 162-164.
Список литературы на английском языке / References in English
- Rollas S. Biological activities of hydrazone derivatives. / S. Rollas, S. Güniz Küçükgüzel. // – 2007. -Vol. 12. - № 6. – P. 1910-1932.
- Chigorina T.M. Synthesis and Properties of Oligoazomethines Based on Decahydroacridinedione. / T. M. Chigorina, A. A. Arutyunyants, E. A. Chigorina. // Russian Journal of Organic Chemistry. – 2015. - Vol. 51. - № 10. - pp. 1505–1507.
- Chigorina T.M. Synthesis and properties of oligoazomethines based on decahydroacridinedione. / Chigorina T.M., Egorov D.I., Chigorina E.A. //9th International Symposium "Molecular mobility and order in polymer systems" – Saint Petersburg. (9-й Международный Симпозиум "Молекулярная Подвижность и Порядок в Полимерных Системах», Санкт-Петербург. – 2017. – P. 132.
- Chigorina T.M. Sintez i issledovanie redoks-reakcij v ryadu prostranstvenno-zatrudnennyh ketoperimidinov [Synthesis and study of redox reactions in a series of spatially obstructed ketoperimidines]. Chigorina TM, Guzitaeva M.F. // Aktual'nye problemy gumanitarnyh i estestvennyh nauk [Actual problems of the humanities and natural sciences]. - 2016. - № 1-5. - pp. 7-9. [in Russian]
- Villa, M. Schiavoni, L. Prati, Material science for the support design: a powerful challenge for catalysis. // Catal. Sci. Technol. – 2012. – 2. – pp. 673–682.
- N. Pyrko. Synthesis and Transformations of New 1,2,3,4,5,6,7,8,9,10-Decahydroacridine-1,8-dione Derivatives. //Russian Journal of Organic Chemistry. - 2008. - vol. 44. - № 8. - pp. 1215–12.
- Yang C.P. Wang J.-M., Su Y.-Y., Hsiao S.-H. Thermally Stable, Organosoluble, and Colorless Poly(ether imide)s Having Ortho-Linked Aromatic Units in the Main Chain and Trifluoromethyl Pendent Groups. // Macromol Chem Phys. – 2006. – Vol. 207 (12). - P. 1049–1061.
- Chigorina T.M. Sintez i okislitel'no-vosstanovitel'nye reakcii dekagidrotetraazaakridina s fragmentom prostranstvenno-zatrudnennogo fenola [Synthesis and redox reactions of decahydrotetraazaridine with a fragment of a hindered phenol] / Chigorina, TM, Gorbunov, AI, Egorov, D.I. and others // Himicheskaya nauka: sovremennye dostizheniya i istoricheskaya perspektiva [Chemical science: modern achievements and historical perspective]. - IP Sinyaev D.N.-Kazan, 2015. - p. 142-144. [in Russian]
- Tsai C.L. Highly Transparent Polyimide Hybrids for Optoelectronic Applications / Tsai C.L., Yen H.J., Liou G.S. // React. Funct. Polym.- –Vol. 108. – P. 2-30.
- Polovkov N.Yu. Predvaritel'naya himicheskaya modifikaciya polimerov s koncevymi amino-gruppami dlya issledovaniya metodom mass-spektrometrii s istochnikom MALDI [Preliminary chemical modification of polymers with terminal amino groups for research using mass spectrometry with a MALDI source] / Polovkov N.Yu., Borisov R.S. // bornik tezisov XVIII mezhdunarodnoj nauchnoj konferencii studentov, aspirantov i molodyh uchyonyh «Lomonosov-2010» [Collection of theses of the XVIII International Scientific Conference of Students, Postgraduates and Young Scientists "Lomonosov-2010"]. - Moscow. - 2011. C. 162-164. [in Russian]
