ВЛИЯНИЕ ТРАНСЛОКАЦИОННОГО ДЕЙСТВИЯ CU И ZN НА БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ ОВСА ПОСЕВНОГО
Петухов А.С.1, Хритохин Н.А.2, Кудрявцев А.А.3, Петухова Г.А.4
1Студент,
2Кандидат химических наук,
3Кандидат физико-математических наук,
4Доктор биологических наук,
Тюменский государственный университет
ВЛИЯНИЕ ТРАНСЛОКАЦИОННОГО ДЕЙСТВИЯ CU И ZN НА БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ ОВСА ПОСЕВНОГО
Аннотация
В статье рассматривается влияние загрязнения минеральной почвы солями тяжелых металлов (Cu2+ и Zn2+) в концентрации, соответствующей 2 ПДК, на процессы перекисного окисления липидов и содержание пигментов фотосинтеза в клетках овса посевного.
Ключевые слова: тяжелые металлы, перекисное окисление липидов, пигменты фотосинтеза.
Petukhov A.S.1, Khritohin N.A.2, Kudryavtsev A.A.3, Petukhova G.A.4,
1Student,
2PhD in Chemical sciences,
3PhD in Physico-mathematical sciences,
4Grand PhD in Biological sciences,
Tyumen State University
INFLUENCE OF TRANSLOCATION ACTION OF CU AND ZN ON BIOCHEMICAL INDEXES OF OAT
Abstract
The article considers the pollution of mineral soil by salts of heavy metals (Cu2+ and Zn2+) in concentration of 2 MPC and its influence on peroxide oxidation of lipids and concentration of photosynthesis pigments in cells of oat.
Keywords: heavy metals, peroxide oxidation of lipids, photosynthesis pigments.
В связи с высоким уровнем развития промышленного производства в настоящее время в окружающую среду выбрасывается большое количество токсикантов, опасных для растений и животных, что является серьезной экологической проблемой [1]. Среди поллютантов большую опасность представляют тяжелые металлы. Токсическое действие тяжелых металлов на растения проявляется как на организменном уровне, что проявляется в угнетении роста и гибели, так и на клеточном [2].
Большое значение для нормальной жизнедеятельности представляет окислительно-восстановительное равновесие. В клетках растений всегда присутствуют активные формы кислорода (АФК) - супероксидный анион радикал (О*2), синглетная формы кислорода (.O2), гидроксильный радикала (OH*), перекись водорода (Н2О2), но их концентрация невелика. Из-за нарушения обмена веществ, провоцируемого поступлением тяжелых металлов в растения, концентрация АФК в клетках возрастает [3]. В силу своей высокой активности, АФК способны вызывать повреждение важнейших биополимеров: нуклеиновых кислот, белков, липидов и углеводов. Наиболее активно свободнорадикальное окисление идет при атаке инициирующим радикалом диаллильного атома углерода, в связи с этим в реакцию наиболее активно вступают полиненасыщенные жирные кислоты липидов мембран. В растениях окислению подвергаются преимущественно линолевая, линоленовая и олеиновая кислоты [3].
Процесс перекисного окисления липидов проходит является цепной реакцией и может быть представлен в виде химической реакции:
R1-CH2-CH=CH-CH2-CH=CH-R2-COOH+O2→R1-CH2-CH=CH-CH(OOH)-CH=CH-R2-COOH→R1-CH2-CH=CH-CH(O•)-CH=CH-R2-COOH+•OH→R1-CH2-CH=CH-CH2-CH=CH-R2-COOH+•OH→H2O+L•, где L• - липидный радикал.
Первичные продукты перекисного окисления – диеновые конъюгаты – -СН2-СН2-СН=СН-СН=СН-СН2-. Образование и накопление диеновых конъюгатов увеличивает полярность гидрофобных углеводородных хвостов жирных кислот, которые образуют липидный бислой мембраны [4].
Шиффово основание (или азометин) – функциональная группа, названная в честь Гуго Шиффа. Шиффовы основания обладают общей формулой R1R2C=N-R3, где R3 – арильная или алкильная группа, которая делает Шиффово основание стабильной имино-группой. К образованию оснований Шиффа приводит реакция нуклеофильного присоединения аминогруппы белка к карбонильному атому углерода в молекуле промежуточного продукта – малонового диальдегида. Шиффовы основания являются конечными продуктами перекисного окисления липидов [4].
Перекисное окисление липидов приводит к увеличению проницаемости клеточных мембран, уменьшению стабильности липидного слоя и электрическому пробою.[5].
Для устранения последствий реакции ПОЛ организму необходима энергия, заключенная в органических веществах. Растения для их создания используют фотосинтез. Как известно, процесс фотосинтеза играет важнейшую роль не только для растений, но и для всех живых организмов.
В процессе фотосинтеза принимают участие пигменты- хлорофиллы. Основной пигмент фотосинтеза – хлорофилл А поглощает свет в голубой, фиолетовой и красной областях спектра. Вспомогательный пигмент фотосинтеза – хлорофилл В расширяет спектр поглощаемого света за счет его синей части. Из литературы известно пагубное воздействие тяжелых металлов на процесс фотосинтеза и содержание хлорофиллов [5].
Также активное участие в процессе фотосинтеза принимают каротиноиды. Они не только играют роль светособирающей антенны, но и защищают от избытка света. При низкой интенсивности света каротиноиды действуют как энергетическая антенна, поглощая свет в той области спектра, в которой не способен поглощать хлорофилл и перенося электроны в возбужденном состоянии к фотохимическим реакционным центрам [6].
Механизмы действия каротиноидов включают устранение избытка АФК, антиокислительный эффект и моделирующее действие на физическое состояние мембран [6].
Целью настоящей работы стало изучение биохимических показателей растений (содержания пигментов фотосинтеза и продуктов перекисного окисления липидов), выращенной на загрязненной тяжелыми металлами почве.
Материалом для исследований стали проростки овса посевного, как часто используемый тест-объект. Среди разнообразия тяжелых металлов было решено выбрать соли (сульфаты) меди и цинка, как наиболее важные элементы для жизни растений, а также как часто встречаемые токсиканты.
Уровень загрязнения был выбран на отметке в 2 ПДК по валовому содержанию соответствующих металлов в почве [7]. Соответствующие сульфаты, находившиеся в виде порошка, перемешивали с минеральной почвой, а затем высаживали в нее семена овса. Было поставлено 4 варианта эксперимента:
- Контроль – семена овса были посажены в почву без внесения тяжелых металлов
- О1 – овес находился в почве, загрязненной CuSO4 в концентрации, соответствующей 2 ПДК (110 мг/кг)
- О2 – овес находился в почве, загрязненной ZnSO4 в концентрации, соответствующей 2 ПДК (200 мг/кг)
- О3 – овес находился в почве, загрязненной CuSO4 (110 мг/кг) и ZnSO4 (200 мг/кг)
Растения росли в равных условиях освещенности и температуры. Эксперимент длился две недели. Каждые два дня проростки поливали отстоянной водой. Было определено содержание в клетках овса диеновых конъюгатов, шиффовых оснований и пигментов фотосинтеза по стандартным методикам [8,9]. Полученные результаты были подвергнуты стандартной статистической обработке [10].
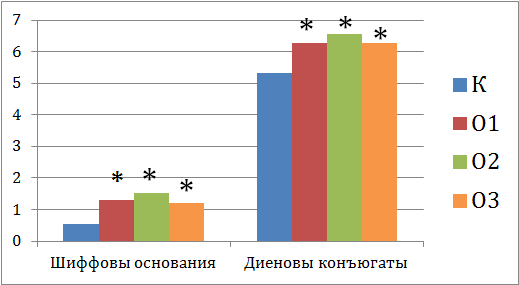
Как показал проведенный эксперимент, аккумуляция растениями тяжелых металлов привела к смещению окислительно-восстановительного равновесия в клетках растений. Увеличение содержания оснований Шиффа и диеновых конъюгатов по сравнению с контролем наблюдалось во всех вариантах опыта (рис. 1). Интересно, что в случае комбинированного воздействия двух металлов эффект оказывался менее выражным, что может быть связано с антагонистическим действием Cu и Zn. Известно, что ионы переходных металлов переменной валентности являются катализаторами перекисного окисления липидов [11]. В нашем эксперименте, действие Cu это подтверждает. Увеличение содержания продуктов ПОЛ в варианте О2 связанно с косвенным воздействием цинка – снижением активности различных ферментов, приводящему к нарушению обмена веществ.
Рис. 1 – Содержание оснований Шиффа и диеновых конъюгатов (усл.ед./мг липидов) в клетках овса, выращенного в загрязненной минеральной почве
Примечание: *- статистически достоверные различия между контролем и вариантом опыта (при Р ≤0,05)
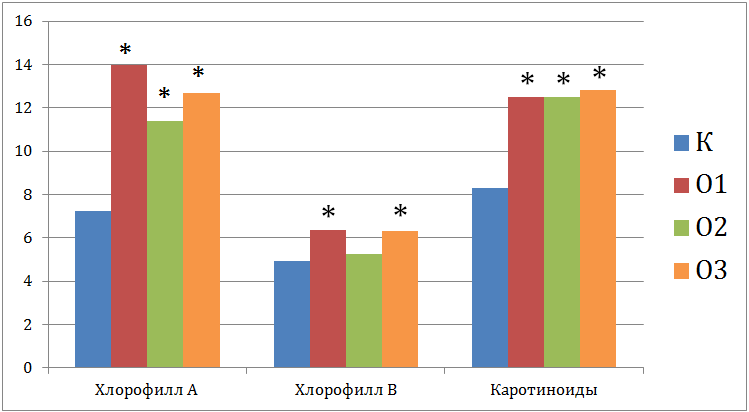
Было показано, что высокое содержание Cu и Zn в почве усиливало процесс фотосинтеза (рис.3). Особенно заметно увеличивалось содержание хлорофилла А в варианте О1. Содержание хлорофилла В также увеличивалось, но только в вариантах О1 и О3. Несоответствие полученных результатов с данными литературы [2] объясняется следующим. Токсический стресс, зафиксированный по увеличению содержания продуктов ПОЛ, создавал необходимость для растений синтезировать больше органических веществ, что и было отмечено по возросшему содержанию пигментов фотосинтеза. Можно предположить, что при дальнейшем продолжении эксперимента, содержание тяжелых металлов в растениях бы возросло, и стимуляция фотосинтетического процесса овса сменилась угнетением.
Рис. 2 – Содержание пигментов фотосинтеза (мг/100г) в растениях, выращенных в загрязненной минеральной почве
Кроме того, усиление реакции ПОЛ привело к активизации антиоксидантных систем овса, что сказалось на росте содержания каротиноидов во всех вариантах опыта по сравнению с контролем (рис.3)
Таким образом, повышенное, относительно ПДК, содержание Cu и Zn в минеральной почве приводило к увеличению содержания продуктов ПОЛ (оснований Шиффа и диеновых конъюгатов) в клетках овса. Как следствие, в растениях усиливался процесс фотосинтеза, повышалось содержание хлорофилла А (в первую очередь), В, каротиноидов.
Литература
- Башкин В.Н., Касимов Н.С. Биогеохимия. - М.: Научный мир, 2004. – 648 с.
- Полевой В. В. Физиология растений. – М.: Высшая школа, 1989. – 464 с.
- Половинкина Е.О., Синицына Ю.В. Окислительный стресс и особенности воздействия слабых стрессоров физической природы на перекисный гомеостаз растительной клетки. Учебно-методическое пособие. – Нижний Новгород: Нижегородский госуниверситет, 2010. – 62 с.
- Владимиров Ю.А. Свободнорадикальное окисление липидов и физические свойства липидного слоя биологических мембран / Ю.А. Владимиров // Биофизика. – 1987. – Т. 32 – №5. – С.830-844.
- Биоиндикация загрязнений наземных экосистем: пер. с нем. / Под ред. Р. Шуберта. – М.: Мир, 1988. – 350 с.
- Зотикова А. П. Динамика содержания и роль каротиноидов хвои кедра сибирского в высокогорье / А.П. Зотикова, Н.А. Воробьева, Ю.С. Соболевская // Вестник Башкирского университета. – 2001. – № 2. – С.67–69.
- Предельно-допустимые концентрации (ПДК) химических веществ в почвах (Госкомприрода СССР, № 02-2333 от 10.12.90)
- Шведова А. А., Полянский Н. Б. Метод определения конечных продуктов перекисного окисления липидов в тканях – флуоресцирующих шиффовых оснований / Исследование синтетических и природных антиоксидантов in vitro и in vivo: cб. науч. статей под ред. Бурлаковой Е. Б. - М.: Наука, 1992. - С. 72 –73.
- Шульгин И.А.,. Ничипорович А.А Расчет содержания пигментов с помощью номограмм // Хлорофилл. – Минск: Наука и техника, 1974. – С. 127-136.
- Лакин Г. Ф. Биометрия М.: Просвещение, 1980.-213 с.
- Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2-х томах. Т. 1. Пер. с англ.: – М.: Мир, 1993. - 384 с.
References
- Bashkin V.N., Kasimov N.S. Biogeohimija. - M.: Nauchnyj mir, 2004. – 648 s.
- Polevoj V. V. Fiziologija rastenij. – M.: Vysshaja shkola, 1989. – 464 s.
- Polovinkina E.O., Sinicyna Ju.V. Okislitel'nyj stress i osobennosti vozdejstvija slabyh stressorov fizicheskoj prirody na perekisnyj gomeostaz rastitel'noj kletki. Uchebno-metodicheskoe posobie. – Nizhnij Novgorod: Nizhegorodskij gosuniversitet, 2010. – 62 s.
- Vladimirov Ju.A. Svobodnoradikal'noe okislenie lipidov i fizicheskie svojstva lipidnogo sloja biologicheskih membran / Ju.A. Vladimirov // Biofizika. – 1987. – T. 32 – №5. – S.830-844.
- Bioindikacija zagrjaznenij nazemnyh jekosistem: per. s nem. / Pod red. R. Shuberta. – M.: Mir, 1988. – 350 s.
- Zotikova A. P. Dinamika soderzhanija i rol' karotinoidov hvoi kedra sibirskogo v vysokogor'e / A.P. Zotikova, N.A. Vorob'eva, Ju.S. Sobolevskaja // Vestnik Bashkirskogo universiteta. – 2001. – № 2. – S.67–69.
- Predel'no-dopustimye koncentracii (PDK) himicheskih veshhestv v pochvah (Goskompriroda SSSR, № 02-2333 ot 10.12.90)
- Shvedova A. A., Poljanskij N. B. Metod opredelenija konechnyh produktov perekisnogo okislenija lipidov v tkanjah – fluorescirujushhih shiffovyh osnovanij / Issledovanie sinteticheskih i prirodnyh antioksidantov in vitro i in vivo: cb. nauch. statej pod red. Burlakovoj E. B. - M.: Nauka, 1992. - S. 72 –73.
- Shul'gin I.A.,. Nichiporovich A.A Raschet soderzhanija pigmentov s pomoshh'ju nomogramm // Hlorofill. – Minsk: Nauka i tehnika, 1974. – S. 127-136.
- Lakin G. F. Biometrija M.: Prosveshhenie, 1980.-213 s.
- Marri R., Grenner D., Mejes P., Rodujell V. Biohimija cheloveka: V 2-h tomah. T. 1. Per. s angl.: – M.: Mir, 1993. - 384 s