ВЛИЯНИЕ ОКИСЛИТЕЛЬНОГО СТРЕССА НА ОРГАНИЗМ ЧЕЛОВЕКА
ВЛИЯНИЕ ОКИСЛИТЕЛЬНОГО СТРЕССА НА ОРГАНИЗМ ЧЕЛОВЕКА
Обзорная статья
Цейликман В.Э.1, Лукин А.А.2, *
1ORCID: 0000-0003-2935-7487;
2ORCID: 0000-0003-4753-3210;
1, 2 Южно-Уральский государственный университет, Челябинск, Россия
* Корреспондирующий автор (lukin3415[at]gmail.com)
АннотацияОкислительный стресс определяется как состояние дисбаланса между антиоксидантной и прооксидантной защитой организма. Цель этой статьи - выяснить связь окислительного стресса и видов свободных радикалов с различными аспектами здоровья человека. Из-за своего вредного воздействия на белки и нуклеиновые кислоты окислительный стресс вызывает хронические заболевания, такие как сердечно-сосудистые и нейродегенеративные, диабет и рак. Употребление большого количества обработанных пищевых продуктов, отсутствия физической активности, дефицит макро- и микроэлементов в питании – все это является причинами окислительного стресса, вызывающего воспалительные реакции в организме человека. В статье обсуждаются методы снижения окислительного стресса, а также отрицательное и положительное влияние на здоровье человека окислительного стресса.
Ключевые слова: окислительный стресс, гомеостаз, иммунитет, рак, сердечно-сосудистые заболевания, нейродегенеративные заболевания.
ON THE EFFECT OF OXIDATIVE STRESS ON THE HUMAN BODY
Review article
Tseylikman V.E.1, Lukin A.A.2, *
1 ORCID: 0000-0003-2935-7487;
2 ORCID: 0000-0003-4753-3210;
1, 2 South Ural State University (National Research University), Chelyabinsk, Russia
* Corresponding author (lukin3415[at]gmail.com)
AbstractOxidative stress is defined as a state of imbalance between the antioxidant and pro-oxidant defenses of the body. The aim of this article is to find out the relationship of oxidative stress and types of free radicals with various aspects of human health. Due to its harmful effects on proteins and nucleic acids, oxidative stress causes chronic diseases such as cardiovascular and neurodegenerative, diabetes and cancer. The use of a large amount of processed foods, lack of physical activity, deficiency of macro- and microelements in the diet can all become the causes of oxidative stress, causing inflammatory reactions in the human body. The article discusses methods of reducing oxidative stress, as well as the negative and positive effects of oxidative stress on human health.
Keywords: oxidative stress, homeostasis, immunity, cancer, cardiovascular diseases, neurodegenerative diseases.
Введение
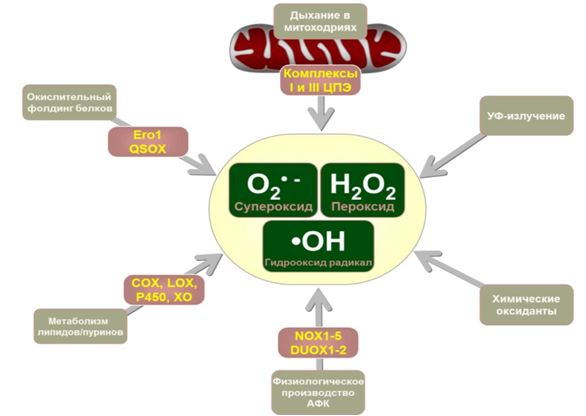
Во всех типах живых организмов непрерывно протекают реакции одноэлектронного восстановления, приводящего к формированию промежуточных продуктов восстановления молекулы кислорода. Образуемые таким образом химические соединения относятся к различным группам веществ как нерадикальной, так и радикальной природы, общим характерным свойством которых является высокая реакционная способность, вследствие чего они получили обобщенное название - активные формы кислорода (АФК). В частности, к данным соединениям относят: супероксидный анион – радикал (О2.-), перекись водорода (Н2О2), гидроксильный радикал (HO), синглетный кислород (1О2), гипогалоиды (HOCl, НОCI, НОBr, НОI, НОSCN), оксид азота (NO∙) и другие (Рис. 1).
Рис. 1 – Основные источники АФК в организме
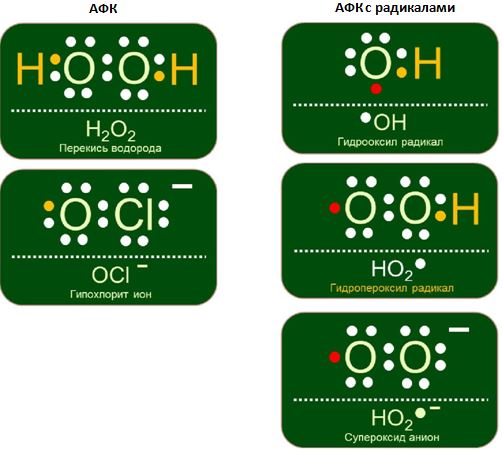
Свободный радикал (СР) - это молекула или её часть, имеющая неспаренный электрон на внешней атомной или молекулярной орбите. Свободные радикалы могут быть нейтральными или заряженными – так называемые ион-радикалы (Рис. 2).
Рис. 2 – Различные виды АФК
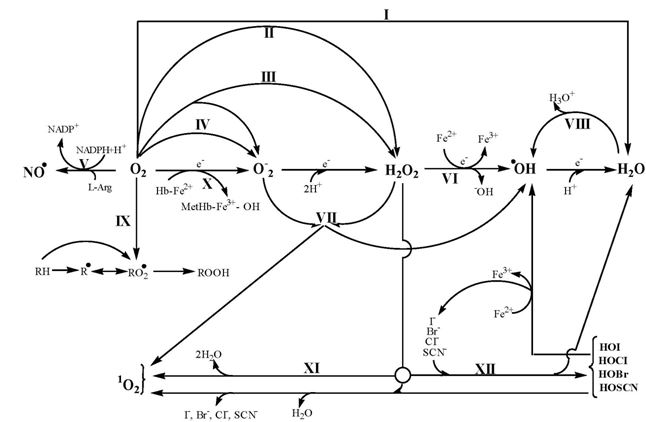
Механизмы образования АФК подразделяют на ферментативные и неферментативные. В частности, в ходе процессов одноэлектронного окисления или восстановления образуются заряженные СР, подразделяемые на катион- или анион-радикалы (Рис. 3) [1].
Рис. 3 – Основные биохимические пути и ферменты образования АФК:
I – цитохром-с-оксидаза; II – флавиновые оксидазы; III – ксантиноксидаза; IV –NADPH – оксидаза; V –NO-синтаза; VI – реакция Фентона; VII – реакция Хабера-Вайса; VIII – воздействие радиации; IX – перекисное окисление липидов; X–неферментативное окисление гемоглобина; XI– каталаза; XII – миелопероксидаза
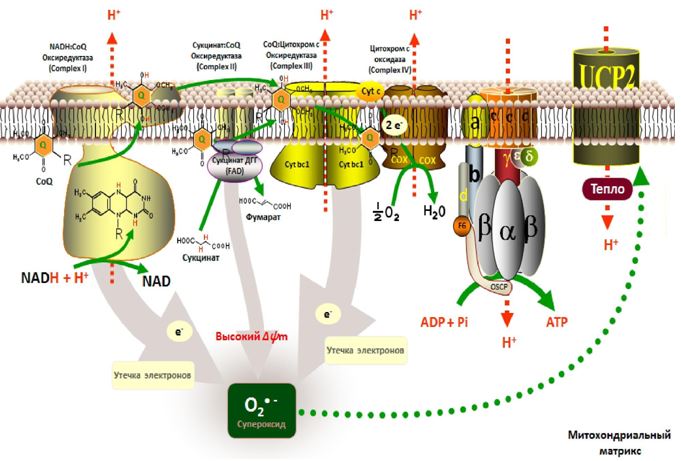
Митохондриальная цепь переноса электронов (ЦПЭ) является одним из наиболее значимых источников генерации АФК ввиду того, что потеря (или «утечка») электронов из ЦПЭ митохондрий (а также микросом) обуславливает дальнейшее взаимодействие с кислородом (Рис. 4).
Рис. 4 – Генерация АФК в дыхательной цепи
В настоящее время, без сомнения, мы наблюдаем всплеск проблем, связанных со здоровьем человека. Сердечно-сосудистые заболевания, гипертония, диабет, аутоиммунные заболевания и различные виды рака справедливо можно назвать основными заболеваниями XXI века. Все эти заболевания связаны с различными факторами – стресс, неправильное питание, экологическая обстановка, малоподвижные образ жизни и т.д.
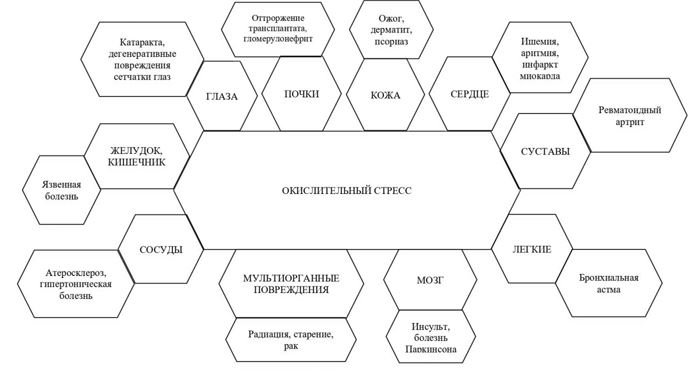
Последние медицинские обзоры и исследования доказали, что окислительный стресс служит потенциальным источником для ряда хронических заболеваний. На рис. 5 представлены болезни, вызванные окислительным стрессом [2].
Далее рассмотрим влияние окислительного стресса на организм и системы человека.
Рис. 5 – Болезни, вызываемые окислительным стрессом
Окислительный стресс и гомеостаз
Каждая клетка человеческого организма должна поддерживать состояние гомеостаза между оксидантами и антиоксидантами. Около 3% легочного кислорода превращается АФК. Образование АФК и других свободных радикалов очень важный процесс, поскольку он помогает в образовании аденозинтрифосфорной кислоты (АТФ) и способствуют нормальному функционированию человеческого организма. Свободные радикалы представляют потенциальную опасность для организма. При окислительном стрессе митохондрии образуют больше АТФ, чтобы ослабить эффекты окисления в организме, но чем больше АТФ, тем больше образуется АФК. Эти АФК будут циркулировать в клетке, вызывая активацию реактивных соединений азота. Присутствие соединений, реагирующих с азотом, объединяющих АФК, вызывает самоповреждение ткани за счет внедрения генов в ДНК и митохондриальных ферментов.
Окислительный стресс и иммунитет
Хорошо известно, что иммунная система и окислительный стресс работают совместно. Иммунная система использует оксиданты вместе с АФК и активными формами азота (АФА) для уничтожения патогенов. Фермент, называемый никотинамидадениндинуклеотидфосфатом (НАДФ+), продуцирует АФК, когда иммунитет ослаблен [3]. Производство АФА в избыточном количестве вызывает большее окисление в организме, что приводит к образованию свободных радикалов.
Присутствие свободных радикалов запускает процесс аутолиза лейкоцитов, тем самым нарушает защитные силы организма и приводит к аутоиммунным заболеваниям.
Есть много примеров аутоиммунных заболеваний, вызванных окислительной модификацией собственных белков, в том числе - системная красная волчанка (СКВ), сахарный диабет и диффузная склеродермия [4], [5]. Кроме того, окислительный стресс представляет серьезную угрозу для некоторых тканей. Одним из распространенных примеров являются β-клетки, продуцирующие инсулин, в островках Лангерганса.
Психологический стресс играет фундаментальную роль в развитии аутоиммунного патогенеза наряду с другими гормонами стресса.
Окислительный стресс и рак
Канцерогенез – сложный патофизиологический процесс зарождения и развития опухоли. Начальные шаги, связанные с развитием рака, мутацией или старением, являются результатом окислительного повреждения клеточной ДНК. Побочные продукты окисления могут привести к измененным генным вариациям, мутациям или могут привести к раку. Повреждение цепей ДНК вызывается изменением пуриновых и пиримидиновых связей, которое инициируется АФК. В обычном клеточном механизме окислительно-восстановительные металлы и АФК контролируют механизм репарации ДНК, взаимодействуя с ферментами, такими как катализ, пероксидазы и супероксиддисмутаза. Остатки свободных радикалов выводятся витаминами Е, С и глутатионом вместе с этими ферментами. Окислительный стресс отключает этот путь апоптоза окислительно-восстановительного потенциала без способности восстанавливать ДНК, а избыточное производство АФК в организме вызывает развитие канцерогенеза [6]. Факторы, продуцируемые окислительным стрессом, такие как фактор некроза опухоли, протеазы, АФК, являются предшественниками роста и пролиферации опухоли. Эти факторы вызывают распространение рака по лимфатическим сосудам за счет деградации мембран и проникновение в соседние ткани за счет нарушения сосудистой сети клеток [7], [8]. Во многих исследованиях доказано, что окислительный стресс является возбудителем развития рака [9].
Ожирение и дисфункция адипоцитов
Ожирение является хроническим воспалительным заболеванием, которое модулируется окислительным стрессом, вызванным в организме инфильтрацией жировой ткани, избытком углеводов и жиров.
Воспалительные цитокины, участвующие в жировом обмене, тесно связаны с абдоминальным ожирением. Окислительный стресс играет жизненно важную роль в воспалении, вызванном ожирением.
Чрезмерное потребление углеводов, белков, липидов и питательных веществ, метаболические нарушения или инфильтраты моноцитов, включая Т-клетки, тучные клетки и макрофаги, модулируются адипоцитами и вызывают нарушение жировых клеток [10], [11].
Сахарный диабет и окислительный стресс
Диабет 2 типа в настоящее время составляет почти 90-95 % случаев сахарного диабета. Это наиболее распространенное, сложное и прогрессирующее заболевание со многими осложнениями, если его не контролировать. Среди многих других невропатий наиболее распространены ретинопатия, нефропатия, микро- и макрососудистые повреждения.
Сахарный диабет вызывается многофакторными факторами, среди которых окислительный стресс относят к основным факторам риска в его развитии. Окислительная среда модифицирует нечувствительность к инсулину либо за счет повышения резистентности к инсулину, либо за счет изменения толерантности к глюкозе. В обоих случаях организм подвергается гипергликемическому состоянию, что приводит к прогрессированию дальнейшего развития окислительного состояния [12]. Осложнения сахарного диабета также связаны с окислительным стрессом [13].
Сердечно-сосудистые заболевания и окислительный стресс
Сердечно-сосудистая система также вовлечена в окислительный стресс. На его развитие и функции сильно влияет перепроизводство АФК и снижение присутствия антиоксидантов [14]. Окислительный стресс может вызывать митохондриальную дисфункцию, повышенная продукция АФК будет вызывать большее окисление жирных кислот и повышать активность НАДФН, расстройства, такие как дисфункция эндотелия, меньшая биодоступность сосудорасширяющих средств, а эндотелиальные сократительные факторы способствуют развитию атеросклеротического заболевания [15], [16].
Нейродегенеративные заболевания и окислительный стресс
Нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, рассеянный склероз и депрессия тесно взаимосвязаны с окислительным стрессом, при этом старение является основным связующим звеном между этими двумя явлениями. Повреждение нервной ткани в основном является результатом митохондриальной дисфункции. Болезнь Альцгеймера — это огромная проблема для населения нашей планеты. Болезнь Альцгеймера возникает из-за накопления β-амилоидных бляшек на нервных клетках головного мозга, и ее причина до сих пор не известна. Тяжесть заболевания увеличивается с годами, и в настоящее время лекарства от этой болезни не существует [17]. Из числа заболевших 15 % относятся к возрастной группе 65–74 лет и 44 % - к возрастной группе 75–84 года. Старение и генетическая предрасположенность считаются неизбежными факторами риска болезни Альцгеймера. С другой стороны, факторы окружающей среды, инсулинорезистентность, ожирение и метаболические синдромы также являются факторами риска болезни Альцгеймера. Такие факторы, как регулярная физическая активность, средиземноморская диета, ограничение калорий и поддержание идеальной массы тела (или периодическое голодание), сокращение курения, борьба с такими заболеваниями, как диабет и гипертония, и непрерывное обучение могут отсрочить или предотвратить снижение когнитивных функций, связанных со старением организма [18].
Заключение
Окислительный стресс и свободные радикалы очень вредны для здоровья человека. Они играют потенциальную роль в развитии, прогрессировании и возникновении многих патологий и заболеваний, чередуя нормальный физиологический механизм, переходя от простого к сложному уровню заболеваний, формируя простую смену иммунитета с патологическим вовлечением рака. В последнее время внимание многих исследователей привлекли антиоксиданты, так как эта группа соединений играет большую роль в противодействии реакциям окислительного стресса, тем самым предотвращая заболевания и укрепляя здоровье человека. По результатам многих исследований можно сделать вывод, что окислительный стресс и свободные радикалы опасны для здоровья человека. В качестве средства лечения можно использовать антиоксиданты и прооксиданты. Окислительный стресс можно уменьшить тремя способами: во-первых, путем уменьшения воздействия загрязнителей окружающей среды, во-вторых, за счет увеличения количества антиоксидантов как эндогенно, так и экзогенно, и, наконец, за счет усиления механизма производства и эффективности митохондриальной окислительной генерации.
| Конфликт интересов Не указан | Conflict of Interest None declared |
Список литературы / References
- Poli G. Oxidative stress and cell signaling / G. Poli, G. Leonarduzzi, F. Biasiet al. // Current Medicinal Chemistry. – 2004. - vol. 11. - № 9. – P. 1163–1182.
- Hampton M. B. Inside the neutrophil phagosome: oxidants, myeloperoxidase, and bacterial killing / M. B. Hampton, A. J. Kettle, C. C. Winterbourn // Blood. – 1998. - vol. 92. - № 9. – P.3007–3017.
- Babior B. M. NADPH oxidase: an update / B. M. Babior // Blood. – 1999. - vol. 93. - № 5. – P. 1464–1476.
- Casciola-Rosen L. Scleroderma autoantigens are uniquely fragmented by metal-catalyzed oxidation reactions: implications for pathogenesis / L. Casciola-Rosen, F. Wigley,A. Rosen // Journal of Experimental Medicine. –1997. - vol. 185. - № 1. -P. 71–79.
- Buttari B. Oxidized 2- glycoprotein I induces human dendritic cell maturation and promotes a T helper type 1 response / B. Buttari, E. Profumo, V. Mattei et al. // Blood. – 2005. - vol. 106. - № 12. - P. 3880–3887.
- Kryston T. B. Role of oxidative stress and DNA damage in human carcinogenesis / T. B. Kryston, A. B. Georgiev, P. Pissiset al.// Mutation Research. – 2011. - vol. 711. - № 1-2. – P. 193–201.
- Davalos A. R. Senescent cells as a source of inflammatory factors for tumor progression / A. R. Davalos, J. Coppe, J. Campisiet al.// Cancer and Metastasis Reviews. – 2010. - vol. 29. - № 2. - P. 273–283.
- Vire B. TOSO, the Fc receptor, is highly expressed on chronic lymphocytic leukemia B cells, internalizes upon IgM binding, shuttles to the lysosome, and is downregulated in response to TLR activation / B. Vire, A. David, A. Wiestner // Journal of Immunology. – 2011. - vol. 187. - № 8. - P. 4040–4050.
- Tan B. L. Brewers’ rice modulates oxidative stress in azoxymethane-mediated colon carcinogenesis in rats / B. L. Tan, M. E. Norhaizan, K. Huynhet al.// World Journal of Gastroenterology. - 2015. - vol. 21. - № 29. - P. 8826–8835.
- Hagen T. M. Oxidative stress, redox imbalance, and the aging process / T. M. Hagen // Antioxidants and Redox Signaling. – 2003. - vol. 5. - № 5. - P. 503– 506.
- Babbar N. Targeting polyamines and inflammation for cancer prevention / N. Babbar, E. W. Gerner // Recent Results in Cancer Research. – 2011. - vol. 188. - P. 49–64.
- Ceriello A. Possible role of oxidative stress in the pathogenesis of hypertension / A. Ceriello // Diabetes Care. - 2008. - vol. 31. - № 2. - P. 181–184.
- Chen X. F. Effect of puerarin in promoting fatty acid oxidation by increasing mitochondrial oxidative capacity and biogenesis in skeletal muscle in diabetic rats / X. F. Chen, L. Wang, Y. Z. Wuet al. // Nutr. Diabetes. –2018. - № 8. – P. 1–13.
- Bugger H. Molecular mechanisms for myocardial mitochondrial dysfunction in the metabolic syndrome / H. Bugger, E. D. Abel // Clinical Science. – 2008. - vol. 114. - № 3.- P. 195–210.
- Lee R. Evaluating oxidative stress in human cardiovascular disease: methodological aspects and considerations / R. Lee, M. Margaritis, M. K. Channonet al.// Current Medicinal Chemistry. – 2012. - vol. 19. - № 16. - P. 2504–2520.
- Ilkun O. Cardiac dysfunction and oxidative stress in the metabolic syndrome: an update on antioxidant therapies / O. Ilkun, S. Boudina // Current Pharmaceutical Design. – 2013. - vol. 19. - № 27. - P. 4806–4817.
- Tönnies E. Oxidative stress, synaptic dysfunction, and Alzheimer’s disease / E. Tönnies, E. Trushina // Journal of Alzheimer’s Disease. – 2017. - vol. 57. - № 4. - P. 1105–1121.
- Butterfield D. A. Amyloid β-peptide (1-42)-induced Oxidative Stress and Neurotoxicity: Implications for Neurodegeneration in Alzheimer’s Disease Brain. A Review / D. A. Butterfield // Free Radical Research. –2009. - vol. 36. - № 12. - P. 1307–1313.