ВЛИЯНИЕ КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ НА КЛЕТОЧНЫЕ ПРОЦЕССЫ
ВЛИЯНИЕ КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ НА КЛЕТОЧНЫЕ ПРОЦЕССЫ
Научная статья
Леонова Т.С.1, Вихнина М.В.2, Гришина Т.В.3, Леонова Л.Е.4, Фролов А.А.5, Романовская Е.В.6, *
1 ORCID: 0000-0002-7153-5059;
2 ORCID: 0000-0001-8912-5886;
3 ORCID: 0000-0002-5306-2980;
4 ORCID: 0000-0003-4560-2278;
5 ORCID: 0000-0002-7593-77171;
6 ORCID: 0000-0001-8912-5886;
1, 2, 3, 4, 5, 6, Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
* Корреспондирующий автор (e.romanovskaya[at]spbu.ru)
Аннотация
Образующиеся в результате неферментативного взаимодействия белков с углеводами конечные продукты глубокого гликирования (Advanced Glycation End products, AGEs) представляют собой группу модифицированных аминокислотных остатков, которые могут медленно накапливаться в организме во время нормального процесса старения. Помимо эндогенных AGEs, в организме человека эти токсичные соединения появляются за счет потребления продуктов питания, прошедших термическую обработку или подвергавшихся длительному хранению, активного и пассивного курения. AGEs могут вызывать возникновение и прогрессирование не только осложнений диабета, но и являются основой патофизиологии многих других болезней, включая сердечно-сосудистые заболевания и нейродегенеративные болезни. И экзогенные, и эндогенные AGEs в организме человека играют существенную роль в развитии воспалительного ответа. В предлагаемом обзоре рассматриваются структура и функции основных рецепторов AGEs и активируемые ими сигнальные пути, а также некоторые биологические эффекты этой активации.
Ключевые слова: гликирование, конечные продукты глубокого гликирования, рецепторы, сигнальные пути
INFLUENCE OF ADVANCED GLYCATION END PRODUCTS ON CELLULAR PROCESSES
Research article
Leonova T.S.1, Vikhnina M.V.2, Grishina T.V.3, Leonova L.E.4, Frolov A.A.5, Romanovskaya E.V.6, *
1 ORCID: 0000-0002-7153-5059;
2 ORCID: 0000-0001-8912-5886;
3 ORCID: 0000-0002-5306-2980;
4 ORCID: 0000-0003-4560-2278;
5 ORCID: 0000-0002-7593-77171;
6 ORCID: 0000-0001-8912-5886;
1, 2, 3, 4, 5, 6 St. Petersburg State University, St. Petersburg, Russia
* Corresponding author (e.romanovskaya[at]spbu.ru)
Abstract
Advanced Glycation End products or AGEs are formed as the result of non-enzymatic interaction of proteins with carbohydrates and belong to the group of modified amino acid residues that can slowly accumulate in the body during the normal process of aging. In addition to endogenous AGEs, these toxic compounds appear in the human body due to the consumption of food that has been heat treated or subjected to long-term storage, due to active and passive smoking. AGEs can cause the onset and progression of complications of diabetes, and become the basis of the pathophysiology of many other diseases including cardiovascular and neurodegenerative ones. Both exogenous and endogenous AGEs play a significant role in the development of the inflammatory response in the human body. The proposed review examines the structure and functions of the main AGEs receptors and the signaling pathways they activate, as well as some of the biological effects of this activation.
Keywords: glycation, advanced glycation end products, receptors, signaling pathways
Конечные продукты глубокого гликирования (AGEs) рассматриваются как потенциально токсичные молекулы, накапливающиеся в организме человека с возрастом и вызывающие возникновение или прогрессирование не только осложнений диабета, но и многих других заболеваний, включая сердечно-сосудистые и нейродегенеративные.
Образование эндогенных AGEs
Гликирование представляет спонтанную неферментативную реакцию белков с сахарами (реакция Майяра), обусловленную взаимодействием между восстанавливающими сахарами или дикарбонильными продуктами их распада (глюкоза, фруктоза, галактоза, манноза, рибоза, реакционноспособные триозы – интермедиаты энергетического метаболизма) и аминогруппами остатков лизина, аргинина и серусодержащих аминокислотных остатков). В результате быстро образуются лабильные Шиффовы основания, которые претерпевают внутримолекулярную перестройку и образуют относительно стабильные продукты Амадори и Хайнса (кетозамины, дезоксикетозы или дезоксиальдозы) [1, C. 5-96]. В дальнейшем продукты Амадори подвергаются дегидратации, циклизации, окислению, кросс-линкингу и полимеризации, что приводит к образованию интермедиатов (3-дезоксиглюкозон, глиоксаль и метилглиоксаль) и затем к формированию стабильных модифицированных аминокислотных остатков, называемых конечными продуктами глубокого гликирования или Advanced Glycation End products, AGEs (рис. 1) [2, C. 587], [3, C. 15]. Таким необратимым изменениям при физиологических температуре и рН подвергаются только долгоживущие белки (такие, как гемоглобины, альбумины, коллаген, кристаллины). К AGEs, обнаруженным в тканях животных и для которых показаны биологические эффекты относятся, в частности, карбоксиметиллизин, карбоксиэтиллизин, пирралин, пентозидин, глюкозопан, аддукты гидроимидазолона, глиоксаль-лизиновый и метилглиоксаль-лизиновый димеры [4, C. 352], [5, 58].
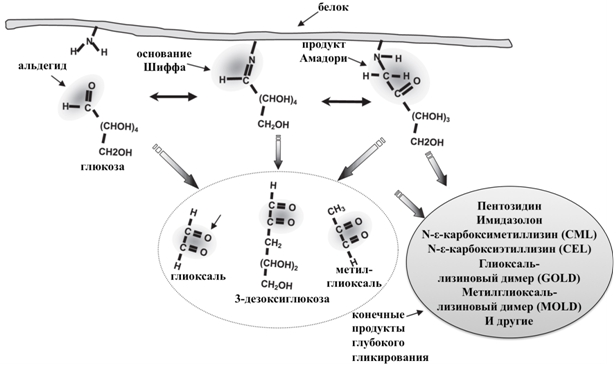
Рис. 1 – Возможные пути образования конечных продуктов глубокого гликирования [2, С. 583, с изменениями]
В процессе гликирования образуются активные формы кислорода, которые вносят свой вклад в индуцированные гликированием модификации белков, часто называемые «гликоокислением». Этим может объясняться и увеличение накопления AGEs в условиях окислительного стресса и воспаления [6, C. 10], [7, C. 8].
Экзогенные AGEs
Основными источниками экзогенных AGEs являются пища, прошедшая тепловую обработку, и табак (сигаретный дым). AGEs образуются в ходе приготовления богатой белками и жирами пищи при высокой температуре, придавая ей коричневую окраску [1, C. 105]. Причем показано, что короткие воздействия высоких температур приводят к образованию большего количества AGEs, чем длительное воздействие более низких; приготовление пищи с использованием воды и СВЧ также снижает образование AGEs [8, C. 2], [9, C. 20], [10, C. 465].
Можно выделить как минимум три возможных механизма повреждающего действия на клетки и ткани эндогенных и экзогенных AGEs: активация рецептор-опосредованных сигнальных путей, приводящих прежде всего к окислительному стрессу и воспалению и модуляции экспрессии генов; изменение структуры и функции стабильных долгоживущих белков, в частности, белков соединительной ткани, за счет необратимого кросс-линкинга с AGEs; прямое гликирование внутриклеточных белков и липидов, приводящее к нарушению функций клетки [11, C. 745].
Рецепторы, связывающие AGEs
Рецепторы, способные связываться с AGEs, локализованы на моноцитах, макрофагах, эндотелиальных и других клетках. Результатом связывания может быть удаление и разрушение AGEs или активация внутриклеточного сигналлинга. Выделяют три группы рецепторов AGEs. Первая группа включает семейство AGE-R, включая AGE-R1 (80K-H), AGE-R2 (OST-48), AGE-R3 (галектин-3) и LOX-170. Эти рецепторы в основном вовлечены в эндоцитоз и удаление AGEs. Так, AGE-R1 препятствует AGE-индуцированному увеличению активных форм кислорода и подавляет активацию RAGE-зависимых сигнальных путей, в частности, подавляет активацию NF-kB-зависимого сигнального пути [12, C. 420], [13, C. 710]. Ко второй группе относят семейство скавенджер-рецепторов макрофагов SR-A; SR-B: CD36, SR-BI, SR-E: LOX-1; FEEL-1; FEEL-2, основной функцией которых является эндоцитоз и внутриклеточная деградация [14, C. 6140].
Третий класс рецепторов – это хорошо охарактеризованные мультилигандные рецепторы RAGE (Receptor For Advanced Glycation End Products), структура и функции которых будут рассмотрены далее.
Было показано, что экспрессия RAGE свойственна для таких типов клеток, как моноциты/макрофаги, Т-лимфоциты, клетки эндотелия, дендритные клетки, фибробласты, гладкомышечные клетки, хондроциты и кератиноциты [15, C. 2248]. Кроме того, RAGE экспрессируется почти во всех типах клеток ЦНС, включая микроглию, астроциты и нейроны [16, C. 60].
RAGE был описан в эндотелиальных клетках легких быка в 1992 г., является трансмембранным гликопротеином типа I, принадлежащим суперсемейству иммуноглобулинов (Ig) с молекулярной массой 35 кДа [17, C. 15000]. Молекулярная масса RAGE человека составляет примерно 50 кДа с учетом посттрансляционных модификаций.
RAGE состоит из трех основных доменов – экстраклеточного лиганд-связывающего, содержащего иммуноглобулиноподобные регионы V (аминокислотные остатки 23–119), C1 (120–233) и C2 (234–325), одинарной трансмембранной спирали (343–363) и короткого С-терминального цитоплазматического домена (364–404) (рис. 2) [18, C. 2], [19, C. 695]. V-домен связывает большинство лигандов RAGE, тогда как цитоплазматический конец ответственен за трансдукцию сигнала. Вторичная структура V-домена состоит из двух β-слоев, короткой α-спирали и неупорядоченной спирали. V и C1-домены представляют собой плотно связанную структурную единицу (VC1), которая связана гибким линкером из пяти аминокислотных остатков (231–237) с C2-доменом. VC1 обогащен положительно заряженными аминокислотными остатками (для изолированного VC1-домена pI=9.9), в противоположность отрицательно заряженному С2-домену (pI=4.2) [20, C. 280]. Для RAGE показано наличие альтернативного сплайсинга, в результате которого могут образовываться его различные функциональные формы. Так, одна из них лишена N-концевого V-домена, но локализована в цитоплазматической мембране. Вторая форма лишена С-концевого цитоплазматического домена и не способна участвовать в сигналлинге. Возможно также образование растворимой формы, получившей название sRAGE, и содержащей все иммуноглобулиноподобные домены [21, C. 6], [13, C. 709]. Еще один путь возникновения такой растворимой формы – это расщепление полноразмерной формы RAGE металлопротеазами ADAM10 и MMP9 [22, C. 35510]. Сывороточный sRAGE может действовать как внеклеточный рецептор-ловушка (Decoy Receptor) для связывания различных лигандов. В противоположность самому RAGE, sRAGE ингибирует миграцию лейкоцитов, инактивирует продукты гликозилирования, тормозит развитие окислительного стресса и воспаления [23, C. 1830].
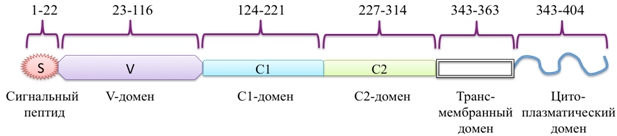
Рис. 2 – Доменная организация RAGE человека
Образование комплекса AGE - RAGE приводит к индукции окислительного стресса и воспалению и ассоциирована с многими патологиями [24, C. 25]. Детально исследовали взаимодействие синтетического полипептида, содержащего модифицированные метилглиоксалем группы: N-карбоксиметиллизин, N-карбоксиэтиллизин и гидроимидазолоны. Показано, что полость V-домена, образованная заряженными аминокислотными остатками K52, R98, K110 совместно с E50 и E108 представляет собой благоприятное окружение для связывания вышеперечисленных лигандов. Эффект связывания исследуемых лигандов с RAGE был подтвержден фосфорилированием JNK в альвеолярных эпителиальных клетках человека А549 [25, C. 3333].
Первоначально RAGE были охарактеризованы, как рецепторы, связывающие AGEs, однако позднее было показано, что эти рецепторы активируются большим количеством лигандов. Выяснилось, что сигнальные пути, опосредуемые RAGE, сложны и клетки по-разному отвечают на активацию рецептора. На активацию RAGE-зависимых каскадов влияют разнообразные факторы. Клеточный ответ, индуцированный взаимодействием RAGE с лигандом, зависит от вида и концентрации лиганда, от присутствия в среде других лигандов, типа клеток и концентрации RAGE на их поверхности, наличия в клетке молекул, участвующих в передаче сигнала, и от уже активированных в клетке сигнальных путей [26, C. 17]. Первым лигандом, для которого было показано связывание с RAGE и который не относится к AGEs, был HMGB1. Будучи изначально описанным как негистоновый белок, архитектурный фактор хроматина, он также относится к группе веществ, ассоциированных с опасностью (повреждением), способных инициировать неинфекционный воспалительный ответ (DAMP) [27, C. 10]. К другим эндогенным лигандам, связывающим RAGE, относятся белки семейства S100 (небольшие кальций-связывающие белки, содержащие два структурных мотива «EF-рука», также охарактеризованные как DAMP и обладающие цитокин-подобным действием), β-амилоид (Аβ40 и Аβ42), экстраклеточная ДНК, фосфолипиды и гликозамингликаны [28, C. 355]. В результате взаимодействия RAGE с одним из перечисленных лигандов активируется ряд компонентов внутриклеточных сигнальных каскадов, в частности протеинкиназа В, протеинкиназа С, киназа гликоген-синтазы; GSK3β; pSrc- и PI3K-киназа, Rac и Ras ГТФазы, ERK1/2-, JNK-, MEK-киназы; p38 MAP- и ROCK киназы, белок раннего ответа 1Egr-1, транскрипционные факторы NF-kB и STAT3 (см. обзор [29]).
Показано, что RAGE способны к образованию димеров и олигомеров как в составе липидных микродоменов (рафтов), так и в растворимой форме, причем еще до связывания лиганда [30, C. 2048].
В клетках меланомы MelJuSo с помощью антител к N-16 фрагменту RAGE методами вестерн-блоттинга и иммунофлуоресценции были выявлены мономеры и димеры рецепторов с молекулярной массой от 55-60 до 120 и более кДа [31, C. 130]. Для β2-интегрина Mac-1 показано, что олигомеры в комплексе с лигандом в составе липидного рафта могут содержать четыре и более молекул RAGE [32, C. 2190]. При исследовании механизмов влияния докозогексаеновой кислоты (DHA) на диабетическую ретинопатию на культуре клеток микроглии было показано, что DHA значительно снижает степень вовлечения RAGE в липидные рафты [33, C. 718]. Оказалось, что низкомолекулярные фракции сои, являющиеся антагонистами RAGE-зависимых сигнальных путей, обладают аналогичным действием [34, C. 1839]. Связывание с лигандами стабилизирует рецепторы и их олигомеры, что показано для AGEs, белков семейства S100 белки и Аβ-олигомеров. По-видимому, олигомеризация играет существенную роль в повышении специфичности связывания с лигандом, в модуляции функции рецептора и активации сигнального каскада [35, C. 1303].
Ассоциация рецепторов в димеры и в высшие олигомерные формы облегчается образованием дисульфидных мостиков и нековалентных взаимодействий. Структурные исследования растворимых и мембранных олигомеров проводились с применением спектроскопии ЯМР в растворе и масс-спектрометрии. Было показано, что отрицательно заряженный C2-домен стабилизирует структуру гомодимера растворимой формы RAGE через взаимодействие с положительно заряженным VC1-доменом. Ключевыми для димеризации и олигомеризации являются аминокислотные остатки K110, R114, R116 VC1-домена и остатки E125, D128, S131 и S307 С2-домена [36, C. 1518].
Для мембранной формы RAGE также показано, что она существует в равновесии между мономером и димером. Интересно, что в образовании мембрано-связанного димера, помимо электростатических взаимодействий, существенную роль играет образование ковалентной связи между остатками цистеина V-доменов. Образование димера облегчает связывание AGEs и усиливает фосфорилирование ERK, высвобождение цитокинов и полимеризацию актина [37, C. 58].
Сигнальные пути, активируемые RAGE-AGEs
Связывание лигандов с RAGE активирует ряд сигнальных путей, клеточный ответ зависит от лиганда, микроокружения и типа клеток.
Первыми идентифицированными лигандами RAGE были AGEs, образование которых было обсуждено выше. Цитоплазматический домен RAGE не имеет тирозинкиназной активности, ключевым медиатором трансдукции RAGE-зависимого сигналлинга является белок млекопитающих Diaphanous (mDia1) [28, C. 362]. Связывание эндогенных и экзогенных AGEs со своими рецепторами прежде всего вызывает провоспалительный ответ, опосредованный транскрипционным фактором NF-kB, ключевым регулятором генной активности при иммунном ответе на воспаление [38, C. 79]. Стимуляция RAGE приводит к окислительному стрессу и вызывает активацию митоген-активируемого киназного каскада (MAPK), что приводит к высвобождению и активации NF-κB [39, C. 47].
Накопление отличных от AGEs лигандов RAGE, в частности, HMGB1, вызываемое повреждением тканей и активацией клеток при воспалительной реакции, стимулирует RAGE-зависимую активацию транскрипции мРНК субъединицы р65 фактора NF-kB, что обеспечивает высокий уровень активности NF-kB. В свою очередь, обратная связь в RAGE-сигнальном пути поддерживается NF-kB-зависимой активацией экспрессии RAGE, что приводит к дополнительному усилению исходного сигнала [40, C. 25R].
Высокие уровни NF-kB в результате активации RAGE-опосредованных сигнальных путей и развитие патологических реакций под воздействием AGEs были показаны на различных моделях воспаления: кишечник мыши, гладкие мышцы легкого крысы, нейрональной культуры клеток РС12 [41, C. 275].
После запуска RAGE-зависимого сигнального каскада одним из механизмов регуляции уровня экспрессии рецепторов является их интернализация [42, C. 117]. Обработка клеток нейробластомы мыши Neuro-2a, экспрессирующих на плазматической мембране RAGE, индуцировала фосфорилирование киназ ERK1 и ERK 2, что приводило к транспорту NF-kB в ядро и его связывание с ДНК, тогда как предварительная инкубация клеток с ингибиторами интернализации рецепторов (дансилкадаверином или оксидом фениларсина) подавляла активацию МАР-киназного каскада [43, C. 26].
Эффекты AGEs, не опосредованные связыванием с рецепторами
Образование AGE меняет функции некоторых важных белков клеточного матрикса. Так, коллаген стенок кровеносных сосудов имеет относительно длинное время полужизни, за это время он может подвергаться значительному неферментативному гликированию, что вносит существенный вклад в развитие атеросклероза. Показано, что поперечные сшивки под воздействием AGEs образуются в растворимых белках плазмы крови – сывороточном альбумине, протромбине и фибриногене [44, C. 175]. Ковалентные кросс-линки также образуются в иммуноглобулинах и липопротеинах низкой плотности (LDL) [45, C. 190]. Образование AGEs на коллагене IV типа базальных мембран подавляет возможность латеральной ассоциации этих молекул в нормальную сеть. Также с коллагеном IV типа AGE формируют кросс-линки с гепаран-сульфатами протеогликанов [46, C. 10].
Гликирование апопротеина В и фосфолипидных компонентов LDL приводит к их функциональным изменениям и сверхвосприимчивости к окислительным модификациям. В дальнейшем, поглощение гликированных LDL макрофагами приводит к их избытку по сравнению с нативными из-за низкой аффинности к ним неспецифических скавенджер-рецепторов. Модификациям посредством AGEs в процессе старения и диабета подвергаются и другие структурные белки - миелин, тубулин и кристаллин хрусталика, внося свой вклад в развитие такой патологии, как катаракта.
Биологические эффекты AGEs
AGEs, будучи продуктами неферментативного гликозилирования, накапливаются в организме человека с возрастом, у больных сахарным диабетом [47, C. 165], в очагах хронического воспаления, а также при тяжелых метаболических нарушениях. AGEs, как эндогенные, так и экзогенные, могут вызывать различные клеточные ответы, что приводят к множественным расстройствам здоровья и заболеваниям [48, C. 1075].
Одним из осложнений диабета является развитие хронического воспаления, которое вызывается процессами гибели клеток, приводящими к формированию инфламмасом в эффекторных клетках, продукции провоспалительных цитокинов, развитию резистентности к инсулину [49, C. 52], [50, C. 414], [51, C. 710]. Хроническое воспаление опосредовано, в частности, накоплением AGEs, вызывающих окислительный стресс, активацию лейкоцитов и, как результат, развитие эндотелиальной дисфункции при сахарном диабете [52, C. 1569], [35, C. 1303], [53, C. 308]. В экспериментах in vitro показано, что интермедиаты гликирования глиоксаль и метилглиоксаль вызывают снижение активности антиоксидантных ферментов супероксиддисмутазы на 39% и 52%, Se-содержащей глутатионпероксидазы из эритроцитов быка 89% и 94% и глутатион-S-трансферазы из печени крысы на 67% и 54% соответственно [54, C. 729].
В стенках кровеносных сосудов и миокарде накапливаются AGEs и модифицированные ими белки, что приводит к образованию поперечных сшивок между фибриллами коллагена. В результате коллаген теряет свои свойства и, как следствие, уменьшается упругость сосудов и мышечной ткани сердца у лиц преклонного возраста и больных диабетом [55, C. 160]. Накопление AGEs стимулирует экспрессию RAGE и приводит к увеличению циркулирующих в крови растворимой изоформы рецептора, не содержащей трансмембранный домен, и внеклеточного домена. Увеличение содержания растворимой формы изоформы RAGE в крови также активирует воспалительные и деструктивные процессы в сосудах и миокарде, что дополнительным фактором развития сердечно- сосудистых заболеваний и ускорение старения [56, C. 98], [57, C. 610], [58, C. 1538].
Провоспалительное действие AGEs, опосредованное образованием провоспалительных цитокинов и активных форм кислорода, делает их существенными элементами в патогенезе таких заболеваний, как сахарный диабет, катаракта, болезнь Альцгеймера [59, C. 1] и другие нейродегенеративные заболевания [60, C. 67], [61, C. 115]. Индуцированная AGEs генерация активных форм кислорода через активацию экспрессии фактора роста эндотелия (VEGF) увеличивает проницаемость сосудов и пролиферацию эндотелиальных клеток, что может привести к развитию опухоли метастазам [55, C. 160]. Доказана роль взаимодействия AGEs-RAGE в развитии и прогрессии таких видов рака, как рака груди, меланомы, гепатоцеллюлярной карциномы, рака поджелудочной железы, кишечника и легких [62, C. 55], [63, C. 315], [64, C. 1900], [65, C. 7].
В настоящее время растворимые формы RAGE могут рассматриваться как биологические маркеры патологических процессов, связанных с воспалением. Так, определение растворимой формы RAGE может применяться для диагностики таких заболеваний, как болезнь Крона, неспецифический язвенный колит, хронической обструктивной болезни легких, диабете 1-го типа, болезни Альцгеймера [66, C. 698].
Доказано, что AGEs накапливаются в организме человека с возрастом, приводя к прогрессированию заболеваний, зависимых от возраста (подробнее см. обзор [67]).
Исследования механизмов повреждающего действия AGEs на клетки являются фундаментом для разработки фармакалогической стратегии предотвращения и лечения заболеваний, вызываемых накоплением AGEs. Несмотря на то, что ученые сталкиваются со многими трудностями в получении и интерпретации данных из-за сложности и неоднозначности эффектов AGEs, особенно экзогенных, мы постепенно приближаемся к пониманию механизмов влияния конечных продуктов глубокого гликирования на клеточные процессы.
| Финансирование Статья подготовлена по результатам работы, выполненной в СПбГУ за счет финансовой поддержки гранта Российского научного фонда (проект № 17-16-01042). | Funding The article was prepared based on the results of work carried out at St. Petersburg State University with the financial support of the grant of the Russian Science Foundation (project No. 17-16-01042). |
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы/ References
- Uribarri J. Dietary AGEs and their Role in Health and Disease / J. Uribarri – Boca Raton: CRC Press, 2017. – 1-384 p.
- Basta G. Advanced glycation end products and vascular inflammation: Implications for accelerated atherosclerosis in diabetes / G. Basta, A. M. Schmidt, R. De Caterina // Cardiovascular Research. – 2004. – №63. – P. 582-592.
- Vistoli G. Advanced glycoxidation and lipoxidation end products (AGEs and ALEs): An overview of their mechanisms of formation / G. Vistoli, D. De Maddis, A. Cipak et al. // Free Radical Research. – 2013. – №47. – P. 3-27.
- Nass N. Advanced glycation end products, diabetes and ageing / N. Nass, B. Bartling, A.N. Santos et al. // Zeitschrift fur Gerontologie und Geriatrie. – 2007. – №40. – P. 349-356.
- Gugliucci A. Formation of Fructose-Mediated Advanced Glycation End Products and Their Roles in Metabolic and Inflammatory Diseases / A. Gugliucci // Advances in Nutrition: An International Review Journal. – 2017. – №8. – P. 54-62.
- Aragno M. Dietary sugars and endogenous formation of advanced glycation endproducts: Emerging mechanisms of disease / M. Aragno, R. Mastrocola // Nutrients. – 2017. – №9. – P. 1-16.
- Ottum M. S. Advanced glycation end-products: modifiable environmental factors profoundly mediate insulin resistance / M.S. Ottum, A. M. Mistry // Journal of Clinical Biochemistry and Nutrition. – 2015. – №57. – P. 1-12.
- Uribarri J. Advanced Glycation End Products in Food and a Practical Guide to Their Reduction in the Diet / J. Uribarri, S. Woodruff, S. Goodman et al. // Journal of American Dietic Association. – 2010. – №110. – P. 1-27.
- Poulsen M. W. Advanced glycation endproducts in food and their effects on health / M. W. Poulsen, R. V. Hedegaard, J.M. Andersen et al. // Food and Chemical Toxicology. – 2013. – №60. – P. 10-37.
- Uribarri J. Dietary Advanced Glycation End Products and Their Role in Health and Disease 1 , 2 / J. Uribarri, M. Dolores, M. Pía et al. // Advances in Nutrition. – 2015. – №6. – P. 461-473.
- Kellow N. J. Effect of diet-derived advanced glycation end products on inflammation / N. J. Kellow, M. T. Coughlan // Nutrition Reviews. – 2015. – №73. – P. 737-759.
- Ott C. Role of advanced glycation end products in cellular signaling / C. Ott, K. Jacobs, E. Haucke et al. // Redox Biology. – 2014. – №2. – P. 411-429.
- Pinkas A. Advanced Glycation End-Products and Their Receptors: Related Pathologies, Recent Therapeutic Strategies, and a Potential Model for Future Neurodegeneration Studies / A. Pinkas, M. Aschner // Chemical Research in Toxicology. – 2016. – №29. – P. 707-714.
- Zhu W. Advanced glycation end products induce a prothrombotic phenotype in mice via interaction with platelet CD36 / W. Zhu, W. Li, R. L. Silverstein // Blood. – 2012. – №119. – P. 6136-6144.
- Lopez Diez R. Cellular Mechanisms and Consequences of Glycation in Atherosclerosis and Obesity / R. Lopez Diez, A. Shekhtman, R. Ramasamy et al. // Biochimica et Biophysica Acta - Molecular Basis of Disease. – 2016. – №1862. – P. 2244-2252.
- Kierdorf K. RAGE regulation and signaling in inflammation and beyond / K. Kierdorf, G. Fritz // Journal of Leukocyte Biology. – 2013. – №94. – P. 55-68.
- Neeper M. Cloning and expression of a cell surface receptor for advanced glycosylation end products of proteins / M. Neeper, A. M. Schmidt, J. Brett et al. // Journal of Biological Chemistry. – 1992. – №267. – P. 14998-15004.
- Chuah Y. K. Receptor for Advanced Glycation End Products and Its Ligands / Y. K. Chuah, R. Basir, H. Talib et al. // International Journal of Inflammation. – 2013. – №2013. – P. 403460.
- Juranek J. Receptor for advanced glycation end-products in neurodegenerative diseases / J. Juranek, R. Ray, M. Banach et al. // Reviews in the Neurosciences. – 2015. – №26. – P. 691-698.
- Degani G. A capture method based on the VC1 domain reveals new binding properties of the human receptor for advanced glycation end products (RAGE) / G. Degani, A. A. Altomare, M. Colzani et al. // Redox Biology. – 2017. – №11. – P. 275-285.
- Schmidt A. M. Soluble RAGEs - Prospects for treating & tracking metabolic and inflammatory disease / A.M. Schmidt // Vascular Pharmacology. – 2015. – №72. – P. 1-8.
- Zhang L. Receptor for advanced glycation end products is subjected to protein ectodomain shedding by metalloproteinases / L. Zhang, M. Bukulin, E. Kojro et al. // Journal of Biological Chemistry. – 2008. – №283. – P. 35507-35516.
- Wang Y. sRAGE Induces Human Monocyte Survival and Differentiation / Y. Wang, H. Wang, M. G. Piper et al. // The Journal of Immunology. – 2010. – №185. – P. 1822-1835.
- Davis K. E. Advanced Glycation End Products, Inflammation, and Chronic Metabolic Diseases: Links in a Chain? / K.E. Davis, C. Prasad, P. Vijayagopal et al. // Critical Reviews in Food Science and Nutrition. – 2016. – P. 1-32.
- Xue J. The Receptor for Advanced Glycation End Products (RAGE) Speci fi cally Recognizes Methylglyoxal-Derived AGEs / J. Xue, R. Ray, D. Singer et al. // Biochemistry. – 2014. – №53. – P. 3327-3335.
- Downs C. A. RAGE-induced changes in the proteome of alveolar epithelial cells / C. A. Downs, N. M. Johnson, G. Tsaprailis et al. // Journal of Proteomics. – 2018. – №177. – P. 11-20.
- Vicentino A. R. R. Emerging role of HMGB1 in the pathogenesis of schistosomiasis liver fibrosis / A. R. R. Vicentino, V.C. Carneiro, D. Allonso et al. // Frontiers in Immunology. – 2018. – №. 9. – P. 1-15.
- Hudson B. I. Targeting RAGE Signaling in Inflammatory Disease. / B.I. Hudson, M.E. Lippman // Annual review of medicine. – 2018. – №69. – P. 349-364.
- Rojas A. The receptor for advanced glycation end-products: A complex signaling scenario for a promiscuous receptor / A. Rojas, F. Delgado-Lopez, I. Gonzalez et al. // Cellular Signalling. – 2013. – №25. – P. 609-614.
- Yatime L. The Structure of the RAGE:S100A6 Complex Reveals a Unique Mode of Homodimerization for S100 Proteins / L. Yatime, C. Betzer, R.K. Jensen, et al. // Structure. – 2016. – №. 24. – P. 2043-2052.
- Popa I. Expression and subcellular localization of RAGE in melanoma cells / I. Popa, E. Ganea, S. M. Petrescu // Biochemistry and Cell Biology. – 2014. – №92. – P. 127-136.
- Xie J. Cellular signalling of the receptor for advanced glycation end products (RAGE) / J. Xie, J.D. Mendez, V. Mendez-Valenzuela et al. // Cellular Signalling. – 2013. – №25. – P. 2185-2197.
- Wang L. DHA Inhibited AGEs-Induced Retinal Microglia Activation Via Suppression of the PPARγ/NFκB Pathway and Reduction of Signal Transducers in the AGEs/RAGE Axis Recruitment into Lipid Rafts / L. Wang, K. Chen, K. Liu et al. // Neurochemical Research. – 2015. – №40. – P. 713-722.
- Munescue S. Low-molecular weight fractions of Japanese sou sauce as a RAGE antagonist via inhibition of RAGE trafficking to lipid rafts / S. Munescue, Y. Yamamoto, R. Urushihara et al. // Food and Function. – 2013. – №4. – P. 1835-1842.
- Hofmann Bowman M. A. Advanced glycation end products in diabetic cardiomyopathy: An alternative hypothesis / M.A. Hofmann Bowman, S. Fedson, A.M. Schmidt // Journal of Heart and Lung Transplantation. – 2011. – №30. – P. 1303.
- Xue J. Change in the Molecular Dimension of a RAGE-Ligand Complex Triggers RAGE Signaling / J. Xue, M. Manigrasso, M. Scalabrin et al. // Structure. – 2016. – №24. – P. 1509-1522.
- Jangde N. Cysteine mediated disulfide bond formation in RAGE V domain facilitates its functionally relevant dimerization / N. Jangde, R. Ray, S. Sinha et al. // Biochimie. – 2018. – №154. – P. 55-61.
- Wei J. Y. Activation of RAGE/STAT3 pathway by methylglyoxal contributes to spinal central sensitization and persistent pain induced by bortezomib / J. Y. Wei, C.C. Liu, H. D. Ouyang et al. // Experimental Neurology. – 2017. – №296. – P. 74-82.
- Oczypok E. A. All the “RAGE” in lung disease: The receptor for advanced glycation endproducts (RAGE) is a major mediator of pulmonary inflammatory responses / E. A. Oczypok, T. N. Perkins, T. D. Oury // Paediatric Respiratory Reviews. – 2017. – №23. – P. 40-49.
- Ramasamy R. Advanced glycation end products and RAGE: A common thread in aging, diabetes, neurodegeneration, and inflammation / R. Ramasamy, S. J. Vannucci, S. S. Du. et al. // Glycobiology. – 2005. – №15. – P. 16R-28R.
- Yu W. Pterostilbene inhibited advanced glycation end products (AGEs)-induced oxidative stress and inflammation by regulation of RAGE/MAPK/NF-κB in RAW264.7 cells / W. Yu, X. Hu, M. Wang // Journal of Functional Foods. – 2018. – №40. – P. 272-279.
- Cao W. Advanced glycation end products induced immune maturation of dendritic cells controls heart failure through NF-κB signaling pathway / W. Cao, J. Chen, Y. Chen et al. // Archives of Biochemistry and Biophysics. – 2015. – №580. – P. 112-120.
- Sevillano N. Internalization of the receptor for advanced glycation end products (RAGE) is required to mediate intracellular responses / N. Sevillano, M. D. Giron, M. Salido et al. // Journal of Biochemistry. – 2009. – №145. – P. 21-30.
- Ансари Н. А. Неферментативное гликирование белков: от диабета до рака / Н. А.Ансари, З. Рашид // Биомедицинская химия. – 2010. – №2. – С. 168-178.
- Indurthi V. S. K. Interaction between glycated serum albumin and AGE-receptors depends on structural changes and the glycation reagent / V. S. K. Indurthi, E. Leclerc, S. W. Vetter // Archives of Biochemistry and Biophysics. – 2012. – №528. – P. 185-196.
- Kandarakis S. A. Emerging role of advanced glycation-end products (AGEs) in the pathobiology of eye diseases / S. A. Kandarakis, C. Piperi, F. Topouzis// Progress in Retinal and Eye Research. – 2014. – P. 1-18.
- Ramasamy R. The diverse ligand repertoire of the receptor for advanced glycation endproducts and pathways to the complications of diabetes / R. Ramasamy, S. F. Yan, A. M. Schmidt // Vascular Pharmacology. – 2012. – №57. – P. 160-167.
- Frimat M. Kidney, heart and brain: three organs targeted by ageing and glycation / M. Frimat, M. Daroux, R. Litke et al. // Clinical Science. – 2017. – №131. – P. 1069-1092.
- Byun K. Advanced glycation end-products produced systemically and by macrophages: A common contributor to inflammation and degenerative diseases / K. Byun, Y.C. Yoo, M. Son et al. // Pharmacology and Therapeutics. – 2017. – №177. – P. 44-55.
- Reynaert N. L. Advanced glycation end products and their receptor in age-related, non-communicable chronic inflammatory diseases; Overview of clinical evidence and potential contributions to disease / N. L. Reynaert, P. Gopal, E. P. A. Rutten et al. // International Journal of Biochemistry and Cell Biology. – 2016. – №81. – P. 403-418.
- Vlassara H. Advanced Glycation Endproducts in Diabetes and Diabetic Complications / H. Vlassara, G. E. Striker // Endocrinology and Metabolism Clinics of North America. – 2013. – №42. – P. 697-719.
- Pertynska-Marczewska M. Advanced glycation end products: A link between metabolic and endothelial dysfunction in polycystic ovary syndrome? / M. Pertynska-Marczewska, E. Diamanti-Kandarakis, J. Zhang et al. // Metabolism: Clinical and Experimental. – 2015. – №64. – P. 1564-1573.
- de Vos L. C. Advanced glycation end products: An emerging biomarker for adverse outcome in patients with peripheral artery disease / L. C. de Vos, J. D. Lefrandt, R. P. F. Dullaart et al. // Atherosclerosis. – 2016. – №254. – P. 305-313.
- Ланкин В. З. Влияние природных дикарбонилов на активность антиоксидантных ферментов in vitro и in vivo / В. З.Ланкин, Г. Г. Коновалова, А. К. Тихазе и др. // Биомедицинская химия. – 2012. – №6. – С. 727-736.
- Yamagishi S. Pathologic role of dietary advanced glycation end products in cardiometabolic disorders, and therapeutic intervention / S. Yamagishi, T. Matsui // Nutrition. – 2016. – №32. – P. 157-165.
- Hegab Z. Role of advanced glycation end products in hypertension and cardiovascular risk: Human studies / Z. Hegab, S. Gibbons, L. Neyses et al. // Journal of the American Society of Hypertension. – 2012. – №4. – P. 90-102.
- Neviere R. Implication of advanced glycation end products (Ages) and their receptor (Rage) on myocardial contractile and mitochondrial functions / R. Neviere, Y. Yu, L. Wang et al. // Glycoconjugate Journal. – 2016. – №33. – P. 607-617.
- Deluyker D. Advanced glycation end products (AGEs) and cardiovascular dysfunction: focus on high molecular weight AGEs / D. Deluyker, L. Evens, V. Bito // Amino Acids. – 2017. – №49. – P. 1535-1541.
- Abate G. Nutrition and AGE-ing : Focusing on Alzheimer ’ s Disease / G. Abate, M. Marziano // – 2017. – №2017. – P. 7039816.
- Jiang X. RAGE and its emerging role in the pathogenesis of Parkinson’s disease / X. Jiang, X. Wang, M. Tuo et al. // Neuroscience Letters. – 2018. – №672. – P. 65-69.
- Kouidrat Y. Advanced glycation end products and schizophrenia: A systematic review / Y. Kouidrat, A. Amad, M. Arai et al. // Journal of Psychiatric Research. – 2015. – №66-67. – P. 112-117.
- Yamagishi S. Role of receptor for advanced glycation end products ( RAGE ) and its ligands in cancer risk / S. Yamagishi, T. Matsui, K. Fukami // Rejuvenation Research. – 2014. – №18. – P. 48-56.
- Palanissami G. RAGE and Its Ligands: Molecular Interplay Between Glycation, Inflammation, and Hallmarks of Cancer—a Review / G. Palanissami, S. F. D. Paul // Hormones and Cancer. – 2018. – №9. – P. 295-325.
- Malik P. Role of receptor for advanced glycation end products in the complication and progression of various types of cancers / P. Malik, N. Chaudhry, R. Mittal et al. // Biochimica et Biophysica Acta - General Subjects. – 2015. – №1850. – P. 1898-1904.
- Lin J. A. Glycative stress from advanced glycation end products (AGEs) and dicarbonyls: An emerging biological factor in cancer onset and progression / J.A. Lin, C.H. Wu, C.C. Lu et al. // Molecular nutrition & food research. – 2016. – №60. – P. 1-15.
- Успенская Ю. А. Лиганды RAGE-белков: роль в межклеточной коммуникации и патогенезе воспаления / Ю. А.Успенская, Ю. К. Комлева, Е. А. Пожиленкова и др. // Вестник Российской академии медицинских наук. – 2015. – №70. – С. 694-703.
- Емельянов В. В. Гликирование, антигликирование и дегликирование: роль в механизмах старения и геропротекции / В.В.Емельянов // Успехи геронтологии. – 2016. – №3. – С. 407-416.
Список литературы на английском языке / References in English
- Uribarri J. Dietary AGEs and their Role in Health and Disease / J. Uribarri – Boca Raton: CRC Press, 2017. – 1-384 p.
- Basta G. Advanced glycation end products and vascular inflammation: Implications for accelerated atherosclerosis in diabetes / G. Basta, A. M. Schmidt, R. De Caterina // Cardiovascular Research. – 2004. – №63. – P. 582-592.
- Vistoli G. Advanced glycoxidation and lipoxidation end products (AGEs and ALEs): An overview of their mechanisms of formation / G. Vistoli, D. De Maddis, A. Cipak et al. // Free Radical Research. – 2013. – №47. – P. 3-27.
- Nass N. Advanced glycation end products, diabetes and ageing / N. Nass, B. Bartling, A. N. Santos et al. // Zeitschrift fur Gerontologie und Geriatrie. – 2007. – №40. – P. 349-356.
- Gugliucci A. Formation of Fructose-Mediated Advanced Glycation End Products and Their Roles in Metabolic and Inflammatory Diseases / A. Gugliucci // Advances in Nutrition: An International Review Journal. – 2017. – №8. – P. 54-62.
- Aragno M. Dietary sugars and endogenous formation of advanced glycation endproducts: Emerging mechanisms of disease / M. Aragno, R. Mastrocola // Nutrients. – 2017. – №9. – P. 1-16.
- Ottum M. S. Advanced glycation end-products: modifiable environmental factors profoundly mediate insulin resistance / M. S. Ottum, A. M. Mistry // Journal of Clinical Biochemistry and Nutrition. – 2015. – №57. – P. 1-12.
- Uribarri J. Advanced Glycation End Products in Food and a Practical Guide to Their Reduction in the Diet / J. Uribarri, S. Woodruff, S. Goodman et al. // Journal of American Dietic Association. – 2010. – №110. – P. 1-27.
- Poulsen M. W. Advanced glycation endproducts in food and their effects on health / M. W. Poulsen, R. V. Hedegaard, J.M. Andersen et al. // Food and Chemical Toxicology. – 2013. – №60. – P. 10-37.
- Uribarri J. Dietary Advanced Glycation End Products and Their Role in Health and Disease 1 , 2 / J. Uribarri, M. Dolores, M. Pía et al. // Advances in Nutrition. – 2015. – №6. – P. 461-473.
- Kellow N. J. Effect of diet-derived advanced glycation end products on inflammation / N. J. Kellow, M. T. Coughlan // Nutrition Reviews. – 2015. – №73. – P. 737-759.
- Ott C. Role of advanced glycation end products in cellular signaling / C. Ott, K. Jacobs, E. Haucke et al. // Redox Biology. – 2014. – №2. – P. 411-429.
- Pinkas A. Advanced Glycation End-Products and Their Receptors: Related Pathologies, Recent Therapeutic Strategies, and a Potential Model for Future Neurodegeneration Studies / A. Pinkas, M. Aschner // Chemical Research in Toxicology. – 2016. – №29. – P. 707-714.
- Zhu W. Advanced glycation end products induce a prothrombotic phenotype in mice via interaction with platelet CD36 / W. Zhu, W. Li, R. L. Silverstein // Blood. – 2012. – №119. – P. 6136-6144.
- Lopez Diez R. Cellular Mechanisms and Consequences of Glycation in Atherosclerosis and Obesity / R. Lopez Diez, A. Shekhtman, R. Ramasamy et al. // Biochimica et Biophysica Acta - Molecular Basis of Disease. – 2016. – №1862. – P. 2244-2252.
- Kierdorf K. RAGE regulation and signaling in inflammation and beyond / K. Kierdorf, G. Fritz // Journal of Leukocyte Biology. – 2013. – №94. – P. 55-68.
- Neeper M. Cloning and expression of a cell surface receptor for advanced glycosylation end products of proteins / M. Neeper, A. M. Schmidt, J. Brett et al. // Journal of Biological Chemistry. – 1992. – №267. – P. 14998-15004.
- Chuah Y. K. Receptor for Advanced Glycation End Products and Its Ligands / Y. K. Chuah, R. Basir, H. Talib et al. // International Journal of Inflammation. – 2013. – №2013. – P. 403460.
- Juranek J. Receptor for advanced glycation end-products in neurodegenerative diseases / J. Juranek, R. Ray, M. Banach et al. // Reviews in the Neurosciences. – 2015. – №26. – P. 691-698.
- Degani G. A capture method based on the VC1 domain reveals new binding properties of the human receptor for advanced glycation end products (RAGE) / G. Degani, A. A. Altomare, M. Colzani et al. // Redox Biology. – 2017. – №11. – P. 275-285.
- Schmidt A. M. Soluble RAGEs - Prospects for treating & tracking metabolic and inflammatory disease / A.M. Schmidt // Vascular Pharmacology. – 2015. – №72. – P. 1-8.
- Zhang L. Receptor for advanced glycation end products is subjected to protein ectodomain shedding by metalloproteinases / L. Zhang, M. Bukulin, E. Kojro et al. // Journal of Biological Chemistry. – 2008. – №283. – P. 35507-35516.
- Wang Y. sRAGE Induces Human Monocyte Survival and Differentiation / Y. Wang, H. Wang, M. G. Piper et al. // The Journal of Immunology. – 2010. – №185. – P. 1822-1835.
- Davis K. E. Advanced Glycation End Products, Inflammation, and Chronic Metabolic Diseases: Links in a Chain? / K. E. Davis, C. Prasad, P. Vijayagopal et al. // Critical Reviews in Food Science and Nutrition. – 2016. – P. 1-32.
- Xue J. The Receptor for Advanced Glycation End Products (RAGE) Speci fi cally Recognizes Methylglyoxal-Derived AGEs / J. Xue, R. Ray, D. Singer et al. // Biochemistry. – 2014. – №53. – P. 3327-3335.
- Downs C. A. RAGE-induced changes in the proteome of alveolar epithelial cells / C. A. Downs, N. M. Johnson, G. Tsaprailis et al. // Journal of Proteomics. – 2018. – №177. – P. 11-20.
- Vicentino A. R. R. Emerging role of HMGB1 in the pathogenesis of schistosomiasis liver fibrosis / A. R. R. Vicentino, V.C. Carneiro, D. Allonso et al. // Frontiers in Immunology. – 2018. – №9. – P. 1-15.
- Hudson B. I. Targeting RAGE Signaling in Inflammatory Disease. / B. I. Hudson, M. E. Lippman // Annual review of medicine. – 2018. – №69. – P. 349-364.
- Rojas A. The receptor for advanced glycation end-products: A complex signaling scenario for a promiscuous receptor / A. Rojas, F. Delgado-Lopez, I. Gonzalez et al. // Cellular Signalling. – 2013. – №25. – P. 609-614.
- Yatime L. The Structure of the RAGE:S100A6 Complex Reveals a Unique Mode of Homodimerization for S100 Proteins / L. Yatime, C. Betzer, R. K. Jensen, et al. // Structure. – 2016. – №24. – P. 2043-2052.
- Popa I. Expression and subcellular localization of RAGE in melanoma cells / I. Popa, E. Ganea, S. M. Petrescu // Biochemistry and Cell Biology. – 2014. – №92. – P. 127-136.
- Xie J. Cellular signalling of the receptor for advanced glycation end products (RAGE) / J. Xie, J. D. Mendez, V. Mendez-Valenzuela et al. // Cellular Signalling. – 2013. – №25. – P. 2185-2197.
- Wang L. DHA Inhibited AGEs-Induced Retinal Microglia Activation Via Suppression of the PPARγ/NFκB Pathway and Reduction of Signal Transducers in the AGEs/RAGE Axis Recruitment into Lipid Rafts / L. Wang, K. Chen, K. Liu et al. // Neurochemical Research. – 2015. – №40. – P. 713-722.
- Munescue S. Low-molecular weight fractions of Japanese sou sauce as a RAGE antagonist via inhibition of RAGE trafficking to lipid rafts / S. Munescue, Y. Yamamoto, R. Urushihara et al. // Food and Function. – 2013. – №4. – P. 1835-1842.
- Hofmann Bowman M. A. Advanced glycation end products in diabetic cardiomyopathy: An alternative hypothesis / M.A. Hofmann Bowman, S. Fedson, A. M. Schmidt // Journal of Heart and Lung Transplantation. – 2011. – №30. – P. 1303.
- Xue J. Change in the Molecular Dimension of a RAGE-Ligand Complex Triggers RAGE Signaling / J. Xue, M. Manigrasso, M. Scalabrin et al. // Structure. – 2016. – №24. – P. 1509-1522.
- Jangde N. Cysteine mediated disulfide bond formation in RAGE V domain facilitates its functionally relevant dimerization / N. Jangde, R. Ray, S. Sinha et al. // Biochimie. – 2018. – №154. – P. 55-61.
- Wei J. Y. Activation of RAGE/STAT3 pathway by methylglyoxal contributes to spinal central sensitization and persistent pain induced by bortezomib / J. Y. Wei, C.C. Liu, H. D. Ouyang et al. // Experimental Neurology. – 2017. – №296. – P. 74-82.
- Oczypok E. A. All the “RAGE” in lung disease: The receptor for advanced glycation endproducts (RAGE) is a major mediator of pulmonary inflammatory responses / E. A. Oczypok, T. N. Perkins, T. D. Oury // Paediatric Respiratory Reviews. – 2017. – №23. – P. 40-49.
- Ramasamy R. Advanced glycation end products and RAGE: A common thread in aging, diabetes, neurodegeneration, and inflammation / R. Ramasamy, S. J. Vannucci, S. S. Du. et al. // Glycobiology. – 2005. – №15. – P. 16R-28R.
- Yu W. Pterostilbene inhibited advanced glycation end products (AGEs)-induced oxidative stress and inflammation by regulation of RAGE/MAPK/NF-κB in RAW264.7 cells / W. Yu, X. Hu, M. Wang // Journal of Functional Foods. – 2018. – №40. – P. 272-279.
- Cao W. Advanced glycation end products induced immune maturation of dendritic cells controls heart failure through NF-κB signaling pathway / W. Cao, J. Chen, Y. Chen et al. // Archives of Biochemistry and Biophysics. – 2015. – №580. – P. 112-120.
- Sevillano N. Internalization of the receptor for advanced glycation end products (RAGE) is required to mediate intracellular responses / N. Sevillano, M. D. Giron, M. Salido et al. // Journal of Biochemistry. – 2009. – №145. – P. 21-30.
- Ansari N. A. Nefermentativnoe glikirovanie belkov: ot diabeta do raka [Non-enzymatic Glycation of Proteins: From Diabetes to Cancer] / N. A. Ansari, Z. Rasheed // Biomedicinskaya khimiya [Biomedical chemistry]. – 2010. – №2. – P. 168-178. [in Russian]
- Indurthi V. S. K. Interaction between glycated serum albumin and AGE-receptors depends on structural changes and the glycation reagent / V. S. K. Indurthi, E. Leclerc, S.W. Vetter // Archives of Biochemistry and Biophysics. – 2012. – №528. – P. 185-196.
- Kandarakis S. A. Emerging role of advanced glycation-end products (AGEs) in the pathobiology of eye diseases / S. A. Kandarakis, C. Piperi, F. Topouzis // Progress in Retinal and Eye Research. – 2014. – P. 1-18.
- Ramasamy R. The diverse ligand repertoire of the receptor for advanced glycation endproducts and pathways to the complications of diabetes / R. Ramasamy, S. F. Yan, A. M. Schmidt // Vascular Pharmacology. – 2012. – №57. – P. 160-167.
- Frimat M. Kidney, heart and brain: three organs targeted by ageing and glycation / M. Frimat, M. Daroux, R. Litke et al. // Clinical Science. – 2017. – №131. – P. 1069-1092.
- Byun K. Advanced glycation end-products produced systemically and by macrophages: A common contributor to inflammation and degenerative diseases / K. Byun, Y. C. Yoo, M. Son et al. // Pharmacology and Therapeutics. – 2017. – №177. – P. 44-55.
- Reynaert N. L. Advanced glycation end products and their receptor in age-related, non-communicable chronic inflammatory diseases; Overview of clinical evidence and potential contributions to disease / N. L. Reynaert, P. Gopal, E.P.A. Rutten et al. // International Journal of Biochemistry and Cell Biology. – 2016. – №81. – P. 403-418.
- Vlassara H. Advanced Glycation Endproducts in Diabetes and Diabetic Complications / H. Vlassara, G. E. Striker // Endocrinology and Metabolism Clinics of North America. – 2013. – №42. – P. 697-719.
- Pertynska-Marczewska M. Advanced glycation end products: A link between metabolic and endothelial dysfunction in polycystic ovary syndrome? / M. Pertynska-Marczewska, E. Diamanti-Kandarakis, J. Zhang et al. // Metabolism: Clinical and Experimental. – 2015. – №64. – P. 1564-1573.
- de Vos L. C. Advanced glycation end products: An emerging biomarker for adverse outcome in patients with peripheral artery disease / L. C. de Vos, J. D. Lefrandt, R. P. F. Dullaart et al. // Atherosclerosis. – 2016. – №254. – P. 305-313.
- Lankin V. Z. Vliyanie prirodnyh dikarbonilov na aktivnost' antioksidantnyh fermentov in vitro i in vivo [The Influence of Natural Dicarbonils on the Antioxidant Enzymes Activity in vitro and in vivo] / V. Z. Lankin, G. G. Konovalova, A. G. Tikhaze and others // Biomedicinskaya khimiya [Biomedical chemistry]. – 2012. – №6. – P. 727-736. [in Russian]
- Yamagishi S. Pathologic role of dietary advanced glycation end products in cardiometabolic disorders, and therapeutic intervention / S. Yamagishi, T. Matsui // Nutrition. – 2016. – №32. – P. 157-165.
- Hegab Z. Role of advanced glycation end products in hypertension and cardiovascular risk: Human studies / Z. Hegab, S. Gibbons, L. Neyses et al. // Journal of the American Society of Hypertension. – 2012. – №4. – P. 90-102.
- Neviere R. Implication of advanced glycation end products (Ages) and their receptor (Rage) on myocardial contractile and mitochondrial functions / R. Neviere, Y. Yu, L. Wang et al. // Glycoconjugate Journal. – 2016. – №33. – P. 607-617.
- Deluyker D. Advanced glycation end products (AGEs) and cardiovascular dysfunction: focus on high molecular weight AGEs / D. Deluyker, L. Evens, V. Bito // Amino Acids. – 2017. – №49. – P. 1535-1541.
- Abate G. Nutrition and AGE-ing : Focusing on Alzheimer ’ s Disease / G. Abate, M. Marziano // – 2017. – №2017. – P. 7039816.
- Jiang X. RAGE and its emerging role in the pathogenesis of Parkinson’s disease / X. Jiang, X. Wang, M. Tuo et al. // Neuroscience Letters. – 2018. – №672. – P. 65-69.
- Kouidrat Y. Advanced glycation end products and schizophrenia: A systematic review / Y. Kouidrat, A. Amad, M. Arai et al. // Journal of Psychiatric Research. – 2015. – №66-67. – P. 112-117.
- Yamagishi S. Role of receptor for advanced glycation end products ( RAGE ) and its ligands in cancer risk / S. Yamagishi, T. Matsui, K. Fukami // Rejuvenation Research. – 2014. – №18. – P. 48-56.
- Palanissami G. RAGE and Its Ligands: Molecular Interplay Between Glycation, Inflammation, and Hallmarks of Cancer—a Review / G. Palanissami, S. F. D. Paul // Hormones and Cancer. – 2018. – №9. – P. 295-325.
- Malik P. Role of receptor for advanced glycation end products in the complication and progression of various types of cancers / P. Malik, N. Chaudhry, R. Mittal et al. // Biochimica et Biophysica Acta - General Subjects. – 2015. – №1850. – P. 1898-1904.
- Lin J. A. Glycative stress from advanced glycation end products (AGEs) and dicarbonyls: An emerging biological factor in cancer onset and progression / J. A. Lin, C. H. Wu, C. C. Lu et al. // Molecular nutrition & food research. – 2016. – №60. – P. 1-15.
- Uspenskaya Y. A. Ligandy RAGE-belkov: rol' v mezhkletochnoj kommunikacii i patogeneze vospaleniya [Ligands of RAGE-Proteins: Role in Intercellular Communication and Pathogenesis of Inflammation] / Y. A. Uspenskaya, Y. K. Komleva, E.A. Pozhilenkova and others // Vestnik rossijskoj akademii medicinskih nauk [Annals of the Russian academy of medical sciences]. 2015. – №70. – P. 694-703. [in Russian]
- Emelyanov V. V. Glikirovanie, antiglikirovanie i deglikirovanie: rol' v mekhanizmah stareniya i geroprotekcii [Glycation, Antiglycation and Deglycation: Their Role in Aging Mechanisms and Geroprotective Effects] / V. V. Emelyanov // Uspekhi gerontologii [Advances in Gerontology]. – 2016. – №3. – P. 407-416. [in Russian]
