СОЗДАНИЕ ENV ПСЕВДОВИРУСОВ НА ОСНОВЕ ШТАММОВ ВИЧ-1, ЦИРКУЛИРУЮЩИХ В НОВОСИБИРСКОЙ ОБЛАСТИ
Рудометов А.П.1, Щербакова Н.С.2
1Аспирант, Государственный научный центр вирусологии и биотехнологии «Вектор»
Работа выполнена при поддержке гранта Минобрнауки России «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014 - 2020 годы» ФЦП № 303
СОЗДАНИЕ ENV ПСЕВДОВИРУСОВ НА ОСНОВЕ ШТАММОВ ВИЧ-1, ЦИРКУЛИРУЮЩИХ В НОВОСИБИРСКОЙ ОБЛАСТИ
Аннотация
В статье рассмотрено – создание Env псевдовирусов на основе штаммов ВИЧ-1, выделенных из сывороток ВИЧ-инфицированных пациентов Новосибирской области. Получено 3 функционально активных псевдовируса, относящихся к циркулирующей рекомбинантной форме CRF63_02А1.
Ключевые слова: ВИЧ-1, псевдовирусы, вируснейтрализация.
Rudometov A.P.1, Shcherbakova N.S.2
1Ph.D. student, State Research Center of Virology and Biotechnology “Vector”
PRODUCTION OF ENV PSEUDOVIRUSES BASED ON HIV-1 STRAINS CIRCULATING IN THE NOVOSIBIRSK REGION
Abstract
In the article we describe the production of Env pseudoviruses based on HIV-1 strains isolated from HIV-positive patients in Novosibirsk region. We assembled 3 functionally active pseudoviruses expressing HIV-1 envelope from circulating recombinant form CRF63_02А1.
Keywords: HIV-1, pseudoviruses, virus neutralization.
ВИЧ-инфекция в России стала национальной угрозой. На 1 января 2014 года в России выявлено 798122 ВИЧ-инфицированных, в том числе 7256 детей. В Сибирском Федеральном округе выявлено 127 635 ВИЧ-положительных пациентов, данный регион занимает 3-е место в стране по количеству инфицированных ВИЧ-1 [1]. В 2008 г. в Новосибирской области выявлен новый генетический вариант CRF02_AG ВИЧ-1, который продолжает стремительно распространяться в Сибирском регионе.
Разработка безопасной и эффективной вакцины против ВИЧ-1 является одной из важнейших задач в борьбе с эпидемией СПИДа. Клинические испытания RV-144 в Тайланде показали, что создание вакцины против ВИЧ-1 возможно [2]. Одним из основных показателей эффективности вакцины является способность индуцировать антитела, нейтрализующие большое количество первичных изолятов ВИЧ-1 разных субтипов. В связи с этим изучение вируснейтрализующих свойств антител, индуцированных ВИЧ-1 иммуногенами, является важной процедурой при создании вакцины.
На смену трудоемкому и дорогостоящему методу анализа нейтрализации ВИЧ с помощью лимфоцитов периферической крови и не клонированных вирусных изолятов, пришла новая технология псевдотипированных вирусов, с использованием генно-инженерных линий клеток [3]. Сегодня данный метод анализа нейтрализующей активности антител, оценки антиретровирусной активности препаратов и вакцин является одним из основных в странах Европы и США [4].
Псевдовирусы представляют собой рекомбинантные вирусные частицы, которые иммунологически практически идентичны природным изолятам ВИЧ-1, но биологически безопасны. Псевдовирусы получают ко-трансфекцией плазмид, одна из которых несет ген Env, кодирующий белки оболочки ВИЧ-1 определенного штамма, другая – геном ВИЧ1, за исключением гена Env. Только Envминусплазмида способна реплицироваться в клетках 293Т/17, ее участие необходимо для упаковки псевдовириона и доставки tatгена в клетки TZMbl. Таким образом, ко-трансфекция клеток 293Т/17 вышеуказанными плазмидами формирует потомство инфекционных псевдовирусных частиц [3]. Благодаря наличию комплекса поверхностных гликопротеинов gp120-gp41 псевдовирусы способны однократно инфицировать клетки, несущие рецепторы CD4+ и CCR5/X4, но из-за дефектного генома не способны к дальнейшему размножению, соответственно работа с ними безопаснее для исследователя [5].
Клетки-мишени TZM-bl, созданные методами генной инженерии, содержат рецептор CD4 и корецепторы CCR5 и CXCR4, а также репортерный tat-зависимый ген люциферазы, который активируется в результате инфицирования этих клеток псевдовирусной частицей. Экспрессия активированного гена люциферазы в инфицированных клетках детектируется с помощью люминометра, при этом интенсивность люминесценции пропорциональна уровню инфекции, а подавление люминесценции соответствует нейтрализации вируса [6].
Целью нашего исследования было получить псевдовирусы на основе штаммов ВИЧ-1, циркулирующих на территории Новосибирской области.
Результаты и обсуждения
Для проведения работы были получены 10 сывороток ВИЧ-инфицированных больных из Областного центра по профилактике и борьбе со СПИД и инфекционными заболеваниями по Новосибирской области. Из полученных образцов сывороток крови была выделена мРНК ВИЧ-1. Для амплификации гена env, кодирующего оболочечные белки ВИЧ-1, с полученной мРНК была проведена полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) (таб.1 праймеры 1 и 2) с последующим проведением гнездовой ПЦР (таб.1 праймеры 2 и 3).
Таблица 1 - Праймеры, используемые при проведении ПЦР
| № п/п | Нуклеотидная последовательность (5’ → 3’) | Ориентация | Положение относительно HXB2 |
| 1 | TACAGTGCAGGGGAAAGAATAATAGACATAATA | S | 4809-4834 |
| 2 | AGACCCAGTACAGGCRARAAGC | A | 9523-9548 |
| 3 | TTAGGCATCTCCTATGGCAGGAAGAAG | S | 5957-5983 |
| 4 | TCCAGTCCCCCCTTTTCTTTTAAAAAG | A | 9063-9089 |
Были получены 8 амплифицированных фрагментов полноразмерного гена env длинной 3132 п.н. (Рис. 1).
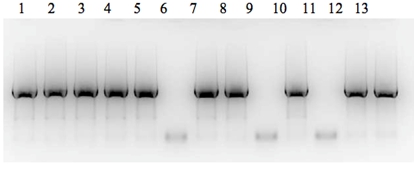
Рис. 1 - Электрофореграмма продуктов ПЦР-реакции в 1% агарозном геле. 1-10 – исследуемые образцы сывороток крови; 11 – отрицательный контроль; 12 – положительный контроль ОТ-ПЦР; 13 – положительный контроль гнездовой ПЦР
Для построения филогенетического дерева и определения субтипа полученных изолятов было проведено определение их нуклеотидных последовательностей в районе гена env (ЦКП «Геномика», Новосибирск). Филогенетические деревья строили методом максимального правдоподобия при помощи программы RAxML версия 7.2.7. Рекомбинацию изучали, используя программу SimPlot версия 3.5. Достоверность филогенетических отношений определяли методом бутстреп-анализа.
В качестве референсных использовали ранее охарактеризованные последовательности субтипов и рекомбинантных форм ВИЧ-1, полученные из коллекции HIV Sequence Database [7].
Филогенетический анализ показал, что все 8 проанализированных последовательностей гена env относятся к рекомбинантной форме CRF63_02A1, распространенной на территории Новосибирской области [8].
Амплифицированные фрагменты полноразмерного гена env были клонированы в составе векторной плазмиды pcDNA™3.1/V5-His TOPO® TA (Invitogen). Полученными рекомбинантными плазмидами pEnv были трансформированы компетентные клетки E.coli Stbl3. Отбор клонов, содержащих вставку, проводили методом ПЦР с праймерами 3 и 4 (табл. 1).
Псевдовирусы получали магнитной ко-трансфекцией (MATra, PromoKine) эукаратиотических клеток 293Т двумя видами плазмид в эквимолярных концентрациях: полученной нами pEnv, кодирующей оболочечные белки ВИЧ-1, и pSG3Δenv (backbone-плазмида), кодирующей остальные белки ВИЧ-1, за исключением Env.
Функциональную активность псевдовирусов определяли в клетках TZM-bl по методике Montefiori [4]. Было показано, что 3 из 8 полученных псевдовирусов обладают функциональной активностью.
Таким образом, были получены 3 функционально активных псевдовируса рекомбинантной формы CRF63_02A1, распространенной в Новосибирской области.
Полученные псевдовирусы будут использованы для анализа нейтрализующей активности антител, индуцированных ВИЧ-1 иммуногенами, и могут применятся при тестировании антиретровирусных препаратов.
Список литературы / References
- Федеральный научно-методический Центр по профилактике и борьбе со СПИДом [Электронный ресурс] URL: http://www.hivrussia.ru/ (дата обращения 20.02.2015).
- Rerks-Ngarm S., Pitisuttithum, P., Nitayaphan, S. et al. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand // New England Journal of Medicine. – 2009 - 361(23) – С. 2209-2220.
- Рыжиков А.Б., Саркисян К.А., Л.И. Карпенко и др. Апробация в доклинических испытаниях метода определения вируснейтрализующей активности вакцины-кандидата против ВИЧ-инфекции КомбиВИЧвак с использованием технологии псевдовирусов ВИЧ-1 // Эпидемиология и Вакцинопрофилактика. – 2014. - 2 (63) – С. 70-76.
- Montefiori D. C. Measuring HIV neutralization in a luciferase reporter gene assay // HIV protocols. – Humana Press, 2009. – С. 395-405.
- Li M., Gao F., Mascola J. R. et al. Human immunodeficiency virus type 1 env clones from acute and early subtype B infections for standardized assessments of vaccine-elicited neutralizing antibodies // Journal of virology. – 2005. - 79(16) – С. 10108-10125.
- Mascola J. R., D'Souza P., Gilbert P. et al. Recommendations for the design and use of standard virus panels to assess neutralizing antibody responses elicited by candidate human immunodeficiency virus type 1 vaccines // Journal of virology. – 2005. - 79(16) – С. 10103-10107.
- HIV Sequence Database [Электронный ресурс] URL: http://www.hiv.lanl.gov/content/sequence/HIV/mainpage.html/ (20.02.2015).
- Shcherbakova N.S., Shalamova L.A., Delgado E. et al. Molecular Epidemiology, Philogeny, and Phylodynamics of CRF63_02A1, a Recently Originated HIV-1 Circulating Recombinant Form Spreading in Siberia // AIDS Research and Human Retroviruses. – 2014. – V. 30. – N. 9. – P. 912-919.
Список литературы на английском языке / References in English
- Federal'nyj nauchno-metodicheskij Centr po profilaktike i bor'be so SPIDom [Jelektronnyj resurs] URL: http://www.hivrussia.ru/ (data obrashhenija 20.02.2015).
- Rerks-Ngarm S., Pitisuttithum, P., Nitayaphan, S. et al. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand // New England Journal of Medicine. – 2009 - 361(23) – S. 2209-2220.
- Ryzhikov A.B., Sarkisjan K.A., L.I. Karpenko i dr. Aprobacija v doklinicheskih ispytanijah metoda opredelenija virusnejtralizujushhej aktivnosti vakciny-kandidata protiv VICh-infekcii KombiVIChvak s ispol'zovaniem tehnologii psevdovirusov VICh-1 // Jepidemiologija i Vakcinoprofilaktika. – 2014. - 2 (63) – S. 70-76.
- Montefiori D. C. Measuring HIV neutralization in a luciferase reporter gene assay // HIV protocols. – Humana Press, 2009. – S. 395-405.
- Li M., Gao F., Mascola J. R. et al. Human immunodeficiency virus type 1 env clones from acute and early subtype B infections for standardized assessments of vaccine-elicited neutralizing antibodies // Journal of virology. – 2005. - 79(16) – S. 10108-10125.
- Mascola J. R., D'Souza P., Gilbert P. et al. Recommendations for the design and use of standard virus panels to assess neutralizing antibody responses elicited by candidate human immunodeficiency virus type 1 vaccines // Journal of virology. – 2005. - 79(16) – S. 10103-10107.
- HIV Sequence Database [Jelektronnyj resurs] URL: http://www.hiv.lanl.gov/content/sequence/HIV/mainpage.html/ (20.02.2015).
- Shcherbakova N.S., Shalamova L.A., Delgado E. et al. Molecular Epidemiology, Philogeny, and Phylodynamics of CRF63_02A1, a Recently Originated HIV-1 Circulating Recombinant Form Spreading in Siberia // AIDS Research and Human Retroviruses. – 2014. – V. 30. – N. 9. – P. 912-919.
