КЛОНИРОВАНИЕ И ЭКСПРЕССИЯ В E.COLI РЕКОМБИНАНТНОГО БЕЛКА VP1 ВИРУСА ИНФЕКЦИОННОЙ АНЕМИИ
КЛОНИРОВАНИЕ И ЭКСПРЕССИЯ В E.COLI РЕКОМБИНАНТНОГО БЕЛКА VP1 ВИРУСА ИНФЕКЦИОННОЙ АНЕМИИ
Научная статья
Алиев А.С.1, *, Грудинин М.П.2, Комиссаров А.Б.3, Забродская Я.А.4, Шалджян А.А.5, Алиева А.К.6
1, 2, 3, 4 ООО «Биовет-К», Москва, Россия;
5 ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России, Санкт-Петербург, Россия;
6 ФГБОУ ВО «Санкт-Петербургский государственный экономический университет», Санкт-Петербург, Россия
* Корреспондирующий автор (aliew.axon[at]mail.ru)
АннотацияОптимизированная последовательность фрагмента гена VP1 вируса инфекционной анемии цыплят клонирована в экспрессионные плазмиды pET15b и pGEX-3T в рамках считывания полигистидиновой последовательности и глутатион-S-трансферазы соответственно. Получены штаммы E. coli Rosetta(DE3), продуцирующие рекомбинантные белки 6HIS-∆VP1 и GST-∆VP1. Оптимизированы условия очистки рекомбинантного белка 6HIS-∆VP1 методом металл-аффинной хроматографии и подобраны условия рефолдинга, обеспечивающие специфическое взаимодействие белка с контрольными поликлональными антителами.
Ключевые слова: (по значимости) Инфекционная анемия цыплят, ИАЦ, экспрессия генов, рекомбинантный белок VP1.
GENERATION AND CHARACTERIZATION OF THE VP1 RECOMBINANT PROTEIN OF THE CHICKEN ANEMIA VIRUS
Research article
Aliev A.S.1, *, Grudinin M.P.2, Komissarov A.B.3, Zabrodskaya Y.A.4, Shaldzhyan A.A.5, Aliyeva A. K.6
1, 2, 3, 4 LLC (limited liability company) “Biovet-K LLC”, Moscow, Russia;
5 Smorodintsev Research Institute of Influenza Ministry of Healthcare of the Russia, St. Petersburg, Russia;
6 FSBEI of HE "St. Petersburg State Economic University", St. Petersburg, Russia
* Corresponding author (aliew.axon[at]mail.ru)
AbstractThe optimized sequence of the VP1 gene fragment of the infectious chicken anemia virus was cloned into the expression vectors pET15b and pGEX-3T in-frame fused with polyhistidine and glutathione-S-transferase tags, respectively. E.coli strains Rosetta (DE3) producing recombinant 6HIS-ΔVP1 and GST-ΔVP1 proteins were obtained. The 6HIS-ΔVP1recombinant protein purification was performed using Immobilized Metal Affinity Chromatography; the refolding conditions, ensuring the specific interaction of the protein with the control polyclonal antibodies, were fulfilled.
Keywords: Chicken anemia virus, CAV, gene expression, VP1 recombinant protein.
ВведениеВозбудитель инфекционной анемии цыплят (ИАЦ) играет важную роль в инфекционной патологии птиц: активно размножаясь в гемоцитобластах костного мозга и предшественниках Т-лимфоцитов, вирус вызывает их гибель и развитие иммунодефицитного состояния [2]. У переболевшей птицы создаются условия для возникновения вторичных инфекций, вызываемых условно-патогенными микроорганизмами [18]. Вирус ИАЦ относится к роду Gyrovirus семейства Circoviridae. В 2016г международным комитетом по таксономии вирусов (ICTV) вирус ИАЦ был реклассифицирован в качестве единственного признанного члена рода Gyrovirus семьейства Anelloviridae(Adams M. J. , et al.,2016). Вирионы цирковирусов — икосаэдрические частицы диаметром 16-25 нм. Капсид включает в себя 32 капсомера. Геном вируса ИАЦ представляет собой кольцевую одноцепочечную ДНК длиной около 2 300 нуклеотидов и кодирует три частично перекрывающихся рамки считывания (ORF1, ORF2 и ORF3). Основной структурный белок вириона VP1 (51 кДа) закодирован в ORF1 (1347 п.о.) [15], [17]. Именно этот фрагмент генома, включающий ORF1, чаще всего является объектом секвенирования и молекулярно-генетического анализа. Анализ ДНК различных штаммов, выделенных в разных регионах мира, показал, что идентичность нуклеотидных последовательностей составляет более 94 %. Это подтверждает наблюдение McNulty и соавторов [10], [11] о том, что все известные изоляты относятся к одному серотипу. Капсидный белок VP1 является одним из белковых компонентов вириона, пригодных для разработки вакцинных и диагностических препаратов [16]. В ряде работ показана возможность экспрессии генов вируса ИАЦ в клетках E.сoli, а белки, полученные подобным образом, обладают выраженной антигенной и иммуногенной активностью [7], [14]. Применение полученного в прокаритической системе экспрессии генов рекомбинантного нуклеокапсидного белка VP1 повысит специфичность и чувствительность метода иммуноферментного анализа (ИФА), используемого для выявления специфических антител.
Цель работы – получение прокариотической системы экспрессии гена VP1 вируса ИАЦ, оптимизация условий экспрессии и очистки целевого рекомбинантного белка.
Материалы и методы
Бактериальные штаммы и плазмиды
Для экспрессии генов, кодирующих рекомбинантные белки, использовали штамм-реципиент Escherichia coli Rosetta (DE3) (Novagen, Германия). Плазмиды pET15b/6HIS-∆VP1 и pGEX-3T/GST-∆VP1 содержали укороченный ген, кодирующий фрагмент белка VP1 вируса инфекционной анемии цыплят (со 130 по 450 а.о.) в составе белков слияния 6HIS-∆VP1 и GST-∆VP1 соответственно. Из литературы известно, что экспрессия гена, кодирующего белок VP1 в E. coli, может быть существенно увеличена путём удаления аргинин-богатого N-концевого домена [7]. Последовательность гена VP1 штамма «ИК-4» вируса инфекционной анемии цыплят была оптимизирована без изменения его аминокислотной последовательности для экспрессии в E. coli, после чего была синтезирована в ООО «Евроген», Москва. Биологические свойства штамма «ИК-4» вируса ИАЦ, изложены в работе [1].
Трансформация клеток штамма-реципиента Escherichia coli Rosetta(DE3)
Компетентные клетки E.coli Rosetta (DE3), подготовленные согласно протоколу, изложенному в [9], помещали в ледяную баню, после чего к 100 мкл клеток добавляли раствор плазмидной ДНК (5 нг) и инкубировали на льду в течение часа. Затем клетки опускали в водяную баню при 420С на 30 секунд и повторно инкубировали на льду в течение 2 минут. Далее к клеткам добавляли 400 мкл среды SOB (2% триптон, 0.5% дрожжевой экстракт, 5M NaCl, 1M KCl), инкубировали при температуре 370С на орбитальном шейкере при 220 об/мин и высевали на агаризованную среду с антибиотиком (ампициллин 100 мкг/мл и хлорамфеникол 25 мкг/мл).
Индукция экспрессии генов, кодирующих рекомбинантные белки
Для индукции экспрессии генов клетки штаммов-продуцентов E. coli Rosetta(DE3)/pGEX-3T/GST-∆VP1 и E. coli Rosetta(DE3)/ pET15b/6HIS-∆VP1 культивировали в 5 мл среды YT*2 (1.6% триптон, 1% дрожжевой экстракт, 0.5% NaCl), содержащей ампициллин (100 мкг/мл) и хлорамфеникол (25 мкг/мл), на орбитальном шейкере при 220 об/мин в течение 4 часов при +370С до достижения оптической плотности OD=0.6. Экспрессию гена целевого белка индуцировали добавлением ИПТГ (Promega, США) до конечной концентрации 0.2 мМ. Клетки культивировали в течение 5 часов. Наличие и уровень синтеза рекомбинантных белков 6HIS-∆VP1 и GST-∆VP1 оценивали методом электрофоретического разделения белков в 12% полиакриламидном геле [6].
Накопление биомассы клеток, содержащих рекомбинантный белок
Клетки штаммов-продуцентов культивировали в 500 мл среды YT*2, содержащей ампициллин (100 мкг/мл) и хлорамфеникол (25 мкг/мл), в течение 4 часов при +370С на орбитальном шейкере при 220 об/мин до достижения оптической плотности OD=0,6. Экспрессию гена целевого белка индуцировали добавлением ИПТГ до конечной концентрации 0.2 мМ. Клетки культивировали в течение 5 часов при +37°С на орбитальном шейкере при 220 об/мин. Далее клетки осаждали центрифугированием в течение 1 часа при 9000 g и +40С, ресуспендировали в фосфатно-солевом буфере (ФC-буфер: 10 мМ Na2HPO4, 1.8 мМ KH2PO4, 137 мМ NaCl, 2.7 мМ KCl), после чего повторно осаждали центрифугированием в тех же условиях. Полученную биомассу клеток хранили при -200С. Наличие целевых белков подтверждали методом электрофоретического разделения белков в 12% полиакриламидном геле.
Идентификация рекомбинантных белков методом MALDI масс-спектрометрии
Лизаты клеток штаммов-продуцентов подвергали электрофоретическому разделению в 12% полиакриламидном геле по методике Лэммли [6] на аппарате MiniProtean III с использованием коммерческих гелей MiniProtean TGX StainFree (Bio-Rad). Гели окрашивали коллоидным раствором Кумасси G-250 [3], изображения получали на аппарате ChemiDoc XRS+ и анализировали при помощи программного обеспечения ImageLab (Bio-Rad). Окрашенные зоны, предположительно соответствующие целевым белкам GST-∆VP1 и 6HIS-∆VP1, вырезали и проводили ферментативный гидролиз белков в геле трипсином. Для этого вырезанные зоны отмывали два раза по 15 минут в 100 мкл 40% ацетонитрила, 30 мM NH4HCO3 и обезвоживали 100 мкл 100% ацетонитрила, после чего к сухому фрагменту геля добавляли 2 мкл трипсина (Sigma, США), 20 мкг/мл в 50 мM NH4HCO3. Ферментативный гидролиз проводили в течение 5 часов при температуре +370C. Реакцию останавливали 3 мкл 10% ацетонитрила, 0.5% трифторуксусной кислоты.
Для масс-спектрометрического исследования образец смешивали с матрицей DHB (2,5-дигидроксибензойная кислота, Bruker, Германия) и наносили на мишень GroundSteel (Bruker, Германия). Спектр триптических пептидов получали на MALDI-TOF/TOF масс-спектрометре «ultrafleXtreme» (Bruker, Германия) в режиме регистрации положительных ионов. Идентификацию белка осуществляли с использованием Mascot (matrixscience.com). Поиск проводился одновременно среди всех известных белков в базе данных NCBI (национальный центр биотехнологической информации, США) и в локальной базе данных, куда вносили оригинальные последовательности рекомбинантных белков. В качестве вариабельных модификаций а.о. указывали окисление метионинов, ошибку ограничивали 20 ppm.
Очистка рекомбинантных белков
Выделение телец включения
Биомассу размораживали, ресуспендировали в лизирующем буфере (50 мМ трис-HCl, 500 мМ NaCl, 1% Тритон Х-100, 1 мМ фенилметилсульфанил фторид (ФМСФ), 5 мМ β-меркаптоэтанол, pH 8.0) из расчета 2 мл буфера на 1 г биомассы. Далее клетки разрушали, подвергая суспензию обработке ультразвуком при помощи дезинтегратора MSE (Великобритания) (5 циклов по 30 секунд озвучивания и 2 минуты охлаждения в ледяной бане). Полученные лизаты центрифугировали в течение 1 часа при 15000 g, +40С, супернатант отбрасывали. Осадок ресуспендировали в лизирующем буфере (см. выше) из расчета 1 мл буфера на 1 г осадка, центрифугировали в течение 1 часа при 30000 g, +100С. Супернатант отбрасывали, полученные осадки, содержащие тельца включения целевых белков GST-∆VP1 и 6HIS-∆VP1, хранили при -200С.
Хроматографическая очистка и рефолдинг целевых белков
Рекомбинантный белок GST-∆VP1
Тельца включения растворяли в денатурирующем буфере (ФС-буфер, 8 М мочевина, 2 мМ ЭДТА, 1 мМ ФМСФ) из расчета 5 мл буфера на 1 г телец включения. Раствор инкубировали на шейкере при комнатной температуре в течение 1 часа, далее центрифугировали при 30000 g, +100С в течение 1 часа. Супернатант отбирали, фильтровали через шприцевой фильтр-насадку (Millipore, размер пор 0.45 мкм, материал мембраны – полиэфирсульфон). Концентрацию белка в растворе определяли методом Лоури [8].
Рефолдинг белка проводили методом разбавления. Раствор телец включения приливали к предварительно охлаждённому буферу для рефолдинга (ФС-буфер, 2 мМ ЭДТА, 1 мМ ФМСФ) до конечной концентрации белка 0.1 мг/мл и инкубировали на магнитной мешалке в течение 24 часов при температуре +40C. Далее раствор центрифугировали в течение 1 часа при 15000 g, +40C, супернатант отбирали, определяли концентрацию белка методом Лоури.
Хроматографическую очистку проводили методом аффинной хроматографии на иммобилизованном глутатионе. Хроматографическую колонку GSTrap HP (GE Healthcare, США) объемом 5 мл уравновешивали 25 мл стартового буфера (ФС-буфер, 2 мМ ЭДТА) на скорости потока 5 мл/мин. Далее вносили раствор белка после рефолдинга на скорости потока 2 мл/мин, после чего промывали колонку 50 мл стартового буфера на скорости потока 2 мл/мин. Целевой белок элюировали буфером для элюции (100 мМ трис-HCl, 20 мМ восстановленный глутатион, pH 7.8) на скорости потока 2 мл/мин. Мониторинг элюции вели по оптической плотности на длине волны 280 нм, отбирая фракции объемом 1 мл при помощи автоматического коллектора.
Рекомбинантный белок 6HIS-∆VP1
Тельца включения растворяли в денатурирующем буфере (20 мМ Na3PO4, 500 мМ NaCl, 8 М мочевина, 20 мМ имидазол, 1 мМ ФМСФ, 5 мМ β-меркаптоэтанол, pH 7.4) из расчета 5 мл буфера на 1 г телец включения. Раствор инкубировали на шейкере при комнатной температуре в течение 1 часа, далее центрифугировали в течение 1 часа при 30000 g, +100С. Супернатант отбирали, фильтровали через шприцевой фильтр-насадку (размер пор 0.45 мкм, материал мембраны – полиэфирсульфон). Полученный солюбилизат телец включения хранили при +4оС не более 24 часов с добавлением ФМСФ до конечной концентрации 1 мМ.
Хроматографическую очистку проводили методом металл-аффинной хроматографии. Хроматографическую колонку HisTrap FF Crude (GE Healthcare, США) объемом 5 мл перед нанесением образца промывали 25 мл буфера для нанесения (20 мМ Na3PO4, 500 мМ NaCl, 8 М мочевина, 20 мМ имидазол, pH 7.4) на скорости потока 5 мл/мин. Далее вносили солюбилизат телец включения на скорости потока 5 мл/мин, после чего колонку промывали 75 мл буфера для нанесения на скорости потока 5 мл/мин. Целевой белок элюировали буфером для элюции (20 мМ Na3PO4, 500 мМ NaCl, 8 М мочевина, 500 мМ имидазол, pH 7.4) на скорости потока 2 мл/мин. Мониторинг элюции вели по оптической плотности на длине волны 280 нм, отбирая фракции объемом 1 мл при помощи автоматического коллектора. Фракции, имеющие значение оптической плотности более 300 mAU, объединяли.
Рефолдинг очищенного белка 6HIS-∆VP1 осуществляли методом разбавления. К предварительно охлажденному до +40С буферу для рефолдинга (см. рис. 6) приливали раствор очищенного белка до конечной концентрации белка 0.1 мг/мл и инкубировали на шейкере в течение 24 часов при +40С. Далее полученный раствор белка центрифугировали в течение 1 часа при 15000g, +4оС, супернатант отбирали, концентрацию белка определяли методом Лоури.
Оценка эффективности рефолдинга
Эффективность рефолдинга белков определяли методом электрофоретического разделения белков в полиакриламидном геле с последующей денситометрией. Супернатант после рефолдинга и контрольный образец (раствор телец включения белка, разбавленный денатурирующим буфером до конечной концентрации белка 0.1 мг/мл) анализировали по методике Лэммли на аппарате MiniProtean III с использованием коммерческих гелей MiniProtean TGX StainFree (Bio-Rad). Гели окрашивали коллоидным раствором Кумасси G-250 [3], изображения получали на аппарате ChemiDoc XRS+ и анализировали при помощи программного обеспечения ImageLab (Bio-Rad). Процент целевого белка в растворимой форме вычисляли, проводя сравнительную денситометрию дорожек исследуемого образца и образца сравнения.
Метод непрямого иммуноферментного анализа (ИФА)
Постановку непрямого ИФА проводили по следующей схеме. Рекомбинантный антиген в концентрации 5 мкг/мл сорбировали на планшетах для иммуноферментного анализа (Медполимер, Россия) в 0.05 М карбонатно-бикарбонатном буфере, рН 9.5, в течение 18 часов при 40С, промывали ФС-буфером, содержащем 0.05% Твин-20, (ФСБТ) и высушивали при 370С. В качестве блокирующего раствора использовали 5% обезжиренное молоко в ФС-буфере. Далее в лунки последовательно вносили по 100 мкл исследуемых сывороток (использовали серию двукратных разведений 1:100, 1:200 и т.д.) в ФСБТ, а затем меченые пероксидазой антитела к IgY кур в рабочем разведении. В качестве контроля также вносили по 100 мкл положительной и отрицательной сыворотки. На каждом этапе планшеты инкубировали 1 час с последующей трехкратной отмывкой ФСБТ. Далее в лунки вносили по 100 мкл субстратного раствора с тетраметилбензидином («ТМБ», «Sigma») и инкубировали в течение 15 минут при комнатной температуре. Реакцию останавливали добавлением 0.05 мл 2 M H2SO4. Интенсивность окраски в лунках определяли на планшетном фотометре Multiskan EX (Thermo Scientific, США) при длине волны 450 нм (А450). Положительными считали сыворотки со значением А450 в два и более раза превышающие значения А450 отрицательной сыворотки.
Результаты и обсуждение
Конструирование экспрессионных плазмид
Для разработки эффективной технологии получения и очистки фрагмента белка VP1 вируса инфекционной анемии цыплят использовали две генетические конструкции, которые кодируют два рекомбинантных белка. В рекомбинантном белке GST-∆VP1 целевой белок ∆VP1 маркирован глутатион-S-трансферазой, а рекомбинантном белке 6HIS-∆VP1 целевой белок ∆VP1 маркирован 6HIS-тегом, расчетная молекулярная масса белков составляет 63.6 и 41.0 кДа соответственно.На первом этапе исследования последовательность гена VP1 клонировали в экспрессионные векторы pGEX-3T и pET15b по сайтам рестрикции BamHI/EcoRI и NdeI/XhoI соответственно. В результате получили конструкции pGEX-3T/GST-∆VP1 и pET15b/6HIS-∆VP1, кодирующие рекомбинантные белки GST-∆VP1 и 6HIS-∆VP1 (см. рис. 1).
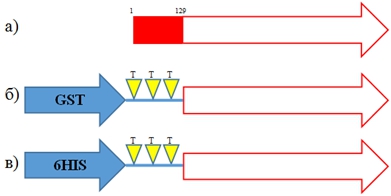
Рис. 1 – Схема строения рекомбинантных белков. a) VP1 дикого типа, красным отмечен участок с 1 по 129 а.о., обогащенный аргинином; б) рекомбинантный белок GST-∆VP1, содержащий протеолитический тромбиновый сайт (ТТТ); в) рекомбинантный белок 6HIS-∆VP1, содержащий протеолитический тромбиновый сайт (ТТТ)
Затем отбирали клоны клеток, в которых выявили экспрессию созданных генетических конструкций (рис.2, дорожки 2-4 и рис. 3, дорожки 2-7).
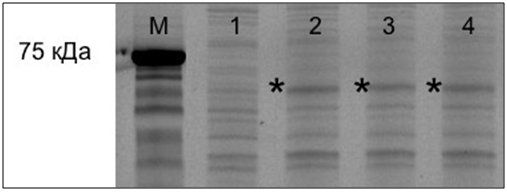
Рис. 2 – Электрофореграмма лизата клеток E.coli Rosetta (DE3) трансформированных плазмидой pGEX-3T/GST-∆VP1:
дорожка М – маркер молекулярных масс;
дорожка 1 – лизат клеток до индукции;
дорожки 2, 3, 4 – лизат клеток после индукции и 5 часов культивирования;
* – зона, по электрофоретической подвижности соответствующая рекомбинантному белку GST-∆VP1 с молекулярной массой 63.6 кДа

Рис. 3 – Электрофореграмма лизата клеток E.coli Rosetta (DE3) трансформированных плазмидой pET15b/6HIS-∆VP1: дорожка М – маркер молекулярных масс; дорожка 1 – лизат клеток до индукции; дорожки 2, 3, 4, 5 и 6 – лизат клеток после индукции и 5 ч культивирования; * – зона, по электрофоретической подвижности соответствующая рекомбинантному белку 6HIS-∆VP1 с молекулярной массой 41.0 кДа
В ходе исследований установили, что рекомбинантные белки накапливаются в клетках в форме телец включения (данные не представлены).
Таким образом, рекомбинантные белки в клетках штаммов-продуцентов E. coli Rosetta(DE3)(pGEX-3T/GST-∆VP1) и E. coli Rosetta(DE3)(pET15b/6HIS-∆VP1) накапливаются в состоянии, не обладающим нативной пространственной структурой, в функционально не активной форме. В связи с этим на следующем этапе исследования осуществили подбор условий рефолдинга для перевода белков в нативное состояние, то есть в активную форму, а также оптимизировали метод их очистки.
Рекомбинантный белок GST-VP1
Методом MALDI масс-спектрометрии в образце, содержащем рекомбинантный белок GST-VP1, достоверно идентифицировали белок слияния GST-VP1 [chicken anemia virus]. Величина Score составила 551 при пороговом значении 89 (в случае, если Score превышает пороговое значение, идентификация считается достоверной, p < 0.05).
Эксперименты по оптимизации условий рефолдинга белка слияния GST-VP1 показали, что изменение состава буфера для рефолдинга не оказывает существенного влияния как на выход растворимой формы белка, так и на эффективность его связывания с иммобилизованным глутатионом (данные не представлены). Аффинная хроматография GST-меченого белка на иммобилизованном глутатионе (колонке GSTrap HP) оказалась невозможной для растворимой формы белка GST-∆VP1 после рефолдинга. Причиной этого может являться как некорректный фолдинг глутатион-связывающего сайта, так и его экранирование элементами пространственной структуры рекомбинантного белка. В обоих случаях хроматографическая очистка на иммобилизованном глутатионе оказывается неэффективной.
Таким образом, синтезировали целевой продукт, меченый GST, но не способный взаимодействовать с иммобилизованным глутатионом. Однако, не удалось подобрать условия, обеспечивающие связывание рекомбинантного белка GST-VP1 с иммобилизованным глутатионом.
Рекомбинантный белок 6HIS-∆VP1
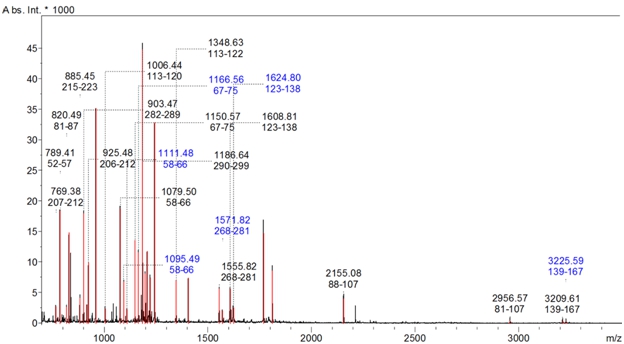
Методом MALDI масс-спектрометрии в образце, содержащем рекомбинантный белок 6HIS-∆VP1, достоверно идентифицировали белок слияния 6HIS-∆VP1 [chicken anemia virus]. Величина Score составила 233 при пороговом значении 70 (в случае, если Score превышает пороговое значение, идентификация считается достоверной, p < 0.05) (рис.4 и табл.1). На рисунке 4 представлен фрагмент масс-спектра рекомбинантного белка, на котором отмечены зарегистрированные ионы и номера аминокислотных остатков в последовательности, которым они соответствуют. Таким образом, синтезировали целевой продукт, меченый полигистидиновой последовательностью.
Рис. 4 – Фрагмент MALDI масс-спектра рекомбинантного белка 6HIS-∆VP1
Примечание: Отмечены ионы, найденные в последовательности белка. Указаны их m/z и номера соответствующих им аминокислотных остатков
В таблице 1 представлена аминокислотная последовательность рекомбинантного белка 6HIS-∆VP1, подчёркнуты фрагменты, обнаруженные в ходе масс-спектрометрического анализа. Покрытие последовательности составило 47%.
Таблица 1 – Фрагменты аминокислотной последовательности рекомбинантного белка 6HIS-∆VP1, обнаруженные в ходе масс-спектрометрического анализа
| 1 | AGELIADGSQ | SQAAQNWPNC | WLPLDNNVPS | ATPSAWWRWA | LMMMQPTDSC |
| 51 | RFFNHPKQMT | LQDMGRMFGG | WHLFRHIETR | FQLLATKNEG | SFSPVASLLS |
| 101 | QGEYLTRRDD | VKYSSDHQNR | WRKGEQPMTG | GIAYATGKMR | PDEQQYPAMP |
| 151 | PDPPIITATT | AQGTQVRCMN | STQAWWSWDT | YMSFATLTAL | GAQWSFPPGQ |
| 201 | RSVSRRSFNH | HKARGAGDPK | GQRWHTLVPL | GTETITDSYM | SAPASELDTN |
| 251 | FFTLYVAQGT | NKSQQYKFGT | ATYALKEPVM | KSDAWAVVRV | QSVWQLGNRQ |
| 301 | RPYPWDVNWA | NSTMYWGSQP | HHHHHH |
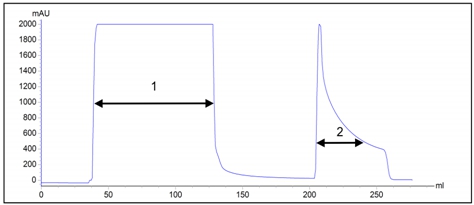
В отличие от аффинной хроматографии на иммобилизованном глутатионе, металл-аффинная хроматография, использующаяся для очистки гистидин-меченых белков, позволяет проводить процесс как в нативных, так и в денатурирующих условиях, что в большинстве случаев обеспечивает решение проблем, связанных с экранированием аффинной метки. Металл-аффинную хроматографию в денатурирующих условиях использовали для очистки рекомбинантного белка 6HIS-∆VP1 (рис. 5). Пул фракций, содержащий целевой белок, диализовали против 50 мМ натрий-фосфатного буфера, pH 7.4, содержащего 1 мМ ЭДТА и 8 М мочевину, и хранили при -200С.
Рис. 5 – Хроматограмма очистки рекомбинантного белка 6HIS-∆VP1 на колонке HisTrap FF Crude.
1 – фракция не связавшегося материала; 2 – фракция элюата.
Примечание: синим цветом показана оптическая плотность на длине волны 280 нм
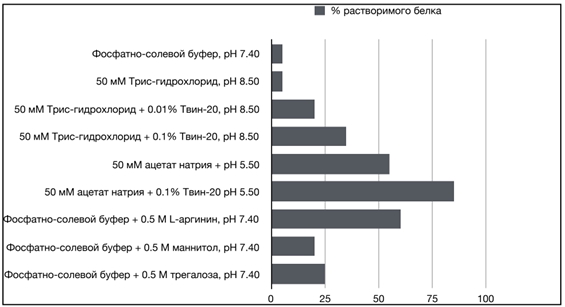
Для изучения биологических свойств очищенного рекомбинантного белка 6HIS-∆VP1 оптимизировали условия рефолдинга данного белка с оценкой количества растворимой формы белка. Для этого использовали буферные растворы, содержащие различные концентрации стабилизирующих агентов и неионных поверхностно активных веществ, имеющие различные значения ионной силы и pH среды. Для рефолдинга использовали 100 мкл белка в концентрации 2 мг/мл в 1.9 мл каждого из испытуемых растворов, после чего измеряли фактическую концентрацию белка методом Лоури с последующим электрофоретическим разделением белков в полиакриламидном геле по методу Лэммли и денситометрией для оценки содержания белка в растворимой форме. На рисунке 6 представлены результаты эксперимента по рефолдингу целевого белка в девяти различных буферных растворах.
Рис. 6 – Рефолдинг рекомбинантного белка 6HIS-∆VP1 в различных буферных системах
Наибольший выход белка 6HIS-∆VP1 в растворимой форме получили с использованием трёх буферных систем: 50 мМ натрий-ацетатный буфер, pH 5.5, содержащий 0.1% Твин-20 (85% белка в растворимой форме); фосфатно-солевой буфер, pH 7.4, содержащий 0.5 М L-аргинин (60% белка в растворимой форме) и 50 мМ натрий-ацетатный буфер, pH 5.5 (55% белка в растворимой форме). Однако методом ИФА показали, что только в фосфатно-солевом буфере, pH 7.4, содержащем 0.5 М L-аргинин, рефолдинг рекомбинантного белка 6HIS-∆VP1 обеспечил его специфическое взаимодействие с поликлональными антителами сывороток кур (рис. 7).
Для подтверждения специфического взаимодействия растворимой формы очищенного рекомбинантного белка 6HIS-∆VP1 использовали положительный и отрицательный контрольные сыворотки крови из набора BioCheck CAV Antibody test kit (BioCheck, США). Рекомбинантный белок 6HIS-∆VP1 сорбировали на 96-луночный планшет Nunc MaxiSorp (ThermoFisher, США) в концентрации 10, 5, 2.5, 1.25, 0.625, 0.313 и 0.156 мкг/мл. Далее проводили ИФА с использованием реагентов из набора BioCheck согласно инструкции производителя. Результаты документировали при помощи планшетного фотометра Multiskan EX (Thermo Scientific, США). На рисунке 7 показана корреляция (зависимость) среднего значения оптической плотности контрольных образцов от концентрации рекомбинантного белка 6HIS-∆VP1.
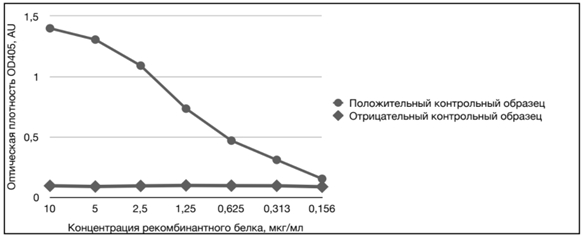
Рис. 7 – Антигенная активность растворимой формы очищенного белка 6HIS-∆VP1: положительный контрольный образец – сыворотка крови птиц, содержащая антитела к возбудителю инфекционной анемии; отрицательный контрольный образец – сыворотка крови СПФ кур
На следующем этапе работы для определения возможности выявления антител к вирусу ИАЦ в сыворотках крови зараженных птиц использовали метод ИФА. В качестве антигена в лунки микропланшета сорбировали рекомбинантный белок 6HIS-∆VP1. Для выявления антител использовали полевые сыворотки крови и сыворотки крови СПФ-цыплят, заражённых патогенным штаммом «ИК-4» вируса ИАЦ, а также сыворотки крови контрольной группы цыплят. Суточным СПФ-цыплятам (n=10) внутримышечно вводили 0.1 мл патогенного штамма «ИК-4» в дозе 6.4 ДНК коп/мл. Контрольной группе (n=5) вводили 0.1 мл физиологического раствора. Сыворотки крови для изучения методом ИФА получали до заражения, затем на 21, 28, 35, 42 и 48 сутки после заражения. Результаты эксперимента приведены в таблице 2 и на рисунке 8 соответственно.
Таблица 2 – Результаты исследования методом ИФА сывороток крови цыплят на наличие антител к вирусу ИАЦ
| Возраст (сут) | Количество проб | Титр антител | ||||
| 0 | 200 | 400-800 | 800-1600 | 3200-6400 | ||
| 1 21 35 | 61 65 94 | 16 18 0 | 10 15 16 | 12 20 18 | 18 12 34 | 5 0 26 |
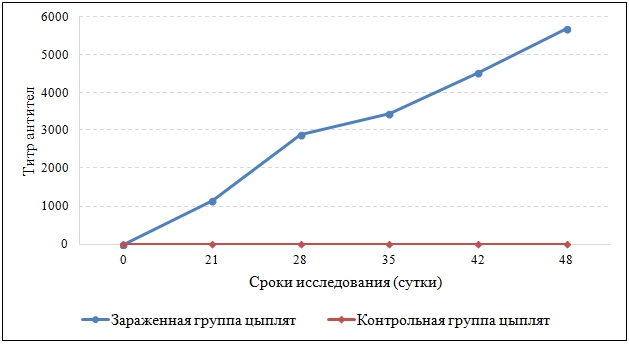
Рис. 8 – Динамика накопления антител в сыворотке крови СПФ-цыплят, зараженных штаммом «ИК-4» вируса ИАЦ
Данные, приведенные в таблице 2 и на рисунке 8, свидетельствуют о том, что рекомбинантный белок VP1 пригоден для выявления антител к вирусу ИАЦ в сыворотке кровы птиц, больных ИАЦ.
Предварительно методом «шахматного» титрования определяли концентрацию рекомбинантного белка и рабочее разведение иммунопероксидазного конъюгата к IgG кур (ООО «ИМТЕК», г.Москва) путем постановки непрямого ИФА, используя двукратные последовательные разведения препаратов. За рабочее разведение каждого из компонентов принимали предельное разведение каждого, обеспечивающее ОП=1.0 ед.
Для определения пороговой чувствительности ИФА устанавливали зависимость величины ОП450 продукта реакции от разведения положительной и отрицательной сывороток. Двукратные разведения положительной и отрицательной сыворотки начинали с разведения 1:100. Опыт проводили при оптимальной концентрации сорбированного рекомбинантного антигена. Достоверно регистрируемое различие в показаниях ОП450 (более чем в 2 раза) наблюдали при разведении положительной и отрицательной сывороток, начиная с 1:200 и более. При разведении ниже 1:200 регистрировали неспецифическое взаимодействие, что не позволяло адекватно оценить результаты реакции.
Таким образом, были определены оптимальная концентрация рекомбинантного антигена для сорбции и разведение положительной сыворотки, которые могут быть использованы при постановке ИФА для выявления специфических антител к вирусу ИАЦ.
Специфичность метода определяли с использованием иммунных сывороток птиц к вирусам инфекционного бронхита, ньюкаслской болезни, инфекционного ларинготрахеита, аденовирусной инфекции, Mycoplasma gallisepticum, а также отрицательную сыворотку кур. Отсутствие положительной реакции с нормальной сывороткой и сыворотками к гетерологичным возбудителям птиц свидетельствует о специфичности рекомбинантного антигена.
Заключение
При выполнении данной работы оптимизировали метод очистки рекомбинантного белка 6HIS-∆VP1 и подобрали условия рефолдинга, обеспечивающие антигенную активность его растворимой формы. Полученный рекомбинантный белок 6HIS-VP1 пригоден для выявления антител к вирусу инфекционной анемии цыплят и может рассматриваться как потенциальный компонент вакцины против данного вируса, что является предметом наших дальнейших исследований.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Алиев А.С. Патогенность изолятов вируса инфекционной анемии цыплят / Алиев А.С., Бурлаков М.В., Громов И.Н. // Ветеринария. – 2015. – No. 5. – c. 20-24.
- Adams M. J. Ratification vote on taxonomic proposals to the International Committee on Taxonomy of Viruses / Adams M. J, E. J. Lefkowitz, A. M. Q. King and others (2016). Arch. Virol. 161:2921–2949.
- Adair B. Immunopathogenesis of chicken anemia virus infection / Adair B. // Dev.Comp. Immunol. – 2000. – No. 24. – pp. 247–255.
- Candiano G. Blue silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis / Candiano G., Bruschi M., Musante L. and others // Electrophoresis. – 2004. – Vol.25 – No. 9. – pp.1327-1333.
- Ducatez M.F. Molecular epidemiology of chicken anemia virus in Nigeria / Ducatez M.F., Owoade A.A., Abiola J.O. and others // Arch. Virol. – 2006. – No. 151. – pp. 97 – 111.
- Kumar S. MEGA7: Molecular Evolutionary Genetics Analysis version 7.0 for bigger datasets / Kumar S., Stecher G., Tamura K. // Molecular Biology and Evolution // 2016. – No. 33. – pp. 1870-1874.
- Laemmli U. K. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4 / Laemmli U. K. // Nature – Vol. 227. – pp. 680–685. doi :10.1038/227680a0.
- Lee M.S. Production of chicken anemia virus (CAV) VP1 and VP2 protein expressed by recombinant Escherichia coli / Lee M.S., Lien Y.Y., Feng S.H. and others // Process Biochem. – 2009. – No. 44. pp. 390-395.
- Lowry O.H. Protein Measurement with the Fooling Phenol Reagent / Lowry O.H., Rosebrough N. J., Farr A. L. and others // J. Biol. Chem. – – No.193. – pp. 265–275.
- Maniatis T. Molecular Cloning: A Laboratory Manual. / Maniatis T., Sambrook J., Fritsch E.F. // Cold Spring Harbor Laboratory Press. – 1982.
- McNulty M.S. Chicken anemia agent in the United States: isolation of the virus and detection of antibody in broiler breeder flocks / McNulty M.S., Connor T.J., McNeilly F. and others // Avian Diseases. – 1989. – Vol. 33. – pp. 691-694.
- McNulty M. S. Preliminary characterization of isolates of chicken anaemia agent from the United Kingdom. / McNulty M. S., Connor T. J., McNeilIy F. and others // Avian Pathology. – 1990. – Vol. 19. – pp. 67-73.
- Natesan S. Biological and molecular characterization of chicken anaemia virus isolates of Indian origin / Natesan S., Kataria J., Dhama K. and others // Virus Res. – 2006. – No. 118. – pp. 78–86.
- Nayabian H. Molecular characterization of the chicken anaemia viruses isolated from broiler farms of west Azerbaijan, Iran / Nayabian H., Mardani K. // Avian Pathology. – 2013. – Vol. 42. – pp. 108-113.
- Pallister R.J. Cloning and sequencing of the chicken anemia virus (CAV) ORF-3 gene, and the development of an ELISA for the detection of serum antibody to CAV / Pallister R.J., Fahey K.J., Sheppard M. // Veterinary Microbiology. – 1994. – No. 39. – pp. 167-178.
- Pringle C.R. Virus Taxonomy at the XIth International Congress of Virology. Sydney, Australia / Pringle C.R. // Archives of Virology. – 1999. – No. 144. – pp. 2065 – 2070.
- Renshaw R.W. A hypervariable region in VP1 of chicken infectious anemia virus mediates rate of spread and cell tropism in tissue culture / Renshaw R.W., Soine C., Weinkle T. and others // J. Virol. – 1996. – No. 70. – pp. 8872–8878.
- Phenk K.V. Transcriptional analysis and genome expression of chicken anemia virus / Phenk K.V., Meehan B.M., Todd D. and others // Journal of General Virology. – No. 75. – pp. 905-909.
- Тodd D. Circoviruses: Immunosuppressive threat to avian species; a review / Тodd D. // Avian Pathology. – 2000. – No. 29. – pp. 373 – 394.
Список литературы на английском языке / References in English
- Aliev A.S. Patogennost' izolyatov virusa infekcionnoj anemii cyplyat [Pathogenicity of chicken infectious anemia virus isolates] / Aliev A.S., Burlakov M.V., Gromov I.N. // Veterinariya. – 2015. – No. 5. – p. 20-24. [in Russian]
- Adams M. J. Ratification vote on taxonomic proposals to the International Committee on Taxonomy of Viruses / Adams M. J, E. J. Lefkowitz, A. M. Q. King and others (2016). Arch. Virol. 161:2921–2949.
- Adair B. Immunopathogenesis of chicken anemia virus infection / Adair B. // Dev.Comp. Immunol. – 2000. – No. 24. – pp. 247–255.
- Candiano G. Blue silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis / Candiano G., Bruschi M., Musante L. and others // Electrophoresis. – 2004. – Vol.25 – No. 9. – pp.1327-1333.
- Ducatez M.F. Molecular epidemiology of chicken anemia virus in Nigeria / Ducatez M.F., Owoade A.A., Abiola J.O. and others // Arch. Virol. – 2006. – No. 151. – pp. 97 – 111.
- Kumar S. MEGA7: Molecular Evolutionary Genetics Analysis version 7.0 for bigger datasets / Kumar S., Stecher G., Tamura K. // Molecular Biology and Evolution // 2016. – No. 33. – pp. 1870-1874.
- Laemmli U. K. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4 / Laemmli U. K. // Nature – Vol. 227. – pp. 680–685. doi :10.1038/227680a0.
- Lee M.S. Production of chicken anemia virus (CAV) VP1 and VP2 protein expressed by recombinant Escherichia coli / Lee M.S., Lien Y.Y., Feng S.H. and others // Process Biochem. – 2009. – No. 44. pp. 390-395.
- Lowry O.H. Protein Measurement with the Fooling Phenol Reagent / Lowry O.H., Rosebrough N. J., Farr A. L. and others // J. Biol. Chem. – – No.193. – pp. 265–275.
- Maniatis T. Molecular Cloning: A Laboratory Manual. / Maniatis T., Sambrook J., Fritsch E.F. // Cold Spring Harbor Laboratory Press. – 1982.
- McNulty M.S. Chicken anemia agent in the United States: isolation of the virus and detection of antibody in broiler breeder flocks / McNulty M.S., Connor T.J., McNeilly F. and others // Avian Diseases. – 1989. – Vol. 33. – pp. 691-694.
- McNulty M. S. Preliminary characterization of isolates of chicken anaemia agent from the United Kingdom. / McNulty M. S., Connor T. J., McNeilIy F. and others // Avian Pathology. – 1990. – Vol. 19. – pp. 67-73.
- Natesan S. Biological and molecular characterization of chicken anaemia virus isolates of Indian origin / Natesan S., Kataria J., Dhama K. and others // Virus Res. – 2006. – No. 118. – pp. 78–86.
- Nayabian H. Molecular characterization of the chicken anaemia viruses isolated from broiler farms of west Azerbaijan, Iran / Nayabian H., Mardani K. // Avian Pathology. – 2013. – Vol. 42. – pp. 108-113.
- Pallister R.J. Cloning and sequencing of the chicken anemia virus (CAV) ORF-3 gene, and the development of an ELISA for the detection of serum antibody to CAV / Pallister R.J., Fahey K.J., Sheppard M. // Veterinary Microbiology. – 1994. – No. 39. – pp. 167-178.
- Pringle C.R. Virus Taxonomy at the XIth International Congress of Virology. Sydney, Australia / Pringle C.R. // Archives of Virology. – 1999. – No. 144. – pp. 2065 – 2070.
- Renshaw R.W. A hypervariable region in VP1 of chicken infectious anemia virus mediates rate of spread and cell tropism in tissue culture / Renshaw R.W., Soine C., Weinkle T. and others // J. Virol. – 1996. – No. 70. – pp. 8872–8878.
- Phenk K.V. Transcriptional analysis and genome expression of chicken anemia virus / Phenk K.V., Meehan B.M., Todd D. and others // Journal of General Virology. – No. 75. – pp. 905-909.
- Тodd D. Circoviruses: Immunosuppressive threat to avian species; a review / Тodd D. // Avian Pathology. – 2000. – No. 29. – pp. 373 – 394.