ЭКСПЕРИМЕНТАЛЬНАЯ КАМЕРА ДЛЯ ТЕРМОСТАБИЛИЗАЦИИ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ ПРИ МИКРОСКОПИЧЕСКИХ ИССЛЕДОВАНИЯХ
Романова А.С.1, Герасимов А.Г.1, Латфуллин А.Р.1, Жиляков Н.В.2, Хазиев Э.Ф.3, Самигуллин Д.В.4
1Магистрант, Казанский национальный исследовательский технический университет им. А.Н. Туполева, 2аспирант, Казанский институт биохимии и биофизики Казанского научного центра РАН, младший научный сотрудник, Казанский (Приволжский) федеральный университет, 3ORCID: 0000-0002-1552-5526, кандидат биологических наук, младший научный сотрудник, Учреждение Российской академии наук Казанский институт биохимии и биофизики Казанского научного центра РАН, Казанский (Приволжский) федеральный университет, доцент, Казанский национальный исследовательский технический университет им. А.Н. Туполева, 4ORCID: 0000-0001-6019-5514, кандидат биологических наук, старший научный сотрудник, Казанский институт биохимии и биофизики Казанского научного центра РАН, Казанский (Приволжский) федеральный университет, доцент, Казанский национальный исследовательский технический университет им. А.Н. Туполева
Работа поддержана грантами: РФФИ № 16-04-01051 (СДВ), №16-34-00817 и № 15-04-02983 (ХЭФ); Президиума РАН "Механизмы интеграции молекулярных систем при реализации физиологических функций". Работа частично выполнена за счет средств субсидии, выделенной в рамках государственной поддержки Казанского (Приволжского) федерального университета в целях повышения его конкурентоспособности среди ведущих мировых научно-образовательных центров
ЭКСПЕРИМЕНТАЛЬНАЯ КАМЕРА ДЛЯ ТЕРМОСТАБИЛИЗАЦИИ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ ПРИ МИКРОСКОПИЧЕСКИХ ИССЛЕДОВАНИЯХ
Аннотация
Температура является одним из важных определяющих факторов физиологических процессов. В живом организме химические процессы протекают с участием сложных ферментных систем, активность которых зависит от температуры. Поддержание постоянной температуры биологических объектов является необходимой составляющей проведения исследований в области биологии и нейрофизиологии. В данной работе описана конструкция экспериментальной термостатируемой камеры, предназначенной для проведения исследований на возбудимых клетках с использованием микроскопической техники. Камера отличается простотой конструкции и позволяет регулировать температуру исследуемого объекта в широком диапазоне значений.
Ключевые слова: температура, термостатирование, биологические объекты, микроскопия.
Romanova A.S.1, Gerasimov A.G.1, Latfullin A.R.1, Zhilyakov N.V.2, Khaziev E.F.3, Samigullin D.V.4
1Master student, Kazan National Research Technical University named after AN Tupolev, 2Postgraduate student, Russian Academy of Sciences, Kazan Institute of Biochemistry and Biophysics, Kazan Scientific Center of the Russian Academy of Sciences, Junior Research, Kazan (Volga region) Federal University, 3ORCID: 0000-0002-1552-5526, PhD in Biology, Junior Researcher, Russian Academy of Sciences, Kazan Institute of Biochemistry and Biophysics, Kazan Scientific Center of the Russian Academy of Sciences, Kazan (Volga region) Federal University, associate professor, AN Tupolev Kazan National Research Technical University, 4ORCID: 0000-0001-6019-5514, PhD in Biology, Senior Researcher, Kazan Institute of Biochemistry and Biophysics, Kazan Scientific Center of the Russian Academy of Sciences, Kazan (Volga region) Federal University, associate professor, AN Tupolev Kazan National Research Technical University.
The following work is supported by grants: Russian Foundation for Basic Research No. 16-04-01051, No. 16-34-00817 and No.15-04-02983; Presidium of Russian Academy of Science “Mechanisms of Molecular Systems Integration in the Realization of Physiological Functions.” The work was partially implemented at the expense of the subsidy allocated within the framework of the state support of the Kazan (Volga region) Federal University in order to increase its competitiveness among the world's leading research and educational centres
EXPERIMENTAL CAMERA FOR THERMO STABILIZATION OF BIOLOGICAL OBJECTS IN MICROSCOPIC STUDIES
Abstract
Temperature is one of the important determinants in physiological processes. Chemical processes take place in a living organism with the participation of complex enzyme systems, the activity of which depends on the temperature. Maintaining permanent temperature of biological objects is a necessary component of research in the field of biology and neurophysiology. In this paper, we describe the design of an experimental thermo-stated chamber, developed to perform studies on excitable cells with the help of microscopic techniques. The camera is simple in design and allows adjusting the temperature of the object under study in a wide range of values.
Keywords: temperature, thermostat control, biological objects, microscopy.
Введение
Температура является одним из определяющих факторов физиологических процессов. Согласно правилу Вант-Гоффа, повышение температуры ведет к пропорциональному возрастанию скорости химических реакций. В живом организме химические процессы всегда идут с участием сложных ферментных систем, активность которых зависит от температуры. В результате ферментативного катализа возрастает скорость биохимической реакции и количественно меняется ее зависимость от внешней температуры. Изменение температуры среды существенно меняет скорость многих пресинаптических процессов, включенных в синаптическую передачу позвоночных. Спонтанная секреция медиатора [1, 2, 3], длительность потенциала действия нервного окончания [4], скорость спада облегчения [3] являются температуро - чувствительными процессами с величиной Q10 (температурный коэффициент, указывающий на интенсификацию реакций или др. процессов, вызываемую увеличением температуры на 10oС.) порядка 3 при физиологических температурах. Работа мышечных волокон [5] и действие некоторых физиологически активных соединений, например АТФ [6], может зависеть от температуры. Естественно, при исследованиях, связанных с изучением межклеточных взаимодействий в таких сложных биологических системах как возбудимые клетки, возникает задача термостатирования небольших образцов в заданных точках диапазона положительных температур. Это необходимо для исключения влияния изменения температуры на наблюдаемые эффекты, и для изучения влияния различных температурных режимов на параметры работы клеточных структур.
Как правило, для решения задачи термостатирования при биологических исследованиях используют жидкостное термостатирование прокачиванием хладотеплоносителя по контуру, окружающему термостатируемый объект. Жидкостное термостатирование не лишено недостатков: громоздкость, значительный вес и потребляемая мощность, сильный шум, необходимость большого количества хладотеплоносителя, длительное время выхода на режим термостатирования. Электронные методы термостатирования принципиально отличаются тем, что при их использовании электрическая энергия непосредственно преобразуется в тепловой поток без применения какого-либо движущегося жидкого или газообразного рабочего тела. В отличие от жидкостных электронные термостаты не имеют механических подвижных деталей, объемных полостей, трубок с хладогентом и т. д. С этой точки зрения электронные системы термостатирования наиболее подходят для микроскопических биологических исследований, при которых необходимо термостатировать препарат в ограниченном пространстве. Одним из электронных методов термостатирования является термоэлектрический метод, основанный на применении термоэлектрических модулей, работающих на основе эффекта Пельтье. Такие модули различных размеров и электрических характеристик серийно выпускаются промышленностью, надежны и находят широкое применение в различных устройствах. В нашей лаборатории подобные модули используются в экспериментальной термостатируемой камере для проведения различных микроскопических исследований биологических препаратов.
Описание узлов и конструкция камеры.
Экспериментальная камера для поддержания температуры биологического образца состоит из доступных компонентов, которые можно приобрести через интернет или в специализированных магазинах. Основой камеры служит радиатор марки BLA239-150 (Рис 1, (1)), габариты которого подходят для размещения двух модулей Пельтье марки TEC1-12706 (40×40мм) (Рис 1, (3)). Радиатор необходим, поскольку модули Пельтье выделяют в процессе работы большое количество тепла. В зависимости от заданной температуры в камере и от температуры в помещении радиатор будет либо нагреваться, либо охлаждаться.

Рис. 1 – Фотография необходимых материалов и оборудования для изготовления экспериментальной камеры (сверху) и схема сборки камеры (снизу). 1 - радиатор; 2 – кронштейн; 3 – Элементы Пельтье; 4 – стеклянное дно; 5 - теплопроводящая смазка; 6 – герметик; 7 – корпус камеры (а- змеевик, б - предварительная камера, в - рабочая камера, г – камера для отвода жидкости); 8- болты крепления с гайками; 9- трубка отсоса; 10- кронштейн для крепления трубки отсоса; 11- пластина крепления отсоса; 12- штуцер подачи раствора (окончание на стр. 100)
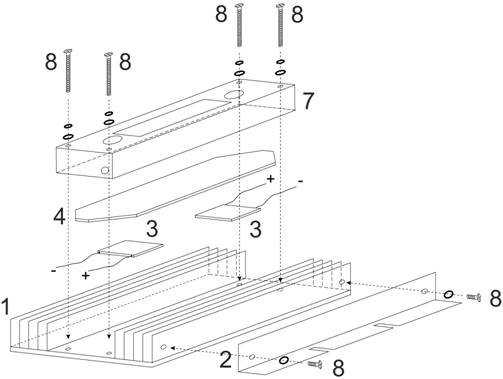
Окончание рис. 1 – Фотография необходимых материалов и оборудования для изготовления экспериментальной камеры (сверху) и схема сборки камеры (снизу). 1 - радиатор; 2 – кронштейн; 3 – Элементы Пельтье; 4 – стеклянное дно; 5 - теплопроводящая смазка; 6 – герметик; 7 – корпус камеры (а- змеевик, б - предварительная камера, в - рабочая камера, г – камера для отвода жидкости); 8- болты крепления с гайками; 9- трубка отсоса; 10- кронштейн для крепления трубки отсоса; 11- пластина крепления отсоса; 12- штуцер подачи раствора
Как показывает наш опыт, данный тип радиатора применим для отведения тепла при установке температуры в экспериментальной камере в диапазоне от 15 0C до 37 0C без дополнительных вентиляторов и жидкостного охлаждения. В радиаторе просверливаются отверстия, и нарезается резьба под винт М3 для крепления корпуса камеры и кронштейна для закрепления на микроскопном столике. Кронштейн изготавливается из алюминиевого уголка 20×20 мм и крепится винтами М3 к радиатору (Рис 1, (2)). В кронштейне высверливаются отверстия для крепления к микроскопному столику. Конфигурация и диаметр отверстий выбирается исходя из конструкции микроскопного столика. Элементы Пельтье контактируют рабочей стороной со стеклянным дном камеры толщиной 1.3 мм (Рис 1, (4)). В качестве заготовки для изготовления дна использовалась стеклянная фотопластинка (слой эмульсии был удален). Стоит отметить, что дно камеры должно быть сделано из стекла для обеспечения лучшей теплопроводнсти. Обе стороны элементов Пельтье контактируют с радиатором и дном камеры через теплопроводящую смазку КТП – 8 (Рис 1, (5)). Дно камеры приклеивается при помощи силиконового герметика (Рис 1, (6)) к корпусу камеры, изготовленному из листа органического стекла толщиной 10 мм (Рис 1, (7)). В корпусе при помощи сверлильного или фрезерного станка высверливаются отверстия для подачи раствора (Рис 1, (7, а)) и размещения различных датчиков и микроинструментов, в зависимости от экспериментальных условий. Для более эффективного теплообмена подача раствора осуществляется через змеевик, фрезерованный в корпусе камеры (Рис 1, (7, б)). Так же высверливаются отверстия под предварительную камеру (Рис 1, (7, б)) рабочую камеру (Рис 1, (7, в)) и камеру для отвода жидкости (Рис 1, (7, г)). Предварительная камера необходима для демпфирования гидроударов, возникающих в системе перфузии при подаче раствора. В камере для отвода жидкости располагается трубка (Рис 1, (8)), отсасывающая раствор, протекающий через рабочую зону камеры. В качестве трубки отсоса раствора используется игла от системы внутривенного вливания, диаметром 1,5 мм. Трубка отсоса закрепляется в держателе, изготовленном из органического стекла (Рис 1, (9)). В свою очередь держатель крепится к камере при помощи приклеенного магнита. Для крепления магнита к корпусу камеры на двустороннем скотче крепится металлическая пластина (Рис 1, (10)). Корпус камеры с дном и элементами Пельтье плотно притягивается к радиатору винтами М3 с шайбой гровера. Предпочтительно использование крепежа из нержавеющей стали (см. схему сборки на рис. 1). Внешний вид камеры в сборе представлен на Рис. 2.

Рис. 2 – Фотография камеры в сборе
Провода от элементов Пельтье соединяются параллельно и припаиваются к разъему питания. Для запитывания элементов Пельтье возможно использование блока питания с ручной регулировкой и стабилизацией напряжения или тока. Напряжение питания зависит от выбранного диапазона рабочих температур. Для регулировки температуры в диапазоне +15 - +36 oC достаточно использовать источник питания, рассчитанный на ток 2-4А. Для контроля температуры в камере используется автономный термометр с выносным датчиком температуры. Возможно использование термометра с жидкокристаллическим дисплеем для дистанционного контроля температуры. Такие термометры снабжены выносным датчиком температуры из нержавеющей стали, соединенным с основным корпусом гибким проводом. Датчик располагается в рабочей камере в непосредственной близости от объекта исследования. В зависимости от заданной температуры, контролируемой термометром, задается напряжение на элементах Пельтье, которое подбирается экспериментальным методом. В нашей лаборатории для поддержания температуры в экспериментальной камере используется специально разработанный автоматический контроллер, работающий по принципу пропорционально-интегрально-дифференцирующего (ПИД) регулятора. На рис. 3 показан график, иллюстрирующий работу камеры, температуру в которой задает автоматический контроллер. Видно, что температура в рабочей области выходит на заданный уровень (15, 20 или 35 oC) примерно за 5 мин. Волнообразные изменения температуры в начальные моменты времени установления связаны с алгоритмом работы ПИД регулятора. На графике представлены усредненные замеры 5 опытов со стандартной ошибкой. Во время работы системы через камеру протекала дистиллированная вода со скоростью 32 капли в минуту.
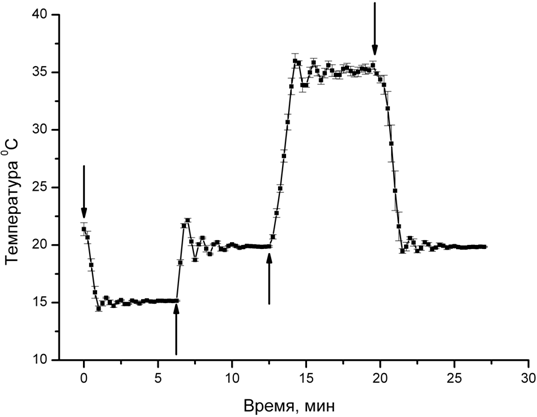
Рис. 3 – График иллюстрирующий работу термостатируемой камеры. По оси Y температура в рабочей зоне камеры, по оси X – время. Стрелками указаны моменты изменения температуры регулятором. Усредненные данные 5 циклов нагревания и охлаждения
Заключение
Достигаемая при помощи разработанной системы термостабилизации точность и быстрота установления температуры в рабочей зоне камеры позволяют быстро изменять и поддерживать необходимую тепмературу среды для проведения электрофизиологических и микроскопических исследований с применением различных биологически активных соединений и перспективных фармакологических препаратов на целых препаратах и одиночных клетках. Благодаря конструкции рабочей камеры возможно использование системы перфузии препарата, которая позволяет оперативно сменять раствор в рабочей области камеры, что особенно важно при работе на нейронах центральной нервной системы. Использование элементов Пельтье позволяет нагревать и охлаждать препарат, регулируя температуру рабочей камеры в широком диапазоне значений. Это выгодно отличает систему от промышленных аналогов на других активных элементах, способных только к нагреву препарата выше комнатной температуры [7]. В отличие от коммерчески доступных дорогостоящих аналогов [8], представленная камера собрана из доступных недорогих компонентов. В нашей лаборатории данная система термостабилизации используется при работе на периферических нервных окончаниях теплокровных и холоднокровных животных при изучении временного хода секреции квантов медиатора [9] и модуляции синаптической передачи физиологически активными веществами [10]. Cущественным достоинством предлагаемой системы является отсутствие шумов и наводок на регистрирующую аппаратуру, препятствующих регистрации электрофизиологической активности возбудимых клеток.
Список литературы / References
- Fatt P. Spontaneous subthreshold activity t motor nerve endings / P. Fatt, B. Katz // The Journal of Physiology. – 1952. – Vol. 117(1). – P. 109-128.
- Boyd I., Spontaneous subthreshold activity at mammalian neuromuscular junction / I. Boyd, A. Martin // The Journal of Physiology. – 1956. - Vol. 132(1). - P. 61-73.
- Hubbard J. The effect of temperature change upon transmitter release, facilitation and post-tetanic potentiation / J. Hubbard, S. Jones and E. Landau // The Journal of Physiology.- 1971. – Vol. 216(3). – P. 591-609.
- Katz B. Propagation of electric activity in motor nerve terminals / B. Katz, R. Miledi // Proceedings of the Royal Society of London. Series B, Biological sciences. – 1965.- Vol.(161). – P.: 453-483.
- Khairullin A. E. Motor units at various temperatures / A. E. Khairullin, A. U. Ziganshin and S. N. Grishin // Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology. – 2017. – Vol. 11(1). doi:10.1134/S1990747816040048.
- Ziganshin A. U. Effects of ATP and adenosine on contraction amplitude of rat soleus muscle at different temperatures / A. U. Ziganshin, A. E. Khairullin, V. V. Zobov, L. E. Ziganshina, A. I. Gabdrakhmanov, B. A. Ziganshin and S. N. Grishin // Muscle and Nerve. – 2017 – Vol. 55(3). – P. 417–423. doi:10.1002/mus.25263.
- Bioscience tools, Systems & Accessories for Imaging & Recording in Animal Physiology & Cell Biology: MicroIncubators for live samples Single Cell & Tissue Perfusion CO2, O2 & Temperature Control Liquid Delivery & Fluidics [Electronic resource]-URL:http://biosciencetools.com/Catalog.pdf (accessed: 13.04.2017).
- Warner Instruments a Harvard Apparatus. Specialized tools for Electrophysiology & Cell Biology Research [Electronic resource] –URL: http://biosciencetools.com/Catalog.pdf (accessed: 13.04.2017).
- Samigullin D., Bukharaeva E., Nikolsky E., Vyskocil F. 2003. Temperature effect on proximal to distal gradient of quantal release of acetylcholine at frog endplate / D. Samigullin, E. Bukharaeva, E. Nikolsky and F. Vyskocil // Neurochem. Res. – 2003 – Vol. 28 (3–4). - P. 507–514.
- Khaziev E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction / E. Khaziev, D. Samigullin, N. Zhilyakov, N. Fatikhov, E. Bukharaeva, A. Verkhratsky and E. Nikolsky // Frontiers in Physiology. – 2016 – Vol. 7(621). doi: 10.3389/fphys.2016.00621.
