АДАПТАЦИОННАЯ ДИНАМИКА АКТИВНОСТИ ГЛУТАТИОНПЕРОКСИДАЗЫ В СЫВОРОТКЕ КРОВИ И ИНЫХ ТКАНЯХ КРЫС ПРИ КРИОДЕСТРУКЦИИ ПРАВОГО ПРЕДСЕРДИЯ
АДАПТАЦИОННАЯ ДИНАМИКА АКТИВНОСТИ ГЛУТАТИОНПЕРОКСИДАЗЫ В СЫВОРОТКЕ КРОВИ И ИНЫХ ТКАНЯХ КРЫС ПРИ КРИОДЕСТРУКЦИИ ПРАВОГО ПРЕДСЕРДИЯ
Научная статья
Борискин П.В.1, Гуленко О.Н.2, Павлова О.Н.3, *, Зайцев В.В4., Палевская С.А.5
2 ORCID: 0000-0001-6338-7095;
1 Медицинский университет «Реавиз», Самара, Россия;
2, 3 Самарский государственный университет путей сообщения, Самара, Россия;
2, 3, 5 Самарский государственный медицинский университет, Самара, Россия;
4 Самарский государственный аграрный университет, Кинель, Россия
* Корреспондирующий автор (casiopeya13[at]mail.ru)
АннотацияТак как смертность от сердечно-сосудистых заболеваний занимает лидирующие позиции среди других болезней в настоящее время большое внимание уделяется поискам маркеров патологических состояний органов сердечно-сосудистой системы и роли оксидативного стресса в патогенезе хронических сердечно-сосудистых заболеваний. Одним из маркеров окислительного стресса является активность глутатионпероксидазы в органах и тканях, как отражение интенсивности окислительных реакций и работы антиоксидантной системы организма. В связи с этим, цель исследования состояла в изучении динамики активности глутатионпероксидазы в сыворотке крови и иных тканях крыс, на фоне криодеструкции миокарда правого предсердия. Задачи исследования: определить активность глутатионпероксидазы в динамике в сыворотке крови, тканях сердца, тканях печени, тканях мозга и скелетной мышечной ткани у интактных животных и животных с экспериментальным оксидативным стрессом, вызванным криодеструкцией миокарда предсердий. В эксперименте было использовано 60 животных, поделенных поровну на 2 группы (интактную и опытную). Красам опытной группы проводили криодеструкцию правого предсердия и у животных обеих групп определяли активность глутатитионпероксидазы в сыворотке крови и всех изучаемых тканях до начала опыта, а также на 1, 3, 5, 7 и 14 сутки эксперимента. Установили: активность глутатионпероксидазы в сыворотке крови, тканях печени, тканях мозга, тканях сердца и скелетной мышечной ткани крыс при криодеструкции предсердий и индуцировании оксидативного стресса снижается по сравнению с интактными животными в течение первых 7 суток после повреждающего воздействия на 31,7 %, 29,5 %, 31,2 %, 44,3 % и 35,5 % соответственно. Но к концу эксперимента, за счет адаптационных процессов установлена тенденция к нормализации уровня глутатионпероксидазы и ее активность начинает возрастать в изучаемых тканях, но, по прежнему, регистрируются значения ниже, чем у интактных крыс – в сыворотке крови ниже на 18,4 %, в тканях печени – ниже на 12,5 %, в тканях мозга – ниже на 14,7 %, в тканях сердца – ниже на 29,9 % и скелетной мышечной ткани – ниже на 25,9 %, что свидетельствует о глубоких нарушениях окислительного гомеостаза в результате криодеструкции правого предсердия.
Ключевые слова: оксидативный стресс, глутатионпероксидаза, сыворотка крови, ткани печени, ткани мозга, ткани сердца, скелетная мышечная ткань.
ADAPTIVE DYNAMICS OF GLUTATHIONE PEROXIDASE ACTIVITY IN BLOOD SERUM AND OTHER RAT TISSUES DURING CRYODESTRUCTION OF THE RIGHT ATRIUM
Research article
Boriskin P.V.1, Gulenko O.N.2, Pavlova O.N.3, *, Zaytsev V.V.4, Palevskaya S.A.5
2 ORCID: 0000-0001-6338-7095;
1 Reaviz Medical University, Samara, Russia;
2, 3 Samara State Transport University, Samara, Russia;
2, 3, 5 Samara State Medical University, Samara, Russia;
4 Samara State Agrarian University, Kinel, Russia
* Corresponding author (casiopeya13[at]mail.ru)
AbstractSince cardiovascular diseases occupy the leading position in terms of mortality, much attention is currently being paid to the search for markers of pathological conditions of the organs of the cardiovascular system and the role of oxidative stress in the pathogenesis of chronic cardiovascular diseases. One of the markers of oxidative stress is the activity of glutathione peroxidase in organs and tissues as a reflection of the intensity of oxidative reactions and the work of the body's antioxidant system. In light of this fact, the aim of the article was to study the dynamics of glutathione peroxidase activity in blood serum and other tissues of rats against the background of cryodestruction of the right atrial myocardium. The objectives of the study were to determine the activity of glutathione peroxidase in dynamics in blood serum, heart tissues, liver tissues, brain tissues and skeletal muscle tissue in intact animals and animals with experimental oxidative stress caused by cryodestruction of the atrial myocardium. The experiment involved 60 animals divided equally into 2 groups (intact and experimental). Cryodestruction of the right atrium was performed on the animals of the experimental group, while the activity of glutathione peroxidase in the blood serum and all the studied tissues were determined in animals of both groups before the experiment as well as on the 1st, 3rd, 5th, 7th and 14th days of the experiment. Results: the activity of glutathione peroxidase in blood serum, liver tissues, brain tissues, heart tissues and skeletal muscle tissue of rats during atrial cryodestruction and induction of oxidative stress decreases in comparison with intact animals during the first 7 days after damaging effects by 31,7 %, 29,5 %, 31,2 %, 44,3 % and 35.5%, respectively. However, by the end of the experiment, due to adaptive processes, a tendency was established to normalize the level of glutathione peroxidase and its activity begins to increase in the tissues under study, but, as before, values are recorded lower than in intact rats – it is lower by 18.4% in blood serum, by 12.5% in liver tissues, by 14.7% in brain tissues, by 29.9% in heart tissues, and by 25.9% in skeletal muscle tissue. This indicates deep violations of oxidative homeostasis as a result of cryodestruction of the right atrium.
Keywords: oxidative stress, glutathione peroxidase, blood serum, liver tissue, brain tissue, heart tissue, skeletal muscle tissue.
Введение
Так как смертность от сердечно-сосудистых заболеваний занимает лидирующие позиции среди других болезней в настоящее время большое внимание уделяется поискам маркеров патологических состояний органов сердечно-сосудистой системы и роли оксидативного стресса в патогенезе хронических сердечно-сосудистых заболеваний [1], [2]. Установлено, что оксидативный стресс и активные формы кислорода обладают специфическими адаптивными эффектами: при низких местных концентрациях и под контролем антиоксидантной системы организма в условиях физиологической нормы они регулируют сосудистый тонус, иммунитет, воспалительные процессы и участвуют в передаче информации посредством специфических внутриклеточных сигнальных молекул, но при высоком уровне окислительных процессов и повышенной концентрации активных форм кислорода и свободных радикалов биологические эффекты заключаются в прямом окислительном воздействии на белки, ДНК, клеточные мембраны, что приводит к повреждению и гибели клеток и воссозданию еще более активных свободных радикалов [3], [4], [5].
Многочисленными исследованиями доказана роль оксидативного стресса в патогенезе различных сердечно-сосудистых заболеваний, он способствует прогрессированию гипертонической болезни, реноваскулярной и злокачественной артериальной гипертензии, дислипидемии, атеросклерозу и всех форм ишемической болезни сердца, реперфузионной ишемии, тромбозу, и другим патологиям. Возникновение оксидативного дисбаланса сказывается на функционировании всего организма в целом [6], [7].
Одним из маркеров оксилительного стресса является активность глутатионпероксидазы в органах и тканях, как отражение интенсивности оксилительных реакций и работы антиоксидантной системы организма.
В связи с этим, цель исследования состояла в изучении динамики активности глутатионпероксидазы в сыворотке крови и иных тканях крыс, на фоне криодеструкции миокарда правого предсердия.
Для реализации поставленной цели нам предстояло решить следующие задачи: определить активность глутатионпероксидазы в динамике в сыворотке крови, тканях сердца, тканях печени, тканях мозга и скелетной мышечной ткани у интактных животных и животных с экспериментальным оксидативным стрессом, вызванным криодеструкцией миокарда предсердий.
Материалы и методыВ эксперименте было использовано 60 животных мужского пола восьмимесячного возраста. Вес крыс составлял 220-240 г. Крысы были поровну разделены на 2 группы, одна группа – интактные животные, вторая группа – опытная. Крысам 2 группы проводили криодеструкцию миокарда правого предсердия с помощью аппарата Криоиней КИ-401 с использованием криоаппликатора № 4 с диаметром рабочей части наконечника 4 мм, с экспозицией 10 секунд. (КриоИней® имеет: Регистрационное удостоверение Росздравнадзора N° ФСР 2009 / 04738.). Работа с животными проводилась в соответствии с этическими нормами под эфирным наркозом и по окончании криодеструкции производили наложение
2-х провизорных швов с доступом, в области 3-4 межреберья, к предсердиям крыс. Грудную полость ушивали герметично, удалив из неё воздух шприцем.
Активность глутатитионпероксидазы в сыворотке крови и всех изучаемых тканях крыс исследовали до начала опыта, а также на 1, 3, 5, 7 и 14 сутки эксперимента по накоплению окисленного глутатиона [8]. Животных декапитировали, забирали кровь и путем механического измельчения тканей сердца, мозга, печени и скелетной мышечной ткани массой 1 г с 9 мл трис-буфера (рН 7,4) готовили гомогенаты в автоматическом гомогенизаторе [9].
Цифровой экспериментальный материал подвергали статистической обработке с применением непараметрического статистического анализа. В работе использованы такие непараметрические критерии, как медиана и процентильный размах, так как они наиболее полно отражают распределение вариант в вариационном ряду. С целью установления достоверности различий в изучаемых группах использовали критерии Вальда-Вольфовица, Колмогорова-Смирнова и Манна-Уитни с расчетом значения р для каждого метода.
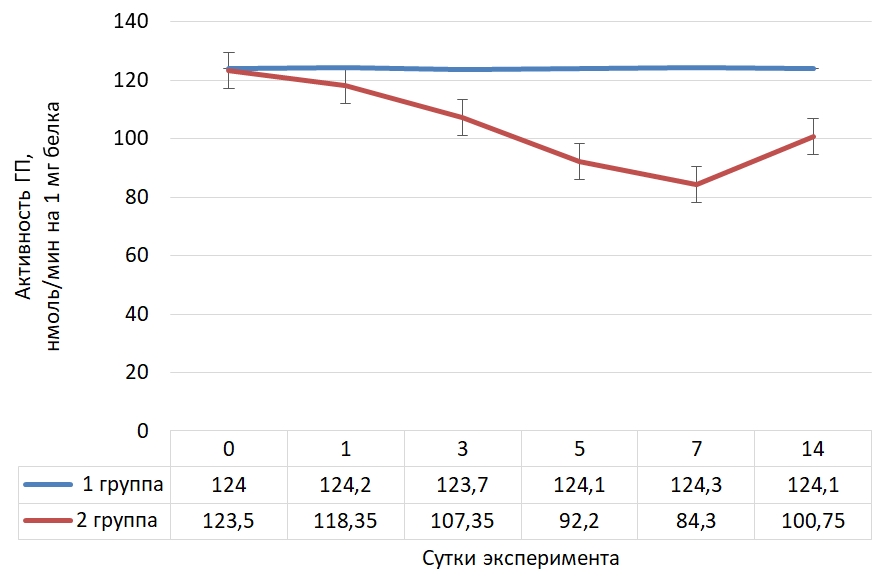
Основные результаты Динамика активности глутатитионпероксидазы (Ме) в сыворотке крови крыс представлена на рисунке 1.Рис. 1 – Динамика активности глутатионпероксидазы в сыворотке крови крыс в норме и при криодеструкции миокарда правого предсердия
Согласно представленным данным, на фоне криодеструкции правого предсердия и вызванного этим процессом оксидативного стресса, в крови крыс наблюдается изначально интенсивное снижение активности глутатионпероксидазы, как одного из важнейших ферментов антиоксидантной системы организма до 7 суток опыта (ниже на 31,7 %), а затем, благодаря компенсаторным механизмам и процессам адаптации определяется тенденция повышения активности фермента, но активность была ниже исходного значения на 18,4 %.
Распределение значений активности глутатионпероксидазы в сыворотке крови животных с экспериментальным оксидативным стрессом представлено в таблице 1.
Таблица 1 – Распределение значений активности глутатионпероксидазы в сыворотке крови крыс на фоне криодеструкции предсердий
| Сутки | N | M | Mе | Min | Max | 25 Per | 75 Per | 10 Per | 90 Per |
| 0 | 30 | 123,57 | 123,50 | 119,60 | 127,10 | 121,90 | 125,30 | 120,65 | 126,55 |
| 1 | 30 | 118,84 | 118,35 | 113,60 | 123,80 | 115,70 | 122,50 | 114,05 | 123,60 |
| 3 | 30 | 107,22 | 107,35 | 102,20 | 111,30 | 105,10 | 109,30 | 103,50 | 110,85 |
| 5 | 30 | 92,65 | 92,20 | 88,60 | 97,90 | 90,80 | 93,10 | 89,50 | 97,45 |
| 7 | 30 | 84,11 | 84,30 | 80,00 | 88,20 | 81,70 | 86,10 | 81,25 | 87,45 |
| 14 | 30 | 101,13 | 100,75 | 97,80 | 105,60 | 99,90 | 102,30 | 99,35 | 103,90 |
Согласно табличным данным, на фоне криодеструкции миокарда предсердий произошло интенсифицирование оксидативного стресса, что привело к снижению активности глутатионпероксидазы.
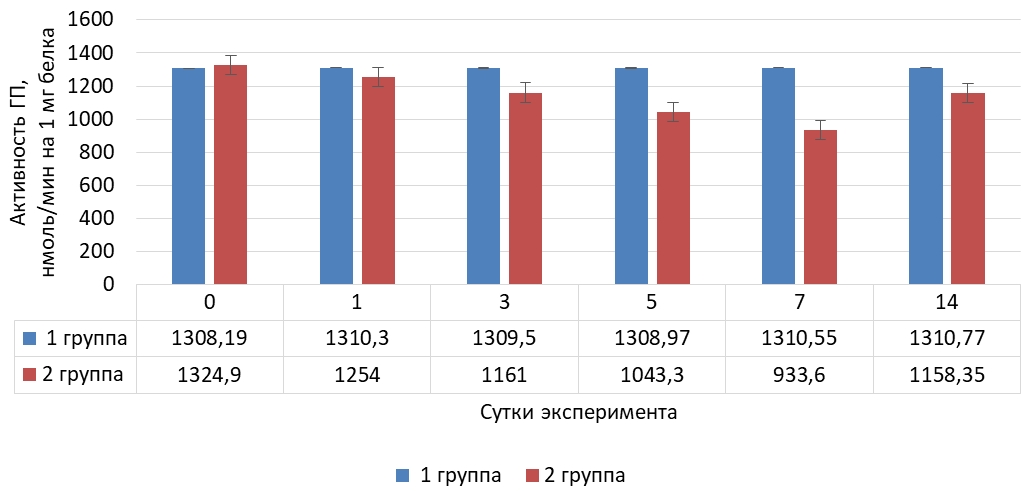
Динамика активности глутатитионпероксидазы (Ме) в тканях печени крыс представлена на рисунке 2.
Рис. 2 – Динамика активности глутатионпероксидазы в тканях печени крыс в норме и при криодеструкции миокарда правого предсердия
В отношении динамики глутатионпероксидазы в тканях печени наблюдается аналогичная сыворотке крови тенденция: до седьмых суток активность фермента интенсивно снижалась (на 29,5 %) по сравнению с исходным значением, а на 14 сутки установлена интенсификация активности фермента, но на 12,5 % ниже начального значения.
Распределение значений активности глутатионпероксидазы в тканях печени животных с экспериментальным оксидативным стрессом представлено в таблице 2.
Таблица 2 – Распределение значений активности глутатионпероксидазы в тканях печени крыс на фоне криодеструкции предсердий
| Сутки | N | M | Mе | Min | Max | 25 Per | 75 Per | 10 Per | 90 Per |
| 0 | 30 | 1321,45 | 1324,90 | 1271,60 | 1365,80 | 1300,50 | 1340,20 | 1276,40 | 1359,35 |
| 1 | 30 | 1252,70 | 1254,00 | 1209,10 | 1294,90 | 1241,30 | 1263,10 | 1228,70 | 1277,10 |
| 3 | 30 | 1166,68 | 1161,00 | 1119,60 | 1223,40 | 1144,20 | 1198,20 | 1129,50 | 1214,40 |
| 5 | 30 | 1046,53 | 1043,30 | 981,80 | 1137,80 | 1011,00 | 1079,20 | 992,30 | 1109,20 |
| 7 | 30 | 932,14 | 933,60 | 915,40 | 945,80 | 927,30 | 938,90 | 917,55 | 941,80 |
| 14 | 30 | 1134,93 | 1158,35 | 1014,80 | 1216,20 | 1110,60 | 1177,50 | 1025,60 | 1190,40 |
Согласно представленным данным, мы наблюдаем снижение активности глутатионпероксидазы в тканях печени на фоне экспериментального оксидативного стресса, иницированного криодеструкцией предсердий.
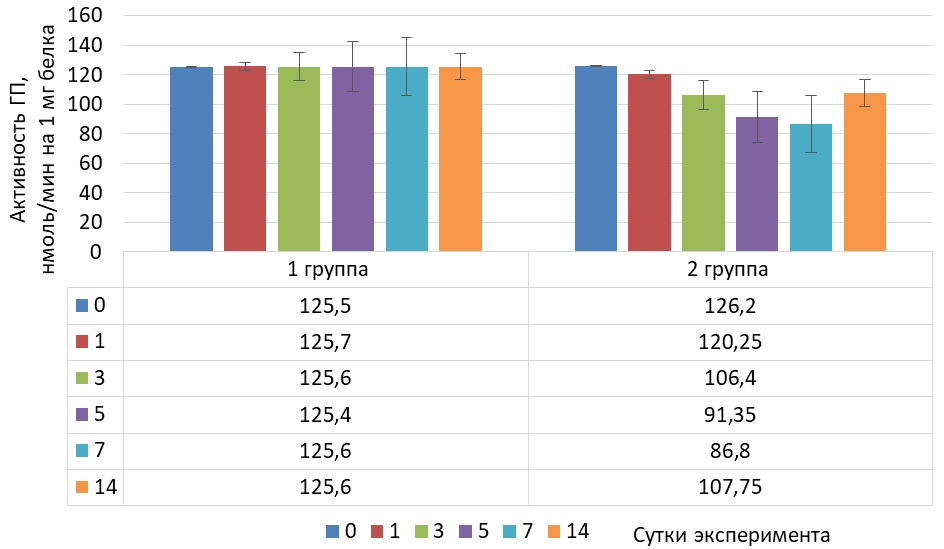
Динамика активности глутатитионпероксидазы (Ме) в тканях мозга крыс представлена на рисунке 3.
Рис. 3 – Динамика активности глутатионпероксидазы в тканях мозга крыс в норме и при криодеструкции миокарда правого предсердия
В тканях мозга на фоне криодеструкции правого предсердия установлено снижение активности глутатионпероксидазы на 31,2 % от исходного уровня и затем, к окончанию эксперимента активность фермента увеличилась, но была ниже исходного значения на 14,7 %.
Распределение значений активности глутатионпероксидазы в тканях мозга животных с экспериментальным оксидативным стрессом представлено в таблице 3.
Таблица 3 – Распределение значений активности глутатионпероксидазы в тканях мозга крыс на фоне криодеструкции предсердий
| Сутки | N | M | Mе | Min | Max | 25 Per | 75 Per | 10 Per | 90 Per |
| 0 | 30 | 125,92 | 126,20 | 121,50 | 130,50 | 124,00 | 127,60 | 122,35 | 129,00 |
| 1 | 30 | 120,64 | 120,25 | 113,50 | 125,10 | 118,10 | 123,80 | 116,65 | 124,65 |
| 3 | 30 | 106,32 | 106,40 | 104,80 | 108,80 | 105,30 | 107,00 | 105,20 | 107,65 |
| 5 | 30 | 89,79 | 91,35 | 82,90 | 96,40 | 84,40 | 93,80 | 83,50 | 95,15 |
| 7 | 30 | 86,47 | 86,80 | 82,80 | 89,30 | 84,50 | 88,10 | 83,45 | 88,90 |
| 14 | 30 | 107,94 | 107,75 | 103,50 | 112,10 | 106,10 | 110,00 | 104,70 | 111,35 |
В тканях мозга в отношении активности глутатионпероксидазы на фоне экспериментального оксидативного стресса наблюдается аналогичная сыворотки крови и тканям печени тенденция.
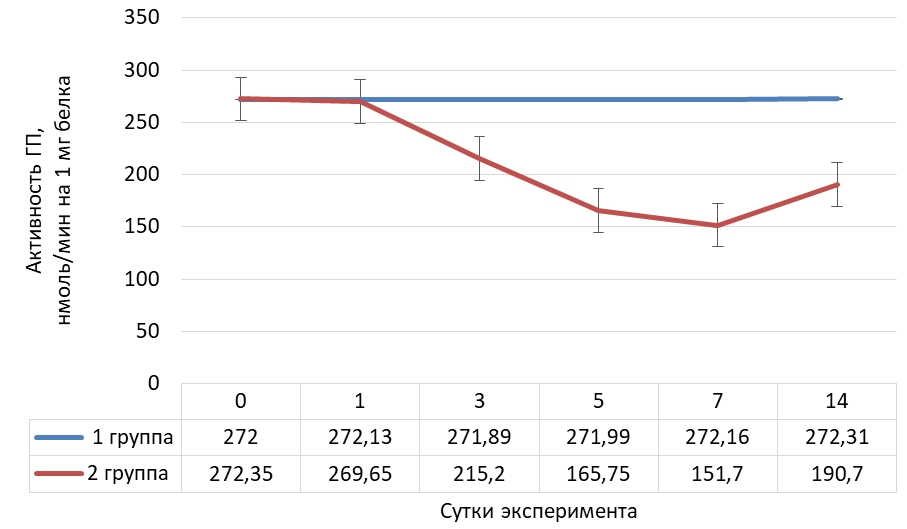
Динамика активности глутатитионпероксидазы (Ме) в тканях сердца крыс представлена на рисунке 4.
Рис. 4 – Динамика активности глутатионпероксидазы в тканях сердца крыс в норме и при криодеструкции миокарда правого предсердия
В тканях сердца, как и в выше изученных тканях, активность глутатионпероксидазы интенсивно снижалась до седьмых суток опыта и была ниже на 44,3 % по сравнению с исходным значением, а к концу эксперимента – возросла, но была ниже на 29,9 % начального значения.
Распределение значений активности глутатионпероксидазы в тканях сердца животных с экспериментальным оксидативным стрессом представлено в таблице 4.
Таблица 4 – Распределение значений активности глутатионпероксидазы в тканях сердца крыс на фоне криодеструкции предсердий
| Сутки | N | M | Mе | Min | Max | 25 Per | 75 Per | 10 Per | 90 Per |
| 0 | 30 | 272,74 | 272,35 | 261,50 | 283,40 | 266,00 | 279,80 | 263,10 | 282,15 |
| 1 | 30 | 265,70 | 269,65 | 254,50 | 276,40 | 257,10 | 272,90 | 255,90 | 275,15 |
| 3 | 30 | 214,67 | 215,20 | 205,30 | 223,10 | 209,80 | 219,40 | 206,55 | 222,50 |
| 5 | 30 | 164,97 | 165,75 | 157,80 | 172,10 | 160,20 | 168,60 | 158,45 | 171,00 |
| 7 | 30 | 151,43 | 151,10 | 144,80 | 160,70 | 148,60 | 153,60 | 146,15 | 157,70 |
| 14 | 30 | 191,16 | 190,70 | 182,20 | 201,00 | 187,20 | 195,40 | 184,10 | 199,00 |
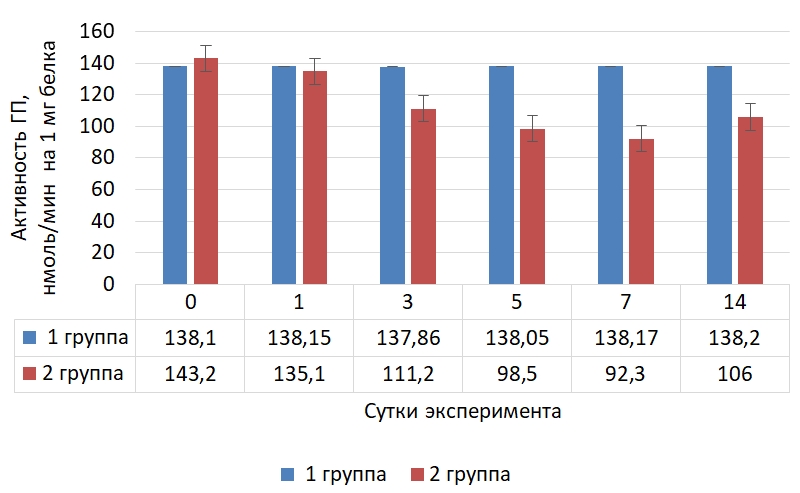
Рис. 5 – Динамика активности глутатионпероксидазы в скелетной мышечной ткани крыс в норме и при криодеструкции миокарда правого предсердия
В скелетной мышечной ткани, как и в выше изученных тканях, активность глутатионпероксидазы интенсивно снижалась до седьмых суток опыта и была ниже на 35,5 % по сравнению с исходным значением, а к концу эксперимента – возросла, но была ниже на 25,9 % начального значения.
Распределение значений активности глутатионпероксидазы в скелетной мышечной ткани животных с экспериментальным оксидативным стрессом представлено в таблице 5.
Таблица 5 – Распределение значений активности ГП в скелетной мышечной ткани крыс на фоне криодеструкции предсердий
| Сутки | N | M | Mе | Min | Max | 25 Per | 75 Per | 10 Per | 90 Per |
| 0 | 30 | 143,42 | 143,20 | 138,10 | 147,90 | 140,90 | 146,10 | 139,80 | 147,30 |
| 1 | 30 | 135,91 | 135,10 | 130,50 | 143,40 | 132,80 | 138,60 | 131,40 | 142,20 |
| 3 | 30 | 111,25 | 111,20 | 106,20 | 117,50 | 108,90 | 112,80 | 107,15 | 116,50 |
| 5 | 30 | 98,81 | 98,50 | 94,50 | 103,90 | 97,00 | 100,70 | 95,55 | 102,75 |
| 7 | 30 | 91,99 | 92,30 | 87,20 | 96,60 | 90,60 | 93,20 | 88,45 | 95,15 |
| 14 | 30 | 106,59 | 106,00 | 101,60 | 112,30 | 104,20 | 109,20 | 102,65 | 111,20 |
Динамика глутатионпероксидазы в скелетной мышечной ткани на фоне криодеструкции предсердий соответствует таковой в выше изученных тканях.
ОбсуждениеПовреждение кардиомиоцитов правого предсердия в результате криодеструкции индуцирует воспалительный процесс и оксидативный стресс, что подтверждается изменениями концентрации и активности ферментов системы перекисного окисления липидов-антиоксидантов в тканях организма. Высокие концентрации ферментов, свидетельствующих об интенсивности свободнорадикальных процессов и низкие концентрации ферментов антиоксидантной защиты коррелируют с возникшей миокардиальной дисфункцией, тяжестью состояния и известными неблагоприятными прогностическими маркерами [10]. На клеточном уровне оксидативный стресс приводит к развитию и прогрессированию неадекватного ремоделирования миокарда и сердечной недостаточности. Интенсивная выработка свободных радикалов провоцирует выход в цитозоль цитохрома С и других биологически активных веществ за счет открытия пор во внешней мембране митохондрий, что, в конечном итоге, приводит к апоптозу. Все эти процессы являются причиной снижения толерантности к физической нагрузке и мышечной слабости у подопытных животных на фоне возникшей сердечной недостаточности, снижается сократительная функция кардиомиоцитов отчасти вследствие нарушения циркуляции кальция и изменения реакции миофиламентов на кальций [11]. Соответственно, несмотря на то что основной очаг воспаления и нарушенного окислительного гомеостаза находится в тканях сердца, данное состояние сказывается на всех тканях организма и проведенное нами исследование по изучению активности одного из маркеров оксидативного стресса – глутатионпероксидазы, показывает взаимосвязь антиоксидантного звена окислительного гомеостаза в тканях организма с патологическими процессами в тканях сердца.
ВыводАктивность глутатионпероксидазы в сыворотке крови, тканях печени, тканях мозга, тканях сердца и скелетной мышечной ткани крыс, при криодеструкции предсердий и индуцировании оксидативного стресса снижается по сравнению с интактными животными в течение первых 7 суток после повреждающего воздействия на 31,7 %, 29,5 %, 31,2 %, 44,3 % и 35,5 % соответственно. Но к концу эксперимента, за счет адаптационных процессов установлена тенденция к нормализации уровня глутатиопероксидазы и ее активность начинает возрастать в изучаемых тканях, но, по прежнему, регистрируются значения ниже, чем у интактных крыс – в сыворотке крови ниже на 18,4 %, в тканях печени – ниже на 12,5 %, в тканях мозга – ниже на 14,7 %, в тканях сердца – ниже на 29,9 % и скелетной мышечной ткани – ниже на 25,9 % что свидетельствует о глубоких нарушениях окислительного гомеостаза в результате криодеструкции правого предсердия.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Paulus W.J. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation / Paulus W.J., Tschöpe C. // J Am Coll Cardiol. – 2013; – 62(4): – 263-271. DOI: 10.1016/j.jacc.2013.02.092
- Hummel S.L. Low-sodium dietary approaches to stop hypertension diet reduces blood pressure, arterial stiffness, and oxidative stress in hypertensive heart failure with preserved ejection fraction / S.L. Hummel, E.M. Seymour, R.D. Brook et al. // Hypertension. – 2012; – 60(5): – 1200-1206. DOI: 10.1161/ HYPERTENSIONAHA.112.202705.
- Andrews D. T. L-arginine cardioplegia reduces oxidative stress and preserves diastolic function in patients with low ejection fraction undergoing coronary artery surgery / D. T. Andrews, J. Sutherland, P. Dawson et al. // Anaesth. Intens. Care. – 2012. – Vol. 40, № 1. – P. 99–106.
- Cavalca V. Oxidative stress and nitric oxide pathway in adult patients who are candidates for cardiac surgery: patterns and differences / V. Cavalca, E. Tremoli, B. Porro et al. // Interact. Cardio-Vasc. Thorac. Surgery. – 2013. – Vol. 17, № 6. – 923–930
- Lakshmi S.V. Oxidative stress in cardiovascular disease / S.V. Lakshmi, G. Padmaja, P. Kuppusamy et al. // Indian J Biochem Biophys. – 2009; – 46(6): – 421-40.
- Elahi M.M. Oxidative stress as a mediator of cardiovascular disease / M.M. Elahi, Y.X. Kong, B.M. Matata // Oxid Med Cell Longev. – 2009; – 2(5): – 259-69.
- Hirooka Y. Oxidative stress and central cardiovascular regulation / Y. Hirooka, Y. Sagara, T. Kishi et al. // Circ J. – 2010; – 74(5): – 827-35.
- Мальцев, Г.Ю. Методы определения содержания глютатиона и активности глутатионпероксидазы в эритроцитах / Г.Ю. Мальцев, Н.В. Тышко // Гигиена и санитария. – 2002. – № 2. – С. 69–72.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / под общ. ред. Р.У. Хабриева.- 2-изд., перераб. и доп.- М.: Медицина, 2005. – 832 с.
- Lankin V.Z. Atherosclerosis as a free radical pathology and antioxidative therapy of this disease / V.Z. Lankin, K. Tikhaze // In: Tomasi A, Özben T, Skulachev VP, editors. Free Radicals, Nitric Oxide, and Inflammation: Molecular, Biochemical, and Clinical Aspects. Vol. 344. IOS Press; Amsterdam: 2003. pp. 218–231. (NATO Science Series).
- Takano H. Implication of cardiac remodeling in heart failure: mechanisms and therapeutic strategies. / H Takano, H Hasegawa, T Nagai, et al. // Intern Med. – 2003; 42: 465–9.
Список литературы на английском языке / References in English
- Paulus W.J. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation / Paulus W.J., Tschöpe C. // J Am Coll Cardiol. – 2013; – 62(4): – 263-271. DOI: 10.1016/j.jacc.2013.02.092
- Hummel S.L. Low-sodium dietary approaches to stop hypertension diet reduces blood pressure, arterial stiffness, and oxidative stress in hypertensive heart failure with preserved ejection fraction / S.L. Hummel, E.M. Seymour, R.D. Brook et al. // Hypertension. – 2012; – 60(5): – 1200-1206. DOI: 10.1161/ HYPERTENSIONAHA.112.202705.
- Andrews D. T. L-arginine cardioplegia reduces oxidative stress and preserves diastolic function in patients with low ejection fraction undergoing coronary artery surgery / D. T. Andrews, J. Sutherland, P. Dawson et al. // Anaesth. Intens. Care. – 2012. – Vol. 40, № 1. – P. 99–106.
- Cavalca V. Oxidative stress and nitric oxide pathway in adult patients who are candidates for cardiac surgery: patterns and differences / V. Cavalca, E. Tremoli, B. Porro et al. // Interact. Cardio-Vasc. Thorac. Surgery. – 2013. – Vol. 17, № 6. – 923–930
- Lakshmi S.V. Oxidative stress in cardiovascular disease / S.V. Lakshmi, G. Padmaja, P. Kuppusamy et al. // Indian J Biochem Biophys. – 2009; – 46(6): – 421-40.
- Elahi M.M. Oxidative stress as a mediator of cardiovascular disease / M.M. Elahi, Y.X. Kong, B.M. Matata // Oxid Med Cell Longev. – 2009; – 2(5): – 259-69.
- Hirooka Y. Oxidative stress and central cardiovascular regulation / Y. Hirooka, Y. Sagara, T. Kishi et al. // Circ J. – 2010; – 74(5): – 827-35.
- Mal'cev, G.Ju. Metody opredelenija soderzhanija gljutationa i aktivnosti glutationperoksidazy v jeritrocitah [Methods of determination of glutathione content and glutathione peroxidase activity in erythrocytes] / G.Ju. Mal'cev, N.V. Tyshko // Gigiena i sanitarija [Hygiene and Sanitation]. – 2002. – № 2. – P. 69–72. [in Russian]
- Rukovodstvo po jeksperimental'nomu (doklinicheskomu) izucheniju novyh farmakologicheskih veshhestv [Guidelines for experimental (preclinical) study of new pharmacological substances]. - M.: Medicina. – 2005. – P. 832. [in Russian]
- Lankin V.Z. Atherosclerosis as a free radical pathology and antioxidative therapy of this disease / V.Z. Lankin, K. Tikhaze // In: Tomasi A, Özben T, Skulachev VP, editors. Free Radicals, Nitric Oxide, and Inflammation: Molecular, Biochemical, and Clinical Aspects. Vol. 344. IOS Press; Amsterdam: 2003. pp. 218–231. (NATO Science Series).
- Takano H. Implication of cardiac remodeling in heart failure: mechanisms and therapeutic strategies. / H Takano, H Hasegawa, T Nagai, et al. // Intern Med. – 2003; 42: 465–9.