РАЗЛИЧИЕ В АКТИВАЦИИ КСАНТИНОКСИДАЗЫ МОЛОКА И ПЕЧЕНИ ЭКЗОГЕННЫМ МОЛИБДЕНОМ
Мухамеджанова А.С.1, Кулатаева М.2, Шалахметова Г.А.3, Аликулов З.4
1ORCID: 0000-0003-3238-1269, докторант 1 курса по специальности 6D070600 «Биология», Евразийский национальный университет им. Л.Н.Гумилева, Астана, 2ORCID: 0000-0002-0611-3386, магистр технических наук, Евразийский национальный университет им. Л.Н.Гумилева, Астана, 3кандидат биологических наук, доцент кафедры молекулярной биологии и генетики, Казахский национальный университет им. Аль-Фараби, Алматы, 4ORCID: 0000-0002-0990-8918, кандидат биологических наук, профессор кафедры биотехнологии и микробиологии Евразийский национальный университет им. Л.Н.Гумилева, Астана
Работа была выполнена в рамках проекта №1253/ГФ4: «Изучение стимуляции ксантиноксидазы для превращения токсичных нитратов и нитритов в полезный оксид азота в парном молоке верблюда, кобылы и козы»
РАЗЛИЧИЕ В АКТИВАЦИИ КСАНТИНОКСИДАЗЫ МОЛОКА И ПЕЧЕНИ ЭКЗОГЕННЫМ МОЛИБДЕНОМ
Аннотация
В молоке и экстрактах печени, полученных из четырех девяти- и десятилетних кобыл, были определены нитратредуктазная (НаР), нитритредуктазная (НиР) и собственная активность ксантиноксидазы (КО). Эти активности КО в экстракте печени проявляются без какой-либо обработки. В то же время высокие активности КО молока обнаруживаются только после термообработки при 80оС в присутствии экзогенных цистеина и молибдата. Таким образом, в отличие от печени животного в молоке кобылы синтезируется безмолибденовые молекулы КО. В случае загрязнения молока нитратами и нитритами, активация молекул КО молибденом может иметь практическое значение в их обезвреживании и превращении их в полезный монооксид азота.
Ключевые слова: молоко, печень, ксантиноксидаза, нитраты, нитриты, монооксид азота, молибден, цистеин.
Mukhamedzhanova A.S.1, Kulataeva M.2, Shalakhmetova G.A.3, Alikulov Z.4
1ORCID: 0000-0003-3238-1269, PhD student of the 1st course in the specialty 6D070600 “Biology,” Eurasian National University named after L.N.Gumilyov, Astana, 2ORCID: 0000-0002-0611-3386 Master of Engineering, Eurasian National University named after L.N.Gumilyov, Astana, 3PhD in Biology, Associate Professor of the Department of Molecular Biology and Genetics, Kazakh National University named after Al-Farabi, Almaty, 4ORCID: 0000-0002-0990-8918, PhD in Biology, Professor of the Department of Biotechnology and Microbiology, Eurasian National University named after L.N.Gumilyov, Astana
The work was carried out within the framework of project No.1253/GF4: “Study of the Stimulation of Xanthine Oxidase for the Conversion of Toxic Nitrates and Nitrites to Useful Nitric Oxide in the Fresh Milk of a Camel, Mare and Goat.”
DIFFERENCE IN ACTIVATION OF XANTINOXIDASE OF MILK AND LIVER WITH EXOGENOUS MOLYBDENUM
Abstract
Milk and liver extracts obtained from four nine- and ten-year-old mares contain nitrate reductase (NaR), nitrite reductase (NiR) and intrinsic activity of xanthine oxidase (XO). These XO activities in the liver extract are manifested without any treatment. At the same time, high activity of milk CO is detected only after the heat treatment at 80oC in the presence of exogenous cysteine and molybdenum. Thus, unlike in the animal’s liver, non-molybdenum molecules of CO are synthesized in mare's milk. In case of milk contamination with nitrates and nitrites, the activation of CO molecules by molybdenum can be of practical importance in neutralizing them and converting them into useful nitrogen monoxide.
Keywords: milk, liver, xanthine oxidase, nitrates, nitrites, nitrogen monoxide, molybdenum, cysteine.
Ксантиноксидаза (КО) участвует в катаболизме пуринов, катализируя превращение гипоксантина в ксантин, а затем в мочевую кислоту. КО присутствуют практически во всех тканях (органах) животного организма. Наивысшей удельной активностью обладают ферменты присутствующие в печени и в молоке животного. Практически вся мочевая кислота в организме образуется именно в печени. Молекулярная масса фермента составляет около 300 кД. Фермент имеет гомодимерную молекулярную структуру. В состав фермента входит кофермент – ФАД, ковалентно связанный с его белковой частью. На каждый мономер приходится одна молекула ФАД. Белковая часть фермента богата цистеином и содержит 60–62 свободные сульфгидрильные (-SH) группы. В структуре КО имеются также железосерные центры, которые представляют собой 2Fe-2S-комплекс [1, С. 546]. В состав активного фермента входит молибден, который находится в виде так называемого молибденового кофактора — он связан двумя S-связями с боковой цепью птерина молекулы кофактора [1, С. 548], [7, С. 532]. Два атома молибдена (Мо) участвуют в переносе электронов в активном центре КО, т.е. активность КО прямо зависит от содержания Мо в молекуле фермента.
В 1980 году, нами было обнаружено, что гомогенная КО молока коровы катализирует восстановление неорганических нитратов и нитритов [2, С. 2–3], т.е. ксантиноксидаза восстанавливала нитраты в нитриты (НаР активность). Позднее английские ученые, показали, что конечным продуктом восстановления нитритов (НиР активность) ксантиноксидазой является монооксид азота (NO) [3, С. 226]. NO – газ, имеющий безграничный спектр функций в жизнедеятельности млекопитающих. Он участвует во многих физиологических процессах, таких как ингибирование агрегации тромбоцитов, нейротрансмиссия и цитотоксические механизмы иммунной защиты [3, С. 225], [4, С. 767], [5, С. 15]. Установлено, что NO-синтаза (NOS, ЕС 3.14.13.39) участвует в процессе внутриклеточного образования NO в результате ферментативного превращения L-аргинина в L-цитруллин в присутствии O2 и НАДФН [2, С. 1715], [3, С. 226], [4, С. 770]. Поэтому в настоящее время вызывает особый интерес способность ксантиноксидазы восстанавливать нитраты и нитриты с образованием монооксида азота в организме человека и животных в качестве альтернативы NO-синтазе в анаэробных условиях. Более того, в связи с загрязнением окружающей среды нитратами и нитритами, последние могут попасть в молоко животных посредством питьевой воды. Известно, что нитриты необратимо связываясь с гемоглобином вызывают метгемоглобинемию, а с аминами образуют потенциальные канцерогены – нитрозамины.
В настоящее время ксантиноксидаза в органах лошади недостаточно изучена, а об активностях восстанавливать нитраты и нитриты сведений не найдено. Поэтому, целью настоящей работы была изучение ассоциированных активностей ксантиноксидазы печени (и других внутренних органов) и молока табунных лошадей, основным кормом которых служила трава естественных пастбищ.
Поскольку по понятным причинам одновременное определение активности ксантиноксидазы в молоке и печени одного и того же животного невозможно, активность этого фермента определяли в молоке четырех кобыл 9- и 10-летних возрастов (по две кобылы) казахской породы типа жабе. 100 мл свеженадоенного молока, полученных из различных животных замораживали при -20оС. А для определения активности ксантиноксидазы печени проводили поиск нелактирующих кобыл такого же возраста, заранее запланированных для забоя. Образцы печени массой 100 г немедленно замораживали при температуре -20оС. Перед определением активности КО образцы печени оттаивали, мелконарезанные куски смешивали в соотношении 1:10 с холодным 0.1 М натрий-фосфатным буфером (рН 7.5) соответсвенно, содержащим 10 мкМ ЭДТА и 10 мкМ фенилметилсульфонилфторид («Sigma»). Гомогенат получали тщательным растиранием смеси на фарфоровой ступке. Супернатант получали центрифугированием гомогената печени при 15000 g в течение 20 минут.
Перед термообработкой в молоко добавляли в конечных концентрациях натрий-фосфатный буфер (NaH2PO4/Na2HPO4), pH 7.5 – 100 мМ, ЭДТА – 10 мкМ, молибдат натрия (Na2MoO4) – 2 мМ, цистеин – 2 мМ. А в супернатант печени добавляли такие же концентрации молибдата и цистеина («Sigma»). Затем молоко и супернатант печени прогревали при температуре 80оС в течение 5 минут. После охлаждения для определения ферментативных активностей использовали 100 мкл аликвоты молока и супернатанта печени. КО, НаР и НиР активности определяли согласно разработанному методу [2, С. 21]. Определение ассоциированных активностей КО молока и печени проводили несколько раз в трех повторностях.
Определение ассоциированных активностей ксантиноксидазы в образцах печени и молока без предварительной обработки показало, что экстракт образцов печени, полученных из кобыл разных возрастов, имел все ассоциированные активности (КО, НаР и НиР) с соответсвующими субстратами без какой-либо предварительной обработки (табл. 1). В то же время, в молоке, полученных из кобыл такого же возраста активности ксантиноксидазы не обнаруживаются. Хотя образцы печени и молока были получены не из одного и того же животного, полученные нами результаты позволяют предположить о том, что печень кобыл содержат нормальную активность ксантиноксидазы, а в их молоке ксантиноксидаза неактивна или вообще не синтезируется (табл. 1). Во всех 12 образцах молока кобыл, собранных 3 раза в месяц , не были обнаружены ассоциированные активности ксантиноксидазы.
Таблица 1 – Ассоциированные активности ксантиноксидазы в необработанном молоке и в экстракте печени кобылей
| № животных | Вид ткани | Ассоциированные активности | ||
| *КО | **НаР | **НиР | ||
| №1 | Печень | 12.3±1.4 | 29.7± 3.6 | 47.6± 5.9 |
| Молоко | ~ 0.02 | ~1.4 | ~1.3 | |
| №2 | Печень | 12.5±2.5 | 31.7± 4.2 | 49.7± 6.8 |
| Молоко | ~ 0.02 | ~1.3 | ~1.3 | |
| №3 | Печень | 13.2±1.8 | 30.9± 4.3 | 48.7± 7.2 |
| Молоко | ~ 0.02 | ~1.3 | ~1.3 | |
| №4 | Печень | 12.3±2.3 | 31.2± 4.2 | 46.8± 6.7 |
| Молоко | ~ 0.02 | ~1.3 | ~1.3 | |
Ранее нами было установлено, что после термообработки экстракта зародыша зерна пшеницы при 80оС в течение 5-7 мин в присутствии 2.0 мМ цистеина и экзогенного молибдата активность ксантиноксидазы повышалась почти в два раза [6, С. 1]. Это указывало на содержание в зародыше зерна безмолибденовой популяции молекул этого фермента. Поэтому, мы не исключали существование безмолибденовых форм ксантиноксидазы в молоке кобыл. Первые же эксперименты по термообработке молока кобыл при 80оС использованием тех же концентрации цистеина и молибдата (оптимальные концентрации) показали, что такая обработка приводит к появлению высокой активности ксантиноксидазы (табл. 2).
Таблица 2 – Ассоциированные активности ксантиноксидазы в молоке и в экстракте печени кобылей после термообработки (80оС) в присутствии цистеина и молибдата
| № животных | Вид ткани | Ассоциированные активности | ||
| КО | НаР | НиР | ||
| №1 | Печень | 12.2±1.8 | 27.5± 4.2 | 43.4±6.1 |
| Молоко | 13.0±2.3 | 29.5±3.5 | 47.3±5.2 | |
| №2 | Печень | 11.9±2.1 | 27.2± 4.2 | 45.7± 6.8 |
| Молоко | 13.5±2.5 | 28.9±3.8 | 48.2±5.8 | |
| №3 | Печень | 11.6±2.3 | 27.9± 4.3 | 45.7± 7.2 |
| Молоко | 13.7±1.7 | 29.3±5.2 | 47.2±5.3 | |
| №4 | Печень | 12.3±2.3 | 26.5± 4.2 | 43.2± 6.7 |
| Молоко | 13.7±1.8 | 28.7±3.8 | 45.6±5.7 | |
В результате полученных результатов возник вопрос о том, только ли в печени синтезируется КО в молибденсодержащей активной форме. Поэтому в экстрактах некоторых внутренних органов животных также определяли ассоциированные активности КО до и после термообработки молока (при 80оС в присутствии цистеина и молибдата). Ассоциированные активности КО, в экстрактах внутренних органов одной из кобыл представлены в табл. 3.
Таблица 3 –Ассоциированные активности КО в экстрактах внутренних органов свежезарезанной кобыльи до и после их термообработки
| Экстракты органов | Обработка молока | Ассоциированные активности КО | ||
| КО | НаР | НиР | ||
| Почки | Контроль | 1.3±0.2 | 5.9± 1.2 | 7.3± 1.2 |
| Термообработка | 1.5±0.3 | 6.1± 1.3 | 7.6± 0.8 | |
| Сердце | Контроль | 1.1±0.3 | 5.2± 0.7 | 6.2± 0.7 |
| Термообработка | 1.2±0.2 | 5.3±0.4 | 6.1± 1.2 | |
| Мышцы | Контроль | 0.9±0.2 | 4.8±0.8 | 5.1± 0.6 |
| Термообработка | 1.0±0.2 | 4.8± 0.4 | 5.0±0.4 | |
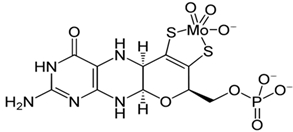
Как видно из таблицы 3, в экстрактах почек, сердца и мышц без термообработки обнаруживается все ассоциированные активности КО, и они не повышались после термообработки в присутствии цистеина и молибдата. Таким образом, в печени и других внутренних органах кобыл синтезируется нормальная активная молибденсодержащая КО. В то же время в молоке синтезируется безмолибденовая КО и для ее активации абсолютно требуется термообработка при 80оС в присутствии цистеина и молибдата. Механизм такой активации можно обьяснить следующим образом. При высокой температуре молекула фермента частично денатурируется и в результате активный центр оказывается доступным для экзогенных молибдена и цистеина. Одним из основных компонентов активного центра КО является молибдокофактор [7, С. 193], [8, С. 165]. В активном центре фермента атом молибдена связывается с двумя сульфгидрильными группами кофактора, образуя –S-Mo-S- связи (рис. 1).
Рис. 1 – Структура молибдокофактора и его связь с атомом молибдена в активном центре ксантиноксидазы
Так, при частичной денатурации фермента термообработкой сульфгидрильные группы кофактора становятся доступными для кислорода и могут окисляться, образуя внутримолекулярный дитиол. Две молекулы цистеина, образуя временные дисульфидные связи с этими сульфгидрильными группами, защищает молибдокофактора от окисления до их связывания с экзогенным атомом молибдена [9, С. 115]. Таким образом, впервые было установлено, что в разных тканях одного и того же вида животного синтезируются Мо-содержащая активная и совершенно неактивная безмолибденовая ксантиноксидаза. In vivo активация молекул КО молока экзогенным молибденом может иметь практическое значение в обезвреживании молока от нитратов и нитритов в случае его загрязнения с этими соединениями, превращая их в полезный монооксид азота [10, С. 352].
Список литературы / References
- Roger Harrison. Milk xanthine oxidase: Properties and physiological roles. // International Dairy Journal. – 2006. – 546–554 p.
- 2. Alikulov Z. Nitrate and nitrite reductase activity of milk xanthine oxidase. / Alikulov Z., L'vov N., Kretovich, V. // Biokhimiia – 1980. – 1714–1718 p.
- Millar T. Xanthine oxidoreductase catalyzes the reduction of nitrates and nitrite to nitric oxide under hypoxic conditions. / Millar T., Stevens C., Benjamin N., Eisenthal R., Harrison R., Blake D. // FEBS Letters. – 1998. – 225–228 p.
- Zhang Z. Generation of nitric oxide by a nitrite reductase activity of xanthine oxidase: a potential pathway for nitric oxide formation in the absence of nitric oxide synthase activity. / Zhang Z., Nauthon D., Winyard P.G., Benjamin N. // Bioch.Biophys.Res.Comm. – 1998. – 767–772 p.
- Bryan N. Discovery of the nitric oxide signaling pathway and targets for drug development. / Bryan N., Bian K., Murad F. // Frontiers in Bioscience. – 2009. – 1–18 р.
- 6. Alikulov Z. The method of xanthineoxidase obtaining. / Alikulov Z. , Bespaev B., Yakupbaev K. // Author's certificate № 1693047 from 22 /07/1999.
- Schwarz G. Molybdenum cofactor biosynthesis and deficiency.// Cell. Mol. Life Sci.– 2005. – № 62 (23): 2792–810 p.
- Mendel Ralf R. The Molybdenum Cofactor. // J Biol. Chem. – 2013. – № 288(19): 2792–165–172 р.
- Santamaria-Araujo J. Structure and stability of the molybdenum cofactor intermediate cyclic pyranopterin monophosphate. / Santamaria-Araujo J.,Wray V.,Schwarz G. // J Biol Inorg Chem. – 2012. – Jan;17(1):113-122 p.
- Lu P. Nitrite-derived nitric oxide by xanthine oxidoreductase protects the liver against ischemia-reperfusion injury. / Lu P., Liu F., Yao Z., Wang C.Y., Chen D.D., Tian Y., Zhang J.H., Wu Y.H. // Hepatobiliary Pancreat Dis. Int. – 2005. –350–355 р.