Биораспределение микровезикул из лошадиных аллогенных мезенхимных стволовых клеток при внутрисуставном введении
Биораспределение микровезикул из лошадиных аллогенных мезенхимных стволовых клеток при внутрисуставном введении
Аннотация
Остеоартроз (ОА) — хроническое заболевание суставов, сопровождающееся воспалением и постепенным разрушением суставного хряща. В ветеринарной практике накоплен значительный клинический опыт применения методов регенеративной медицины при ОА. В основном этот вид терапии связан с использованием мезенхимных стволовых клеток (МСК). Однако внедрение МСК имеет ряд ограничений, в основном из-за стандартизации, контроля качества и коммерциализации. В настоящее время исследования показывают, что основной терапевтический эффект МСК реализуется за счет внеклеточных везикул (ВВ) — наноразмерных частиц, обладающих противовоспалительным, иммунорегуляторным и регенеративным действием. Целью этого исследования было изучение биораспределения ВВ после внутрисуставного введения при ОА. Исследования показали, что после инъекции ВВ в полость сустава (как при моделировании ОА, так и в здоровом суставе) везикулы сохранялись внутри в течение длительного времени. Электронная микроскопия показала, что ВВ адгезируются на поверхности мениска. Полученные данные открывают новые возможности для развития эффективных и стандартизированных биопрепаратов на основе ВВ для ветеринарии и, потенциально, для медицины.
1. Введение
Регенеративная медицина — перспективное направление современной медицины, ориентированное на разработку технологий восстановления и замещения поврежденных клеток, тканей и органов. Важнейшей стратегией этого направления выступает клеточная терапия, основанная на применении стволовых клеток. Основным объектом клеточной терапии являются мезенхимные стволовые клетки (МСК), что обусловлено их противовоспалительным, иммуномодулирующим и регенеративным потенциалом. В ветеринарной практике накоплен значительный клинический опыт применения МСК, подтверждающий эффективность этого подхода , . Однако перспективы их широкого клинического использования ограничены сложностями стандартизации и коммерциализации .
В ветеринарной практике клеточная терапия нашла широкое применение, особенно при лечении патологий опорно-двигательного аппарата . Стволовые клетки также демонстрируют значительный терапевтический потенциал в восстановлении поврежденных тканей у животных-компаньонов , .
Многочисленные исследования демонстрируют, что терапевтический эффект МСК в значительной степени опосредован внеклеточными везикулами (ВВ). Эти наноразмерные частицы обладают сходным с МСК противовоспалительным, иммунорегуляторным и регенеративным действием, а в некоторых случаях превосходят по эффективности клетки-продуценты .
Внеклеточные везикулы (ВВ) — это наноразмерные липидные двухслойные структуры, секретируемые практически всеми типами клеток. Их размер варьируется от 30 нм до нескольких микрометров. ВВ обычно классифицируют по размеру на три группы: апоптотические тельца имеют диаметр 800–5000 нм, микровезикулы — от 50 до 1000 нм, а нановезикулы (включая экзосомы) — от 40 до 150 нм . ВВ способны транспортировать биологически активные молекулы, включая белки, липиды, РНК и ДНК, и играют ключевую роль в различных физиологических и патологических процессах. Благодаря своей природной способности переносить биологические молекулы, внеклеточные везикулы рассматриваются как перспективные терапевтические агенты и система доставки лекарственных средств. Использование бесклеточной терапии на основе ВВ считается перспективным подходом для стимуляции регенерации тканей . ВВ преодолевают ключевые ограничения клеточной терапии, обладая такими преимуществами, как стабильность, низкая иммуногенность и гибкость дозирования (возможность применения в широком диапазоне терапевтических доз) , . Исследования ВВ в ветеринарии все еще находятся на ранних этапах становления, хотя в последние годы было опубликовано несколько статей , .
Перед клиническим применением ВВ в качестве носителей для доставки лекарств и терапевтических агентов необходимо тщательно изучить их биораспределение и фармакокинетику . Однако мониторинг биораспределения экзогенно введенных ВВ in vivo остается сложной задачей из-за их естественного происхождения, малого размера и короткого периода полувыведения . Для отслеживания ВВ in vivo используются различные методы, включая маркировку липофильными флуоресцентными красителями или радиоизотопами, а также генетическую инженерию для экспрессии люминесцентных белков .
Цель настоящего исследования изучение биораспределения ВВ, полученных при помощи цитохалазина Б при внутрисуставном введении.
2. Методы и принципы исследования
2.1. Одобрение этического комитета
Данное исследование было одобрено Экспертным комитетом по биомедицинской этике Казанского федерального университета (Протокол 3, дата 5 мая 2015 г.) в соответствии как с институциональными, так и с международными этическими рекомендациями ARRIVE.
2.2. Выделение МСК лошади
МСК были получены из жировой ткани лошади. Жировая ткань была предоставлена ветеринарной службой Казанского ипподрома. Полученные образцы в стерильных условиях очищали от соединительной ткани, промывали фосфатным буферизованным физиологическим раствором (PBS, Панэко, Россия) и измельчали при помощи ножниц. Измельченную ткань инкубировали 1ч с 0,2% коллагеназой краба (Панэко, Россия) в шейкере-инкубаторе. Далее клетки осаждали при помощи центрифуги в течение 10 мин при 800 g, супернатант сливали, осадок ресуспендировали в 0,9% физиологическом растворе (Панэко, Россия). Отмытый осадок клеток повторно суспендировали в среде для выращивания, состоящей из DMEM-Glutamax I (high glucose, Панэко, Россия) с добавлением 10% сыворотки плодов коров (FВS, Панэко, Россия) и 1% пенициллина-стрептомицина (Панэко, Россия), и высевали на фласки. Через 24 ч прикрепившиеся клетки промывали физиологическим раствором и полученную культуру клеток поддерживали в ростовой среде (10%FBS, DMEM: F12, L- глутамин, антибиотики) в увлажненной атмосфере 95% О2 и 5% CO2. Смену среды проводили через 3дня.
2.3. Проточная цитометрия выделенных клеток
Принадлежность клеток к клеточному пулу стволовых клеток определяли окрашивая методами иммуноцитохимии на мембранные маркеры клеток мезенхимного происхождения. Для этого применяли антитела: CD 44 (Biolegend, clone IM7, USA), CD 90 (Sony Biotechnology, cat № 1612630, USA). В качестве отрицательного контроля окрашивали антителами к CD 34 (ICO115) (Santa Cruz, sc-7324, USA), CD 45 (BioLegend, cat №202205, USA). Окрашивание клеток проводили согласно инструкции фирм-производителей. Анализ результатов производили при помощи проточного цитофлюориметра Guava EasyCyte 8HT (Millipore, USA). Результат проточной цитометрии выражен в % от общего числа клеток в образце (не менее 100 тыс. клеток на 1 аликвоту).
Также для подтверждения биологической активности выделенных клеток проводили дифференцировку в 3 направлениях (остеогенном, хондрогенном, адипогенном) по методике, описанной ранее .
Фиксировали результаты дифференциации с помощью инвертированного микроскопа AxioObserver Z1 (Carl Zeiss, Германия).
2.4. Получение МВ из МСК лошади
Получение микровезикул (МВ) из культуры клеток МСК лошади осуществляли по методике, опубликованной ранее . При достижении культурой клеток плотности монослоя 90%, отбирали питательную среду, дважды промывали культуру от остатков среды с помощью PBS. Клетки открепляли с культурального пластика при помощи 0,25% раствора трипсина-ЭДТА (ПанЭко, Россия), затем отмывали клетки PBS. Полученную суспензию инкубировали в DMEM без сыворотки крови, содержащей 10 μг/мл цитохалазина B (Sigma-Aldrich, США) в течение 30 мин при 37°С во влажной атмосфере, содержащей 5% CO2. Далее осуществляли серию последовательных центрифугирований: 500 об/мин 10 мин, супернатант отбирали и центрифугировали 500 об/мин 20 минут, супернатант отбирали и центрифугировали 3000 об/мин 25 минут. Осадок, содержащий МВ, отмывали большим количеством PBS, центрифугируют при 3000 об/мин 25 минут. Полученный осадок МВ использовали далее в работе.
2.5. Исследование биораспределения МВ МСК лошади на мышах
Для оценки миграционного потенциала МВ из МСК лошади окрашивали витальным красителем Dil (Lumiprobe, Россия). Для этого МСК лошади окрашивали красителем Dil и получали из них МВ. МВ вводили внутрь коленного сустава мышей под общей анестезией. Доза МВ была эквивалентна 500 тыс МСК, из которых они были получены. Биораспределение оценивали при помощи прибора IVIS Spectrum Perkin Elmer (США) на 3, 7, 14 21 сутки после их введения.
2.6. Исследование биораспределения МВ МСК лошади при моделировании остеоартроза на крысах
ОА была воспроизведена на крысах самцах линии Вистар массой 300-350 г. Всех экспериментальных и контрольных животных содержали, кормили в соответствии с установленными Законом стандартами. ОА воспроизводили хирургическим путем. Операцию проводили под общей анестезией. Для этого использовали Золетил 100 (Virbac, Франция) и Ксилазина (Nitr-Pharm, Россия). Для обезболивания использовали Мелоксидин (Промветсервис, Беларусь). ОА вызывали путем рассечения медиальной коллатеральной связки. Для этого медиальный мениск захватывали кровоостанавливающим зажимом и отрезали проксимально по направлению к бедренной кости. Мениск рассекали скальпелем или маленькими хирургическими ножницами. Кожа ушивалась шелковыми нитками 4-0.
Для оценки миграционного потенциала МВ вводились внутрисуставно через 24 часа после проведения операции. Для визуализации их окрашивали при помощи витального красителя Dil (Lumiprobe, Россия). Биораспределение оценивали при помощи прибора IVIS Spectrum Perkin Elmer на 1, 3, 7, 14 день после их введения. Доза МВ была эквивалентна 1млн МСК из которых они были получены.
2.7. Визуализация МВ при помощи электронной микроскопии
Для визуализации МВ использовали сканирующую электронную микроскопию (SEM). Для этого крысам с индуцированным ОА внутрисуставно вводили МВ. Через 3сут изымали поврежденные мениски микроскопировали. Для этого напыляли сплав Au/Pd в соотношении 80/20. При проведении количественного и качественного анализа Au/Pd были исключены. Зафиксированные на держатель образцы помещались в камеру электронного микроскопа, где проводилось зондирование выбранных участков. Исследования проводились на автоэмиссионном сканирующем электронном микроскопе Merlin (Carl Zeiss). Микроскоп оснащен спектрометром энергетической дисперсии AZtec X-Max (Oxford Instruments). Разрешение спектрометра 127 эВ. Съемка морфологии поверхности и элементный анализ проводился при ускоряющем напряжение 20 кэВ и рабочем отрезке 9 мм, что позволяет избежать минимальных погрешностей. Глубина зондирования при проведении элементного анализа составляет менее 1 микрона. Съемка выполнена с BSE-детектором, фазовый контраст.
3. Основные результаты
Клетки, выделенные из жировой ткани лошади, несли на своей поверхности характерные маркеры МСК и не имели маркеры гематопоэтических стволовых клеток: CD34 (0%), СD45 (0%), СD44 (91%) и СD90 (100%). Также полученные клетки дифференцировались в адипо-, хондро- и остеогенном направлении при культивировании в соответствующих дифференцировочных средах результаты показаны на рисунке 1. Проведенные эксперименты показали, что клетки, полученные из жировой ткани лошади являются мезенхимными стволовыми клетками (рис.1). Далее для исследований из этих клеток были получены МВ.
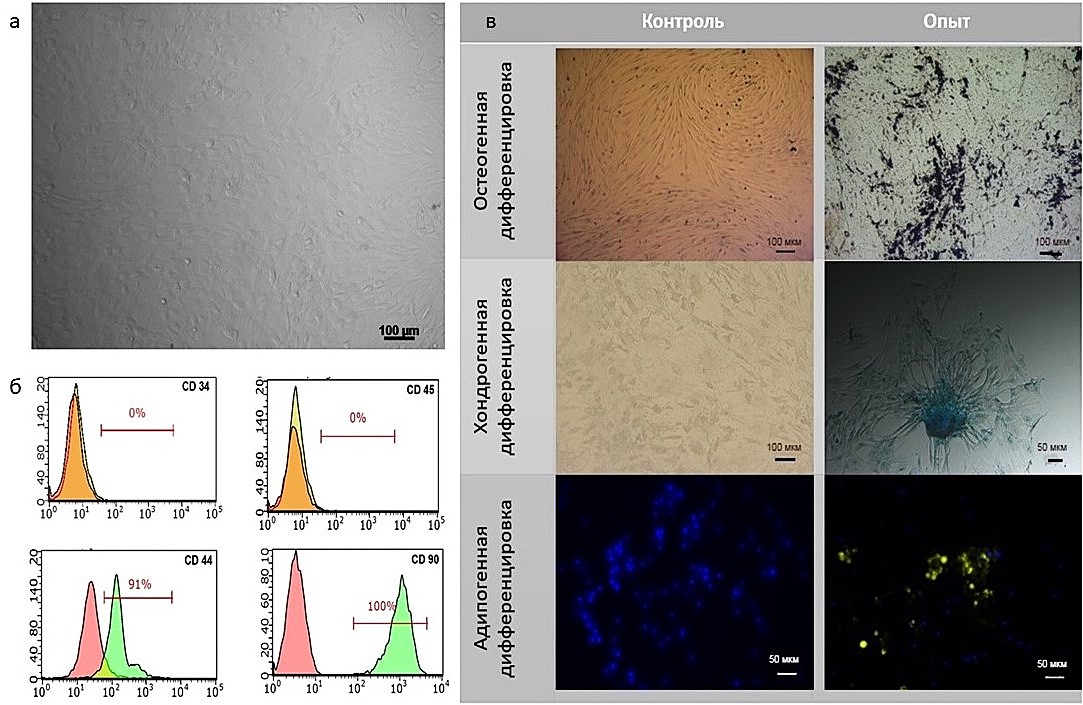
Рисунок 1 - Характеристика стволовых клеток лошади:
а – монослой МСК; б – результат анализа МСК с помощью проточного цитофлюориметра; в – результат дифференцировки МСК
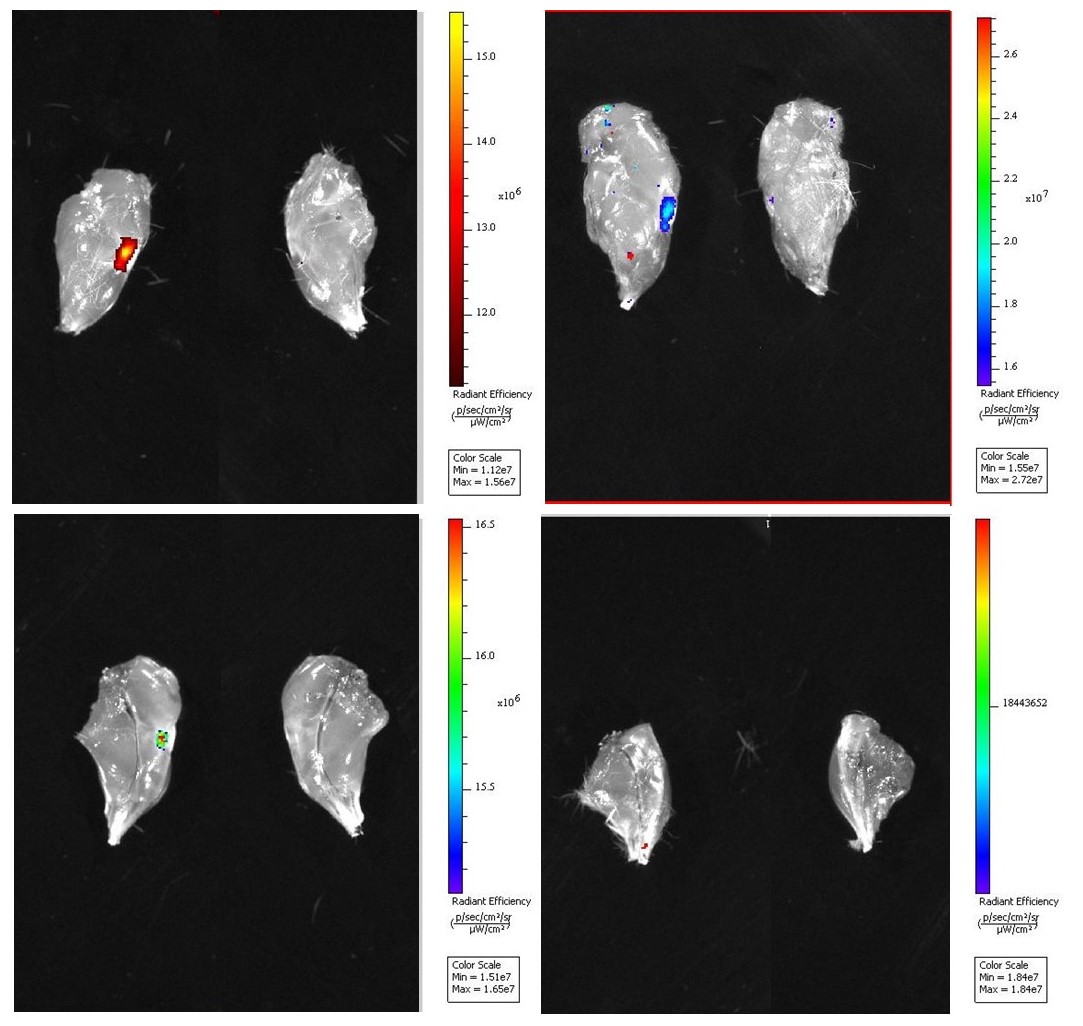
Рисунок 2 - Оценка биораспределения на мышах при внутрисуставном введении:
а – 3 сутки; б – 7 сутки; в – 14 сутки; г – 21 сутки
Примечание: слева – суставная поверхность мениска после введения МВ; справа – контроль
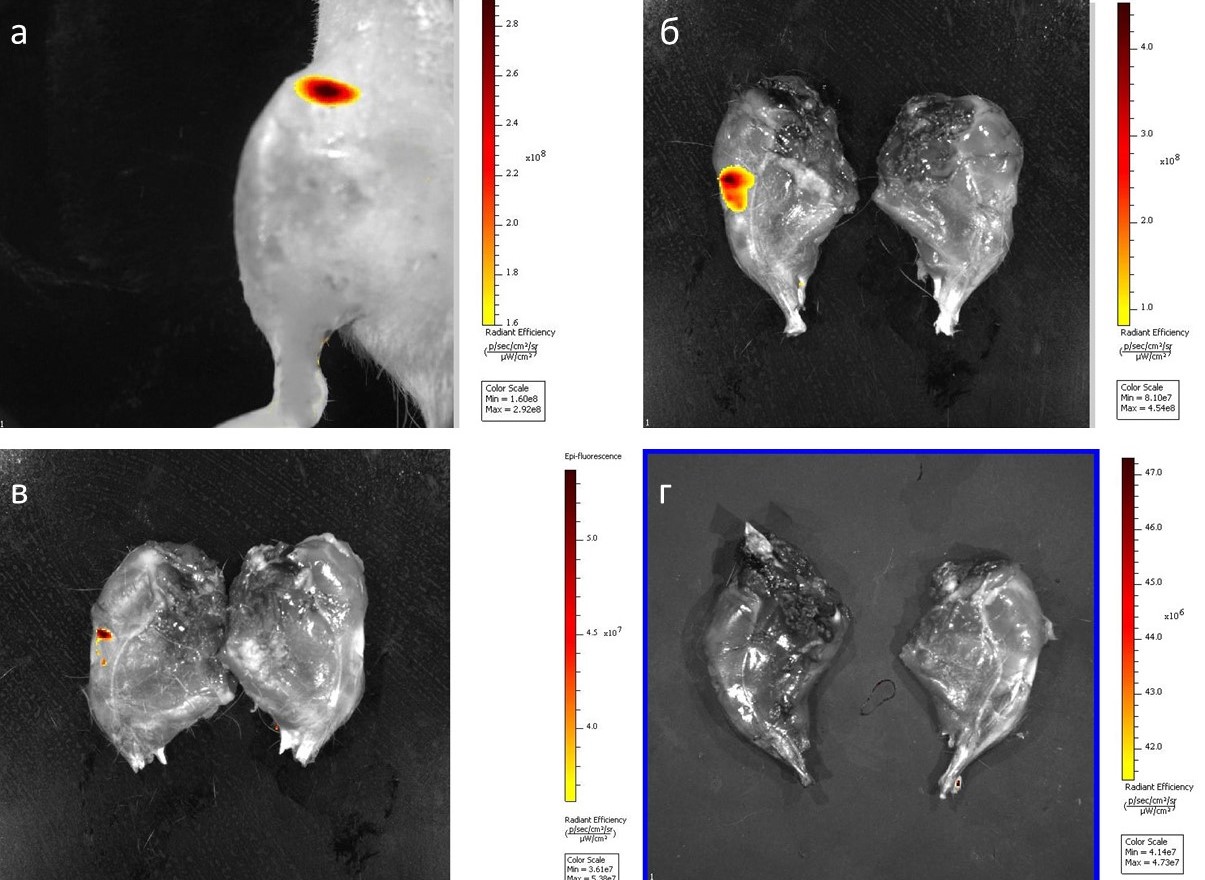
Рисунок 3 - Биораспределение МВ при внутрисуставном введении после моделирования ОА на крысах:
а – флуоресценция на 1-е сутки; б – флуоресценция на 3-и сутки; в – флуоресценция на 7-сутки; г – флуоресценция на 14-е сутки
Примечание: слева – суставная поверхность мениска после введения МВ; справа – контроль

Рисунок 4 - Сканирующая электронная микроскопия поверхности мениска:
а, в – поверхность мениска без внутрисуставного введения МВ; б, г – поверхность мениска после внутрисуставного введения МВ
Примечание: стрелками указаны микровезикулы
4. Обсуждение
Различные доклинические исследования показали, что МВ из МСК являются перспективным источником бесклеточной терапии. Терапевтическая эффективность МВ была показана для многих заболеваний. Также имеются сведения использования их в терапии ОА . Настоящее исследования посвящено изучению биораспределения ВВ в опытах in vivo.
Изучение биораспределения МВ являются важным этапом в доклинических исследованиях. Современные исследования биораспределения МВ in vivo крайне неоднородны и используют самые разные методологии . Для изучения биораспределения мы в своих экспериментах применяли метод окращивания МВ витальными липофильными красителями, которые относятся к классу карбоцианинов. Окрашивание МВ липофильными красителями позволяет получить высокоинтенсивный флуоресцентный сигнал, который был идентифицирован нами при помощи прибора при помощи прибора IVIS Spectrum Perkin Elmer (США). Исследование биораспределения меченых МВ in vivo показало, что интенсивность флуоресценции внутри сустава достигала пика через 24 часа после введения, а затем постепенно снижалась до 21 суток.
Визуализация МВ после введения внутрь сустава проводили при помощи сканирующей электронной микроскопии. Этот метод позволяет показывать расположение МВ и адгезию в тканях. Исследование является важным, так как показывает взаимодействие МВ с тканью мишенью. Наши исследования показали, что МВ через 3 суток адгезировались на поверхности мениска.
Полученные результаты исследований послужат базой для других доклинических и клинических исследований.
5. Заключение
Проведенные эксперименты показали, что МВ после введения адгезируются на хрящнвых поверхностях сустава и располагаются в суставе на протяжении довольно большого срока. Исследования показывают, что МВ могут быть неплохим инструментом для терапии ОА, так как они располагаются в пораженном органе довольно долго и, следовательно, долго могут оказывать действие на ткани.
