Клеточный цикл как критерий оценки биосовместимости фибробластов и скаффолдов в системе in vitro после воздействия УФ-облучения в аспекте создания эквивалента кожи
Клеточный цикл как критерий оценки биосовместимости фибробластов и скаффолдов в системе in vitro после воздействия УФ-облучения в аспекте создания эквивалента кожи
Аннотация
Проведена оценка динамики показателей клеточного цикла фибробластов в системе in vitro методом проточной цитофлуориметрии в экспериментальной модели по оценке биосовместимости фибробластов со скаффолдами в условиях 2D и 3D-культивирования и биологии фибробластов после воздействия УФ-облучения. Выявлено, что для периода двух недель культивирования лучшая биосовместимось клеток наблюдается к скаффолду G-DERM в условиях 2D-культивирования, что может быть связано с физико-химическим составом и пространственным плетением структур данного скаффолда. УФ-облучение в течение 30 сек вызывает остановку клеточного цикла как компенсаторно приспособительная реакция клеток в ответ на повреждающее действие облучения.
1. Введение
По мере накопления знаний о биологии клеток в условиях in vitro, растет и понимание сложности, неоднородности физиологических, биохимических и молекулярно-генетических программ реализации клеточного ответа на действие повреждающих факторов различного генеза [1], [2], [3]. Для оценки клеточной реактивности в условиях отсутствия единых универсальных маркеров, был установлен общий набор признаков, среди которых анализ клеточного цикла является одним из наиболее информативных [4].
Отмечено, что УФ-облучение и разные условия культивирования в системе in vitro влияют на морфофункциональные показатели клеток [5]. Так, в частности, выявлено прямое мутагенное воздействие УФ-облучения на структуру ДНК, на возникновение мутаций туморсупрессорных генов, на увеличение продукции АФК. В то же время УФ-излучение оказывает активирующее действие на синтез клетками кожи факторов роста, пролиферации и т.д. [6], [7]. Известно, что заболевание меланомой кожи находится в прямой зависимости не только от длительности, но и от интенсивности УФ-облучения, даже относительно кратковременное, но высокой интенсивности облучение вызывает мощный канцерогенный эффект [8].
Наряду с внешним воздействием, на биологию клеток в условиях in vitro оказывают влияние разные условия культивирования, к которым можно отнести биосовместимость клеток со скаффолдами. В настоящее время существует большое количество фундаментальных исследований биосовместимости скаффолдов с клетками кожи в аспекте создания эквивалентов поврежденных тканей и органов для регенеративной медицины [9], [10]. Однако поиск оптимальных решений для практического применения все еще ведется. Одним из показателей биосовместимости является анализ клеточного цикла, его динамика и механизмы регуляции. В частности, известно, что наиболее уязвимы клетки в S-фазе и в период пролиферации - G2-M [11], [12].
Фибробласты представляют собой гетерогенную популяцию клеток кожи, что определяется топографической локализацией в организме и нахождением в фибробластическом диффероне [13], это в свою очередь определяет сложность интерпретации динамики показателей клеточного цикла. Так, в дерме кожи человека выделяют митотически активные и постмитотические фибробласты. Даже фибробласты одного анатомического участка, но разных слоев (сосочкового и сетчатого) имеют различия в клеточной морфологии, пролиферативном потенциале, продукции внеклеточного матрикса, продукции и реакции на факторы роста и цитокины [14]. Существующие различия в динамике клеточного цикла фибробластов необходимы для поддержания тканевого гомеостаза [15]. Гетерогенность фибробластов основана на вариабельности экспрессии генома под воздействием факторов микроокружения [16]. Иммунофенотипический профиль культивируемых фибробластов кожи в норме соответствует профилю клеток мезенхимного ряда. Они экспрессируют виментин, CD44, СD49b, CD54, CD90, CD105, не экспрессируют - CD34, CD45, CD133, CD117, HLA-DR, нестин [17].
Таким образом, современные методы исследования в области клеточной и молекулярной биологии дают возможность приблизиться к пониманию тонких механизмов клеточного гомеостаза, способов регуляции клеточного цикла, в связи с этим анализ клеточного цикла остается одним из основных критериев для оценки реактивности клеток на внешние условия. Актуальность изучения биосовместимости скаффолдов и культуры клеток кожи, а также влияния УФ-излучения определяется значимостью для практического применения создаваемых тканевых эквивалентов кожи в регенеративной медицине.
В связи с этим целью настоящего исследования является в двух экспериментальных моделях провести оценку динамики показателей клеточного цикла фибробластов в системе in vitro методом проточной цитофлуориметрии. Первой экспериментальной моделью является оценка биосовместимости фибробластов со скаффолдами в условиях 2D и 3D-культивирования. Вторая экспериментальная модель – оценка биологии фибробластов после воздействия УФ-облучения.
2. Материалы и методы исследования
Материалом для исследования служили лоскуты кожи из области век женщин в возрасте от 38 до 63 лет полученные от доноров после проведения пластических операций. Выделение и культивирование фибробластов проводили по оптимизированному протоколу [18]. Клетки были выделены с использованием механической диссоциации ткани и культивировались во флаконах T25 (TTP, Швейцария) в среде RPMI-1640 (ПанЭко, Россия) с добавлением 10% эмбриональной телячьей сыворотки (ПанЭко, Россия). Формирование конфлюэнтного монослоя контролировали визуально на инвертированном микроскопе Axio Vert. A1 FL с цветной цифровой камерой Axiocam 105 (Carl Zeiss, Германия). При достижении покрытия поверхности флакона на 40% клетки пересевали. Снятие клеток проводили 0,25% раствором трипсина с добавлением ЭДТА (ПанЭко, Россия). В эксперименте использовали клеточные линии третьего пассажа.
Для исследования влияния УФ-облучения на показатели клеточного цикла фибробластов в культуре in vitro, клеточные линии облучали УФ лампой с мощностью 36 Вт (ThermoScientific, США) длиной волны 253,7 нм в течение 30 сек. Для этого в чашку Петри засевали клетки в количестве 1х104 и при достижении покрытия поверхности чашки не менее 50% проводили облучение. Анализ популяции фибробластов в контрольной группе без облучения и экспериментальной с облучением проводили по истечении 24 часов после воздействия.
Для анализа биосовместимости клеточной линии фибробластов со скаффолдами проводили посев фибробластов на носители двух видов - «G-DERM» (ДЖИ-Групп, Россия), который представляет собой биополимер на основе гидроколлоида гиалуроновой кислоты и адгезивного пептидного комплекса; «Transwell» (Corning, Нидерланды) - мембранные вставки из тетрафторэтилена (ПТФЭ) с коллагеновым покрытием. Фибробласты вносили на скаффолды в количестве 1х104 кл/мл. Для этой части работы были сформированы две модели эквивалента кожи в зависимости от используемого скаффолда: CulTw – культура клеток на Transwell, 3D-культивирование и CulGD – культура клеток на G-Derm, 2D-культивирование. Анализ популяции фибробластов проводили на сроке 15 суток культивирования.
Проточная цитофлуориметрия:
- иммунофенотип фибробластов определяли по экспрессии метки CD90 (Beckman Coulter, США), с оценкой доли фибробластов, как клеток мезенхимального происхождения;
- определение доли фибробластов по фазам клеточного цикла - G0-G1, S, G2-M.
Для исследований на цитофлуориметре использовали синий лазер (λ=488 нм). Сбор и обработка данных проводилась с использованием программного обеспечения Flow Max (Partec, Германия) по показателям прямого, бокового рассеяния и интенсивности флуоресценции по четырём каналам (3 канал на синий лазер и 1 канал на фиолетовый).
Подсчет количества жизнеспособных фибробластов проводили с помощью окраски трипановым синим (BioRad, США) с использованием автоматического счетчика клеток «Bio – Rad TC20» (Bio-Rad, США).
Статистическая обработка данных для показателя корреляции проводилась с применением коэффициента Стьюдента при уровне значимости различий p<0,05 в программе Microsoft Excel 2013.
3. Результаты и обсуждения
Анализ динамики показателей клеточного цикла в двух экспериментальных группах выявил отличительные особенности, которые определяются адаптивными механизмами клеточных линий фибробластов в первом случае к скаффолдам, во втором - являются результатом компенсаторной адаптации на действие УФ-облучения.
Клеточная линия фибробластов, которая вносилась на поверхность скаффолдов проявляла иммунофенотип CD90-позитивных клеток, как маркер мезенхимальных стромальных клеток, в количестве 75,7 % в группе CulTW и 88,7% - в группе CulGD (см. рисунок 1). Соответственно, культивируемые клетки были представлены молодой генерацией клеток фибробластического дифферона с высоким пролиферативным потенциалом для формирования адгезий с поверхностью скаффолдов.
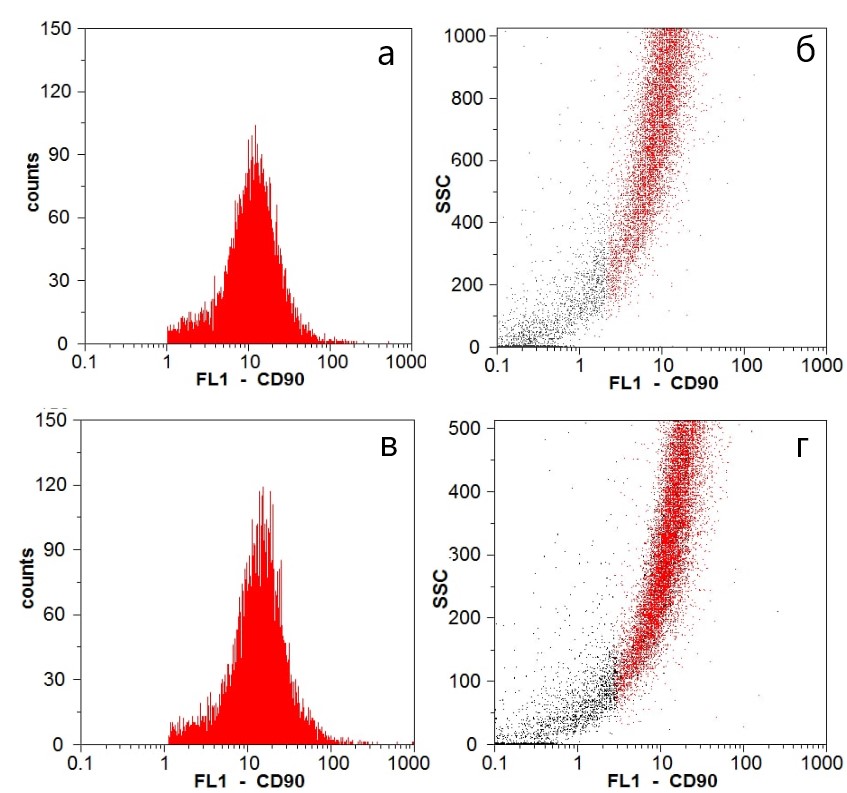
Рисунок 1 - Иммунофенотип линии дермальных фибробластов CD90+-позитивных в экспериментальных группах CulTw (а, б) и CulGD (в,г):
а, в - гистограммы количества CD90-положительных фибробластов; б, г - точечный график (красным цветом обозначены CD90-положительные фибробласты среди общего количества клеток)
Таким образом, химико-физические свойства и пространственная организация структур скаффолда G-Derm более оптимальны для пролиферативной активности фибробластов в сравнении со скаффолдом Transwell, обеспечивая высокую скорость покрытия поверхности скаффолда (см. рисунок 2). В то же время нужно отметить, что полученные данные соответствуют двум неделям культивирования фибробластов на поверхности скаффолдов, тогда как более поздние сроки культивирования пока не проанализированы, и, возможно, 3D-культивирование клеток на Transwell в отсроченный период будет более оптимальным в сравнении с 2D-культивированием на G-Derm.
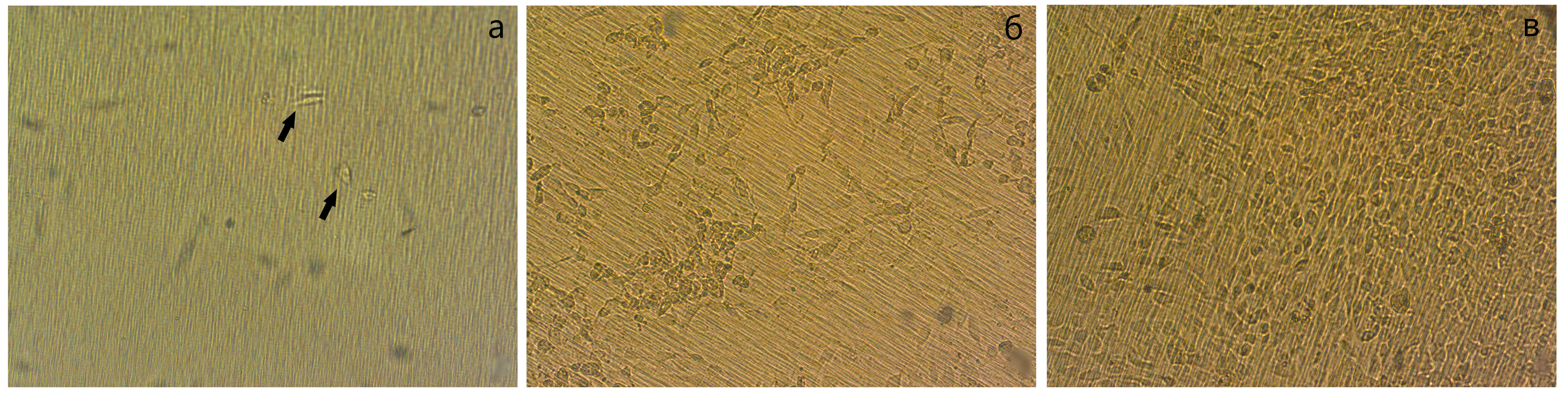
Рисунок 2 - Дермальные фибробласты на скаффолде Transwell:
а - на 2, б - 13 и в - 15 сутки культивирования
Примечание: витальный препарат; увеличение ок 10хоб 20
Выявленные изменения в клеточном цикле фибробластов контрольной группы без облучения и с облучением в течение 30 сек не отразились на общем количестве клеток при анализе через 24 часа. Выбор временной экспозиции в 30 сек был сделан после серии экспериментов с временными экспозициями в 60 и 300 сек. Увеличение времени воздействия вызывало дозозависимое статистически значимое снижение общего количества клеток по сравнению с контрольной группой без облучения - с 2,32х105 до 1,5х105 (r = - 0,89, р = 0,01). Увеличение времени облучения фибробластов до 300 секунд приводило к ярко выраженным морфологическим изменениям, которые выражались повышением зернистости цитоплазмы и истончением отростков вплоть до полного их отсутствия (см. рисунок 3).
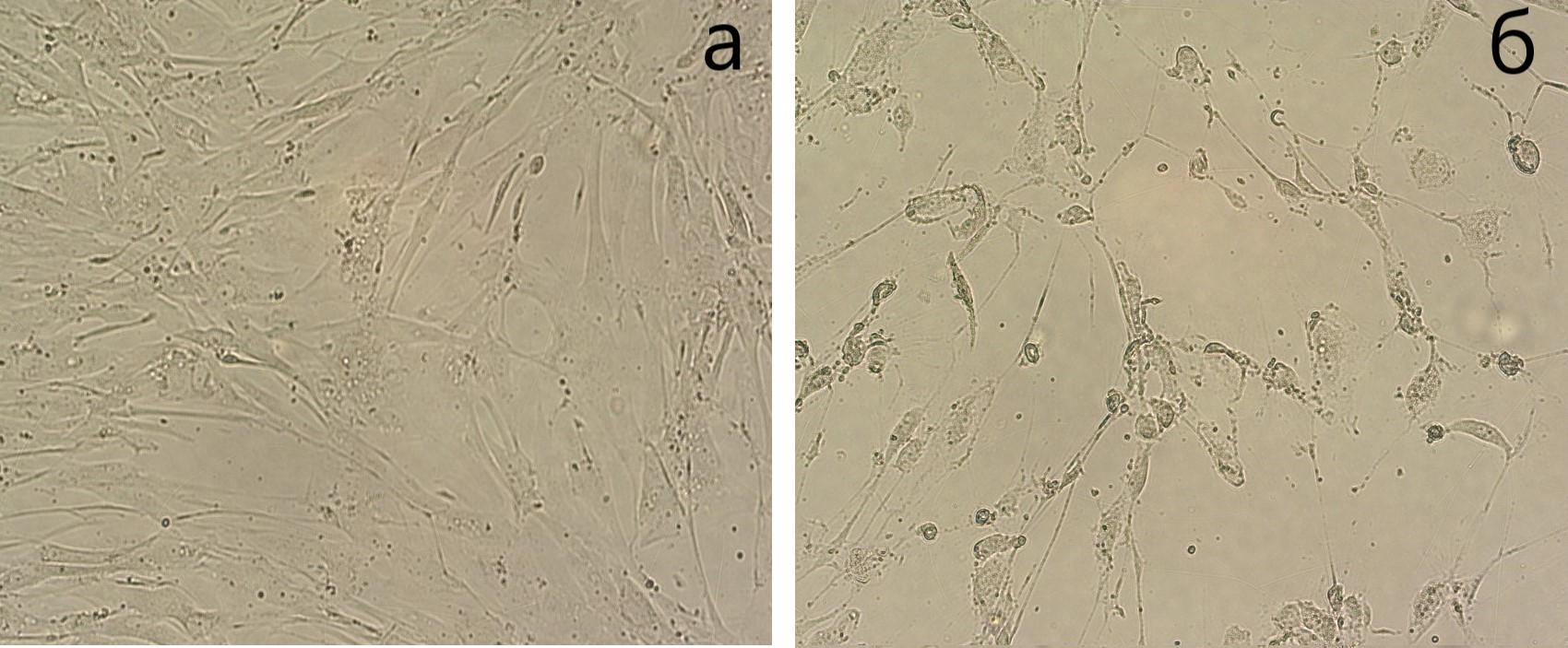
Рисунок 3 - Дермальные фибробласты:
без облучения (а) и через 24 часа после облучения в течение 300 секунд (б)
Примечание: витальная культура; световая микроскопия; ув.: ок10 х об20
Выявленные необратимые изменения в клетках, по всей видимости были вызваны нарушением функций митохондрий, нарушением структуры и функции ядерного аппарата так как в клеточных культурах было отмечено значимое увеличение числа погибших клеток По-видимому, уязвимость фибробластов к данному виду воздействия носит, во-первых, дозозависимый характер, а во-вторых, не исключена отсроченная реактивность клеток после воздействия [13].
4. Заключение
Таким образом, предварительные результаты по анализу клеточного цикла фибробластов в условиях in vitro при воздействии ультрафиолета и культивировании на различных скаффолдах выявили, что для периода двух недель культивирования высокая биосовместимось клеток наблюдается к скаффолду G-DERM в условиях 2D-культивирования. Известно, что пространственное расположение клеток и биосовместимость со скаффолдом по принципу гистоморфологического соответствия, с соблюдением принципов пространственного и функционального подобия, во многом определяется физико-химическим составом и пространственным плетением структур скаффолда [18], [19].
УФ-облучение вызывает остановку клеточного цикла как компенсаторно приспособительный процесс в ответ на действие повреждающего излучения. Временная экспозиция и дозозависимое воздействие УФ-облучения в 30 сек не оказывает выраженного летального воздействия на клеточные культуры.
Полученные нами данные о клеточном цикле фибробластов в условиях in vitro при воздействии ультрафиолета и культивировании на скаффолдах требуют дальнейших исследований путей гибели клеток, идентификации цитотоксичности и анализа сохранения пролиферативной активности у клеток. Остается открытым вопрос о степени повреждения фибробластов и порогового значения влияния анализируемых внешних агрессоров для возврата клеток в исходное состояние с помощью репаративных механизмов стрессоустойчивоcти.
