Перспективы изучения эндотелиального фактора роста сосудов для прогнозирования коморбидной патологии при детском церебральном параличе
Перспективы изучения эндотелиального фактора роста сосудов для прогнозирования коморбидной патологии при детском церебральном параличе
Аннотация
Цель. Оценка перспективы изучения эндотелиального фактора роста сосудов как диагностического маркера, принимающего активное участие и осуществляющего контроль над множеством как физиологических, так и патологических реакций организма человека.
Методика. Сбор, систематизация и анализ данных литературы в рамках возможности прогнозирования как развития основного заболевания, так и коморбидной патологии; проведение собственных исследований.
Результаты. В статье рассматривается значение эндотелиального фактора роста сосудов в физиологических и патофизиологических процессах в организме человека. Выявлено участие эндотелиального фактора в патологических изменениях головного мозга, что может свидетельствовать о возможности применения фактора как маркера заболеваний ЦНС.
Заключение. Изучение эндотелиального фактора роста сосудов при ДЦП в рамках возможности прогнозирования как развития основного заболевания, так и коморбидной патологии является перспективным, поскольку позволит планировать реабилитационный процесс наиболее эффективно и своевременно.
1. Введение
Детский церебральный паралич (ДЦП) является одним из наиболее тяжелых заболеваний нервной системы и опорно-двигательного аппарата, характеризуется изменением когнитивных способностей, существенным ограничением социальных возможностей, как самого ребенка, так и членов его семьи. Необходимо отметить, что у детей с ДЦП есть изменения со стороны различных систем организма, что оказывает негативное воздействие на реабилитационный потенциал
, . Возможность прогнозирования тяжести течения заболевания и развития сопутствующей патологии позволит планировать реабилитационный процесс наиболее эффективно и своевременно , . В последние годы исследовательское внимание уделяется изучению роли пептидных факторов, ответственных за различные функции эндотелия, в реализации патогенетических реакций при заболеваниях ЦНС.2. Основные результаты
В связи с вышесказанным является актуальным детальное изучение проблемы прогнозирования развития, определения степени тяжести, наличия коморбидной патологии, эффективности терапевтических и реабилитационных мероприятий при ДЦП с помощью биологических маркеров развития заболевания. Одним из наиболее перспективных направлений в вопросе анализа роли пептидных факторов как диагностических маркеров различной патологии является определение значимости эндотелиального фактора роста сосудов (VEGF) в развитии детского церебрального паралича и мультифакториальных заболеваний
, . VEGF, являющийся митогенным гликопротеином для эндотелиальных клеток, выполняет разнонаправленные функции . Так, VEGF стимулирует процессы васкулогенеза и ангиогенеза, увеличивает проницаемость сосудистой стенки. Однако он также влияет на активность опухолевого процесса за счет динамичности патологического неоангиогенеза и является провоспалительным цитокином, выступающим в роли индуктора макрофагов и эндотелия .Эндотелиальный фактор состоит из следующих ключевых представителей: VEGF-A, VEGF-B, VEGF-C, VEGF-D и плацентарного фактора роста (Placental growth factor — PlGF)
. Наибольшее количество исследований на сегодняшний день представлено по VEGF-A, который оказывает влияние на проницаемость сосудистой стенки, ангиогенез и нейрогенез . VEGF-A состоит из шести изоформ: VEGF121, VEGF145, VEGF165, VEGF183, VEGF189, VEGF 206, характеризующихся различной функциональной активностью . VEGF-A представляет собой фактор, приводящий к вазодилатации и стимулирующий процессы миграции моноцитов. Из множества модификаций сплайсинга VEGF-A превалирующим белком является VEGF165, несущий наиболее значительную роль в ангиогенезе и обладающий относительным сродством к гепарину , .Рудько А.С. и соавт. описали аномалию развития артериол и высокий уровень смертности у новорожденных мышей, экспрессирующих исключительно VEGF188 (аналог человеческого VEGF189) (до 50%). Отмечалось, что у мышей, экспрессирующих только VEGF120 (аналог человеческого VEGF121), также отмечались большие показатели смертности, а у выживших особей диагностировали ишемическую кардиомиопатию и полиорганную недостаточность. В то время как мыши, экспрессирующие только VEGF164 (аналог человеческого VEGF165), жизнеспособны и здоровы
.VEGF-A принимает участие в регуляции таких физиологических процессов как контроль баланса половых гормонов, регенерации, остеогенеза, сосудистого гомеостаза
. VEGF-A обеспечивает ангиопротекторное действие, ингибирует апоптоз. В ходе экспериментальных исследований было выявлено, что результатом угнетения VEGF у новорожденных мышей является апоптоз и подавление васкулогенеза, тогда как в более позднем возрастном интервале подобных изменений не наблюдается, что, возможно, свидетельствует об изменении роли VEGF в ходе онтогенеза . Кроме того, указанный фактор действует за счет индуцирования нейрогенеза, который активно продолжается в течение всей жизни .VEGF-B представлен двумя изоформами: VEGF-B167 и VEGF-B186. По своим структурным особенностям напоминает VEGF-A, однако функциональная активность существенно отличается. Так, ангиогенная активность практически не выражена, за исключением клеток миокарда. D. Bellomo с соавторами подтвердили тот факт, что отсутствие VEGF-B приводит к малым размерам сердца, более продолжительному восстановлению сердечной мышцы, нарушению работы коронарных артерий
. В исследованиях было продемонстрировано, что VEGF-B работает как защита от повреждения тканей и клеток под воздействием окислительного стресса, являющегося субстратом для развития тяжелых патологических процессов .Другим репрезентантом семейства VEGF, который характеризуется влиянием на процессы ангиогенеза, является VEGF-C, обладающий митогенной активностью по отношению к эндотелию лимфатических сосудов. Указанный фактор является мощным активатором лимфоангиогенеза, оказывая воздействие на миграцию и пролиферацию эндотелиальных клеток
. A. Bagheri с соавт. называют высокой вероятность нарушения развития плода при уменьшении экспрессии VEGF-A и VEGF-C .VEGF-D (c-fos-индуцированный фактор или FIGF) по своей структурной активности напоминает VEGF-C. Образование VEGF-D происходит в виде белка-предшественника, содержащего N- и С-терминальные пропептиды, отсутствующие у других членов семейства VEGF. За процессы лимфангиогенеза несет ответственность именно VEGF-D. VEGF-С представляет значимый маркер метастазирования опухоли, а определенное соответствие VEGF С/VEGF D является свидетельством патологического поражения лимфатических узлов
, .VEGF-E по функциональной активности напоминает VEGF-A: данный фактор является стимулятором образования фактора свертывания крови III, разрастания эндотелиальных клеток и ангиогенеза
.Синтез плацентарного фактора роста сосудов (PlGF) осуществляется в капиллярах и эндотелии пупочной вены, клетках костного мозга и матки
. Плацентарный фактор ответственен за эмбриональный ангиогенез в физиологических условиях. Концентрация фактора увеличивается и при патологических реакциях: в том числе воспалительного характера и при некоторых опухолях. Реализация функциональной активности фактора происходит за счет взаимодействия с VEGFR-1 (тирозинкиназным рецептором-1) и NRP-1 (нейропилиновым рецептором-1) , , .Таким образом, семейство VEGF принимает активное участие и осуществляет контроль над множеством как физиологических, так и патологических реакций организма человека, включая комплексный цитокиновый каскад, воздействуя посредством формирования связей с тирозинкиназными рецепторами (VEGFR-1, VEGFR-2, VEGFR-3) и корецепторами (NRP-1, NRP-2)
, .VEGFR-1 ответственен за проницаемость сосудов, миграцию моноцитов, процессы кроветворения и изменения эндотелиальных клеток. Экспрессия VEGFR-1 осуществляется в эндотелии, а гемопоэтических стволовых клетках, контролирует синтез эндотелиоцитов, сосудистую проницаемость, секрецию и другие функции эндотелия
. На эндотелиальных клетках лимфатической системы растворимая форма VEGFR-1 является эндогенным ингибитором VEGF .VEGFR-2 и VEGFR-3 располагаются на сосудистых и лимфатических клетках, являются участниками процесса васкулогенеза. VEGFR-2 является преимущественным рецептором в васкулогенезе, взаимодействуя с VEGF-A.
Взаимодействие также развивается с нейропилинами, являющимися корецепторами для VEGF и существующими в двух формах – NRP-1 и NRP-2
, .VEGF стимулирует ангиогенез и нейрогенез при инсульте, травматическом повреждении. При местном и внутримышечном введении эндотелиального фактора редуцируется очаг инфаркта и уменьшается площадь отека головного мозга. Д.И. Мальцев и О.В. Подгорный
описали нейропротективное воздействие VEGF. VEGF является механизмом нейрозащиты при повреждающем действии гипоксии . VEGF после окклюзии средней церебральной артерии у крыс приводит к положительной динамике в неврологическом и сосудистом профиле . Отмечена стимуляция синтеза нейральных стволовых клеток после интравентрикулярного введения VEGF за счет активации VEGFR-1-рецепторов и ангиогенеза , .Нейропротективное действие эндотелиального фактора развивается за счет активации процессов нейрогенеза, которые наиболее активно протекают в зонах, отличающихся хорошим кровоснабжением: в субвентрикулярной зоне латерального желудочка и субгранулярной зоне в зубчатой извилине гиппокампа
. Данный факт определил развитие концепции «ангиогенной ниши нейрогенеза», которая объясняет особенности пролиферации и дифференциации предшественников нейронов . Активация нейрогенеза VEGF-A, происходит путем стимуляции нервных клеток-предшественников, экспрессирующих непосредственные рецепторы, кроме того, создавая структурную и матриксную поддержку или секрецию других нейрогенных факторов , .Показатель VEGF на протяжении всего жизненного цикла является вариабельным: наблюдается тенденция к снижению у взрослых. Однако исключение составляют очаги активного ангиогенеза (яичники, матка и кожа)
. Повышение экспрессии VEGF наблюдается при патологических состояниях, в частности при опухолевых процессах .Нейропротективное действие эндотелиального фактора регистрируется у пациентов с последствиями нарушений мозгового кровообращения. Отмечено
существенное редуцирование ишемизированной зоны после интравентрикулярного введения VEGF и уменьшение неврологического дефицита у пациентов с ишемией мозговой ткани. Повышение экспрессии VEGF при ишемии головного мозга приводит к увеличению плотности сосудов в очаге поражения, что определяет дальнейший прогноз заболевания . Наблюдается стимуляция ангиогенеза, повышение проницаемости сосудов и улучшение перфузии в области ишемического очага при применении VEGF после перенесенного инсульта, что приводит к уменьшению зоны инфаркта мозга . VEGF оказывает влияние на нервные клетки, активируя рост аксонов и повышает устойчивость к воздействию неблагоприятных факторов .VEGF является непосредственным компонентом развития такого состояния как эндотелиальная дисфункция (ЭД)
, . Важнейшая функция эндотелия — поддержание гемоваскулярного гомеостаза, обусловленного регуляцией гемостаза, сосудистого тонуса и проницаемости сосудов, а также модуляцией воспаления . В зависимости от механизма развития выделяют различные формы дисфункции эндотелия: вазомоторную, гемостатическую, адгезионную и ангиогенную, связанные соответственно с дисбалансом вазоактивных веществ, тромбогенных эндотелиальных факторов, эндотелиальных молекул адгезии и ангиогенных факторов , . Наиболее часто встречающаяся ангиогенная форма дисфункции связана с изменением экспрессии VEGF , . VEGF занимает ведущую позицию, регулируя экспрессию эндотелиальных адгезивных факторов и модулируя адгезию лейкоцитов и тромбоцитов, способствуя миграции эндотелиальных клеток и экспрессии матриксных металлопротеиназ , .В основе развития патологического процесса при ДЦП ведущую роль играют гипоксически-ишемические изменения головного мозга
, . Гибель мембраны нервных клеток приводит к возникновению и развитию патологии нервной системы, в том числе и перинатальных энцефалопатий и ДЦП . Дистрофические изменения нейронов усугубляют дисфункция эндотелия и активация окислительного стресса, что неумолимо влечет за собой нарушения со стороны сердечно-сосудистой системы. Обеспечивая процессы вазоконстрикции и вазодилатации эндотелиальные клетки, являющиеся мультифункциональными по своей природе, участвуют в воспалительных реакциях, регуляции реологических свойств крови и изменениях в них, по всей вероятности, вызывают прогрессирование основного заболевания и развитие сопутствующей патологии.Нами был проведен сравнительный анализ уровня VEGF при разных формах ДЦП.
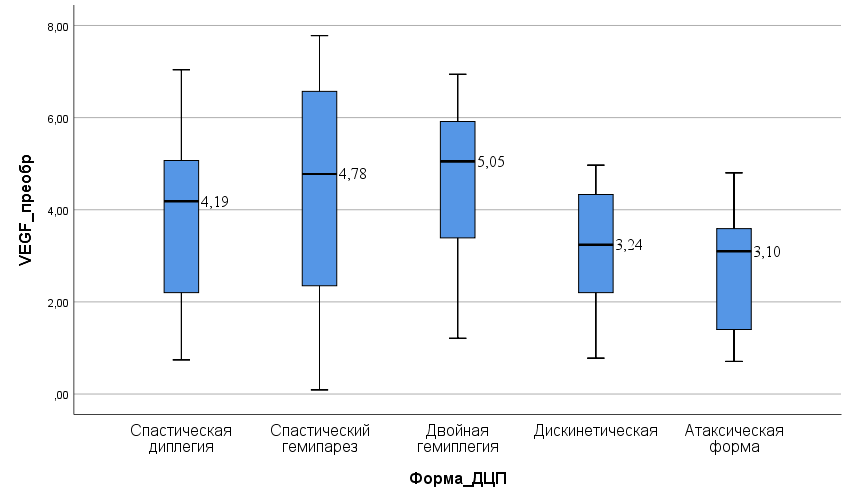
Рисунок 1 - Сравнительный анализ уровня VEGF при разных формах ДЦП
Уровень VEGF у детей с диагнозом ДЦП, спастическая диплегия представлен в таблице 1.
Таблица 1 - Уровень VEGF у детей с диагнозом ДЦП, спастическая диплегия с наличием или отсутствием сердечно-сосудистой патологии
Маркер | ДЦП, спастическая диплегия | р | |
Наличие патологии ССС, n=32 | Отсутствие патологии ССС, n=22 | ||
VEGF пг/мл, Me [Q1; Q3] | 4,68 [3,11; 5,34] | 3,4 [1,24; 4,05] | 0,048 |
Примечание: р – значимость различий, по критерию Манна–Уитни при сравнении уровня VEGF между детьми с ДЦП, спастической диплегией с наличием или отсутствием сердечно-сосудистой патологии
Как видно из таблицы 1, уровень эндотелиального фактора у детей со спастической диплегией с ССП составил 4,68 [3,11; 5,34] пг/мл, что является статистически значимо (p = 0,048) больше, чем в группе без ССП, где составил 3,4 [1,24; 4,05] пг/мл.
Результаты исследований VEGF при спастическом гемипарезе представлены в таблице 2.
Таблица 2 - Уровень VEGF у детей с диагнозом ДЦП, спастический гемипарез с наличием или отсутствием сердечно-сосудистой патологии
Маркер | ДЦП, спастический гемипарез | р | |
Наличие патологии ССС, n=12 | Отсутствие патологии ССС, n=22 | ||
VEGF пг/мл, Me [Q1; Q3] | 5,58 [2,35; 7,45] | 4,78 [2,39; 5,43] | 0,322 |
Примечание: р – значимость различий, по критерию Манна–Уитни при сравнении уровня VEGF между детьми с ДЦП, спастическим гемипарезом с наличием или отсутствием сердечно-сосудистой патологии
Уровень VEGF у детей с ССП составил 5,58 [2,35; 7,45] пг/мл, у детей без ССП — 4,78 [2,39; 5,43] пг/мл. Значения сопоставимы между собой (p = 0,322).
Уровень VEGF у детей с диагнозом ДЦП, двойная гемиплегия представлен в таблице 3.
Таблица 3 - Уровень VEGF у детей с диагнозом ДЦП, двойная гемиплегия с наличием или отсутствием сердечно-сосудистой патологии
Маркер | ДЦП, двойная гемиплегия | Р | |
Наличие патологии ССС, n=10 | Отсутствие патологии ССС, n=8 | ||
VEGF пг/мл, Me [Q1; Q3] | 5,28 [5,05; 6,94] | 3,39 [2,6; 4,29] | 0,026 |
Примечание: р – значимость различий, по критерию Манна–Уитни при сравнении уровня VEGF между детьми с ДЦП, двойной гемиплегией с наличием или отсутствием сердечно-сосудистой патологии
Как видно из таблицы 3, уровень VEGF у детей при двойной гемиплегии с ССП составил 5,28 [5,05; 6,94] пг/мл, что является статистически значимо (p = 0,026) больше, чем в группе без ССП (3,39 [2,6; 4,29] пг/мл).
Уровень VEGF у детей с диагнозом ДЦП, дискинетическая форма представлены в таблице 4.
Таблица 4 - Уровень VEGF у детей с диагнозом ДЦП, дискинетическая форма с наличием или отсутствием сердечно-сосудистой патологии
Маркер | ДЦП, дискинетическая форма | р | |
Наличие патологии ССС, n=6 | Отсутствие патологии ССС, n=6 | ||
VEGF пг/мл, Me [Q1; Q3] | 3,22 [2,34; 3,44] | 3,41 [2,12; 4,36] | 0,395 |
Примечание: р – значимость различий, по критерию Манна–Уитни при сравнении уровня VEGF между детьми с ДЦП, дискинетической формой с наличием или отсутствием сердечно-сосудистой патологии
Уровень VEGF у детей с ССП при дискинетической форме составил 3,22 [2,34; 3,44] пг/мл, у детей без ССП — 3,41 [2,12; 4,36] пг/мл. Значения сопоставимы между собой (p = 0,395).
Результаты исследования VEGF у детей с атаксической формой ДЦП представлены в таблице 5.
Таблица 5 - Уровень VEGF у детей с диагнозом ДЦП, атаксическая форма с наличием или отсутствием сердечно-сосудистой патологии
Маркер | ДЦП, атаксическая форма | Р | |
Наличие патологии ССС, n=4 | Отсутствие патологии ССС, n=6 | ||
VEGF пг/мл, Me [Q1; Q3] | 2,15 [0,71; 3,59] | 3,1 [2,54; 3,53] | 0,724 |
Примечание: р – значимость различий, по критерию Манна–Уитни при сравнении уровня VEGF между детьми с ДЦП, атаксической формой с наличием или отсутствием сердечно-сосудистой патологии
Уровень VEGF у детей с ССП составил 2,15 [0,71; 3,59] пг/мл, у детей без ССП — 3,1 [2,54; 3,53] пг/мл. Результаты сопоставимы между собой (p = 0,724).
3. Заключение
При определении значений эндотелиального фактора при разных формах ДЦП установлено повышение показателя при спастической диплегии и двойной гемиплегии с сопутствующей сердечно-сосудистой патологией.
Принимая во внимание вышеизложенное, представляется целесообразным изучение пептидных факторов роста при ДЦП в рамках возможности прогнозирования как развития основного заболевания, так и коморбидной патологии.
