Стимулирование люминесцентной реакции базидиомицета Mycena gombakensis соком ананаса
Стимулирование люминесцентной реакции базидиомицета Mycena gombakensis соком ананаса
Аннотация
Недавнее открытие механизма биолюминесценции высших грибов открывает новые возможности для широкого ряда биотехнологических применений. Поиск и исследование действия стимуляторов люминесцентной реакции является актуальной задачей, решение которой расширяет представления о биолюминесцентном потенциале базидиомицетов. Работа посвящена изучению действия сока ананаса на люминесценцию светящегося базидиомицета Mycena gombakensis, биомассу которого получали методом глубинного и поверхностного культивирования мицелия. Результаты экспериментальных исследований свидетельствуют, что сок ананаса не содержит компоненты биолюминесцентной реакции. Однако его добавление в несколько раз увеличивает интенсивность люминесценции in vivo пеллет M. gombakensis и выделенных из них ферментных систем in vitro.
1. Введение
Согласно общепринятому представлению, люминесценция базидиомицетов в природе или при культивировании биомассы в лабораторных условиях вызывается ферментной системой , . Фермент гиспидин-синтаза преобразует кофейную кислоту в гиспидин. Гиспидин преобразуется ферментом гиспидин -3-гидроксилаза в люциферин, а из люциферина, благодаря ферменту люцифераза, образуется окисленный люциферин и излучаются кванты света. Окисленный люциферин ферментом кофеоил пируват гидролаза вновь преобразуется в кофейную кислоту, и цикл излучения повторяется , .
Ферментные системы светящихся грибов, содержащие компоненты люминесцентной реакции, можно выделить из плодовых тел или культивируемой биомассы базидиомицетов , . При этом появляется возможность изучения in vitro интенсивности и кинетики люминесценции, которые определяются составом веществ, вносимых в раствор ферментной системы. В биолюминесцентном анализе вносимые вещества вызывают три эффекта:
1) ингибирующий, сопровождаемый снижением интенсивности люминесценции;
2) нейтральный, когда отсутствуют изменения в интенсивности люминесценции;
3) стимулирующий, ведущий к увеличению интенсивности люминесценции.
Под стимулятором мы подразумеваем вещества, не являющиеся компонентам люминесцентной реакции (субстрат ферментной реакции или НАДФН), которые увеличивают квантовый выход ферментной системы и выделяются из нелюминесцентных растительных объектов.
Считается, что светящиеся грибы имеют общий механизм биолюминесценции и содержат гиспидин, являющийся предшественником субстрата люминесцентной системы , . Горячие экстракты, полученные из плодовых тел светящихся и несветящихся грибов или мицелия , питательные среды при культивировании биомассы и экстракты некоторых растений не относятся к стимуляторам, так как содержат гиспидин.
Работа посвящена изучению сока ананаса (СА), как стимулятора люминесценции ферментной системы базидиомицета Mycena gombakensis. Результаты исследований свидетельствуют, что СА не содержит субстрат люминесцентной реакции и НАДФН, однако стимулирует in vivo люминесценцию пеллет M. gombakensis и выделенных из них ферментных систем invitro.
2. Методы и принципы исследования
Ананасы, выращенные в Китае, приобретены в торговой сети города Красноярска. Сок получали путем отжима мякоти плода с помощью механического пресса и последующим центрифугированием 30 мин при 16000g на центрифуге Avanti® J–E (Beckman–Coulter, США). Для увеличения концентрации веществ в образце и сохранности свойств препаратов супернатанты лиофильно высушивали на установке ЛС–500 (Россия), а затем перед измерением разводили в деионизованной воде Milli–Q system (Millipore, США).
В работе использовали люминесцентную культуру базидиомицета M. gombakensis (культура 2371) из Коллекции культур Института биофизики СО РАН. Биомассу M. gombakensis получали методом глубинного и поверхностного культивирования мицелия используя картофельно-сахарозную питательную среду (200 г/л картофеля, 20 г/л сахарозы). Культуры росли при температуре 27°С при глубинном культивировании с постоянным перемешиванием колб с посевным материалом, а при поверхностном культивировании без перемешивания в чашках Петри. Подробнее методы культивирования описаны в работе . Выросшие мицелиальные пеллеты в форме глобул использовали для проведения экспериментов in vivo.
Изучение in vitro кинетики реакций на внесение СА проводили на ферментной системе, выделенной из пеллет M. gombakensis. Методика выделения ферментной люминесцентной системы подробно описана в работах . Необходимо отметить, что из биомассы мицелия M. gombakensis в зависимости от условий культивирования можно получить 2 типа люминесцентных систем. При культивировании в объеме жидкой питательной среды выделенная ферментная система не содержит эндогенный субстрат ферментативной реакции, тогда как при культивировании на поверхности жидкой питательной среды ферментная система содержит эндогенный субстрат. В качестве экзогенного субстрата люминесцентной реакции in vitro использовали горячий экстракт из плодовых тел нелюминесцентного гриба Pholiota squarrosa, получение которого описано в работе . Лиофильно высушенные образцы ферментных систем и все используемые в экспериментах растворы хранили при температуре -20°C.
Кинетику и интенсивность люминесцентных сигналов в относительных единицах (RLU) регистрировали in vivo и in vitro с помощью люминометра Glomax 20/20 (Promega BioSystems Sunnyvale, Inc., США) в режиме одно измерение в секунду. Для визуализации люминесценции пеллет применяли гель-документирующую систему GelDoc XR Imaging System (Bio-Rad Laboratories, Inc., США). Данный прибор позволяет получить изображение образцов при наличии света и регистрировать люминесценцию в отсутствии освещения. Получаемое изображение является черно-белым, но программное обеспечение позволяет получить его в цвете. Поскольку большинство грибов имеют максимумы спектров излучения биолюминесценции в диапазоне 520-530 нм , изображения люминесцирующих объектов представлены в зеленом цвете.
3. Основные результаты и обсуждение
Ферментная система M. gombakensis, не содержащая эндогенного субстрата. Результаты регистрации люминесценции при разной последовательности добавления веществ в реакционную среду представлены на рис. 1. Во всех случаях добавление только НАДФ к системе 2371 не меняет уровень люминесцентного сигнала. Люминесценция возрастает при последующем добавлении экстракта P. squarrosa, содержащего экзогенный субстрат люминесцентной реакции (кривые а и б). Последующее добавление СА приводит к дополнительному увеличению люминесценции (б).
Отсутствие увеличения люминесценции при добавлении НАДФН означает, что ферментная система, выделенная из пеллет, культивируемых в объеме жидкой питательной среды, не имеет эндогенного субстрата. Поэтому изменения в кинетике люминесцентной реакции будут определяться только добавленными к ней веществами.
Добавление НАДФН и СА не меняет люминесцентный отклик ферментной системы (в). Следовательно, СА не является субстратом люминесцентной реакции. Подтверждением того, что ферментная система функционирует, следует из увеличения люминесценции при последующем добавлении экстракта P. squarrosa (в).
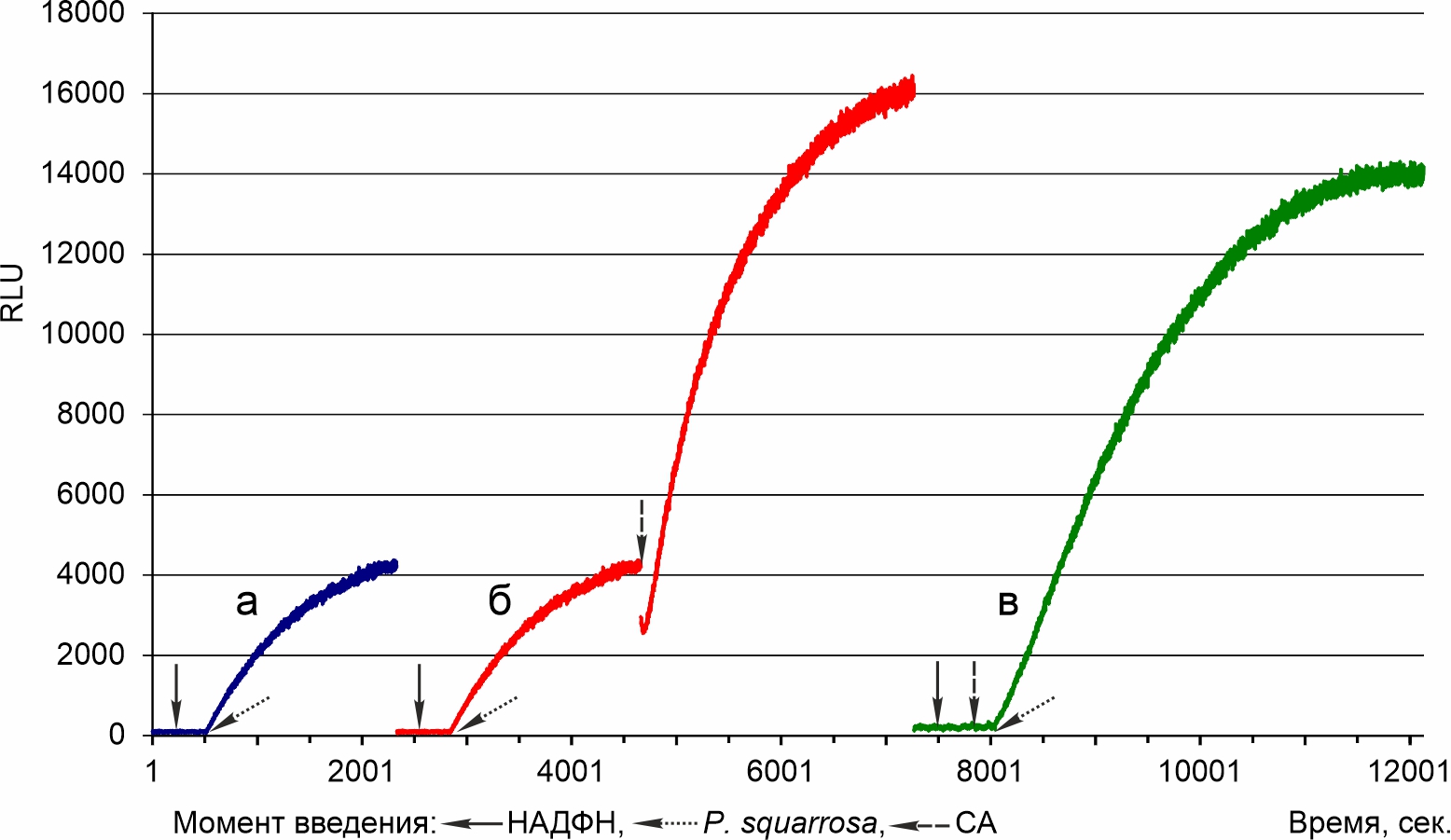
Рисунок 1 - Люминесценция системы 2371 при внесении в реакционную среду СА
Примечание: а - 50 мкл системы + 5 мкл НАДФН + 5 мкл экстракта P. squarrosa; б - 50 мкл системы + 5 мкл НАДФН + 5 мкл экстракта P. squarrosa + 5 мкл СА; в - 50 мкл системы + 5 мкл НАДФН + 5 мкл СА + 5 мкл экстракта P. squarrosa
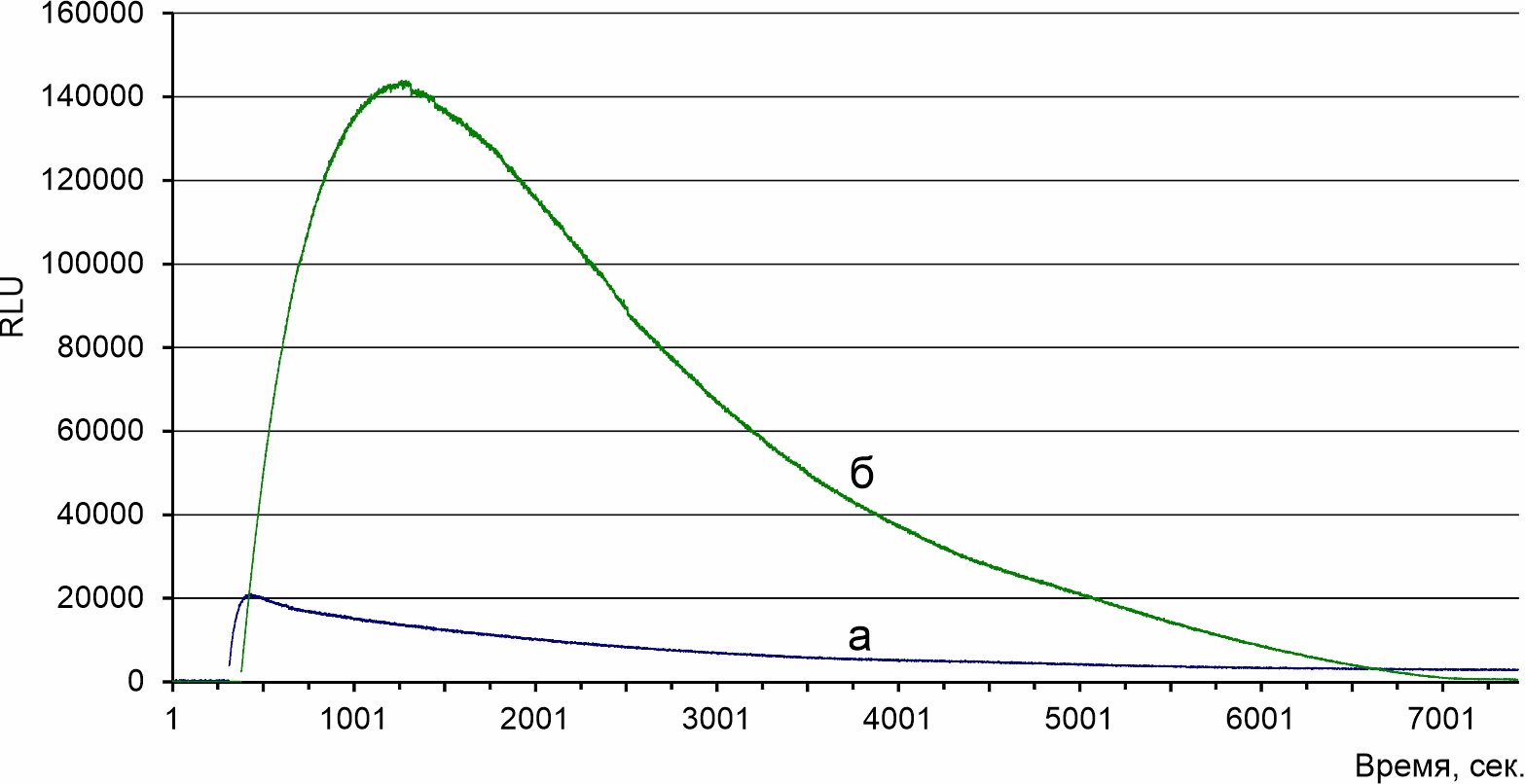
Рисунок 2 - Изменение кинетики люминесценции при внесении 5 мкл СА к 50 мкл ферментной системы 2371 содержащей 5 мкл НАДФН и 5 мкл экстракта P. squarrosa
Примечание: а – ферментная система, не содержащая СА; б – ферментная система, содержащая СА
а) выделена ферментная система M. gombakensis не содержащая эндогенный субстрат люминесцентной реакции;
б) СА не является субстратом ферментной люминесцентной системы 2371;
в) при использовании экзогенного субстрата СА увеличивает квантовый выход люминесцентной реакции и максимальное значение сигнала.
Ферментная система M. gombakensis, содержащая эндогенный субстрат. Отличие люминесценции ферментной системы 2371, имеющей эндогенный субстрат от люминесценции ферментной системы, не имеющей эндогенный субстрат заключается в продуцировании квантов света при внесении раствора НАДФН (рис. 3а). Последующее внесение СА вызывает увеличение люминесценции. Следовательно, СА участвует в продуцировании квантов света на основе эндогенного субстрата M. gombakensis.
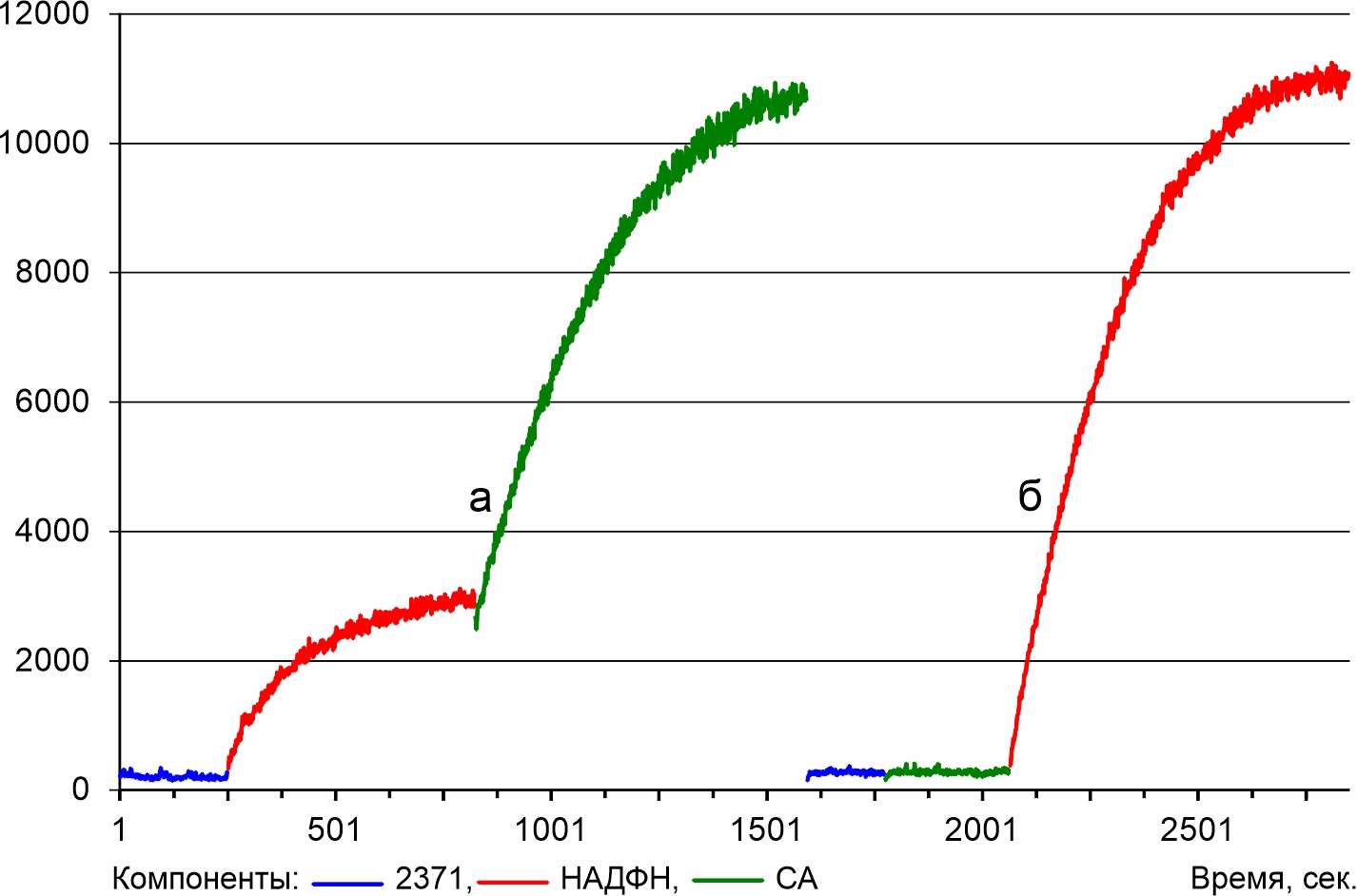
Рисунок 3 - Люминесценция системы 2371, имеющей эндогенный субстрат, при различной последовательности внесении в реакционную среду СА и НАДФН
Люминесценция пеллет. Визуализация люминесценции пеллет M. gombakensis на гель-документирующей системе GelDoc XR Imaging System (Bio-Rad Laboratories, Inc., США) при добавлении СА представлена на рис. 4.
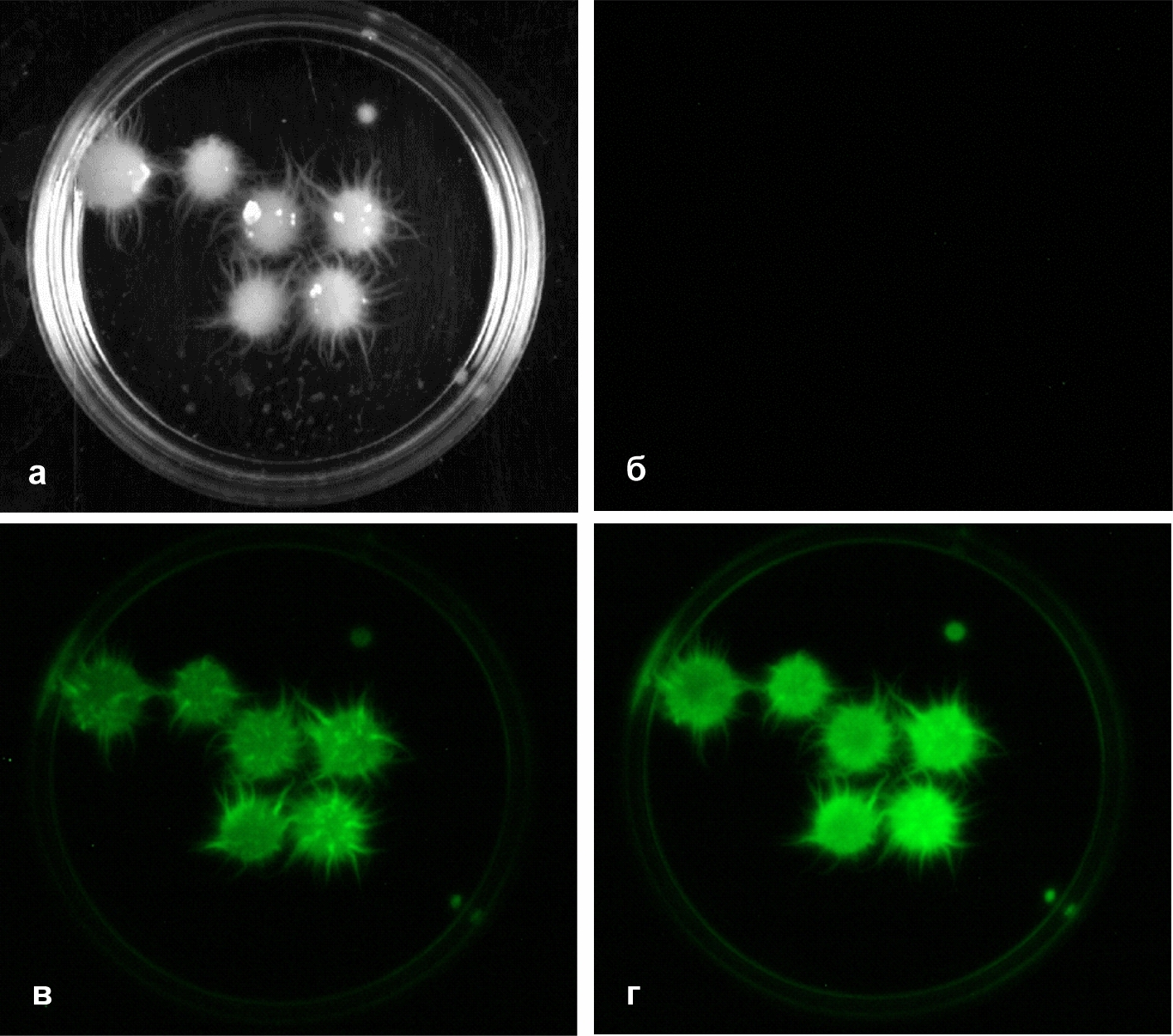
Рисунок 4 - Регистрация увеличения люминесценции пеллет культуры 2371 при добавлении СА
Примечание: а – пеллеты при внешнем освещении; б – отсутствие люминесцентного сигнала, достаточного для визуализации; в – люминесценция пеллет через 15 минут после добавления СА; г – люминесценция пеллет через 30 минут после добавления СА
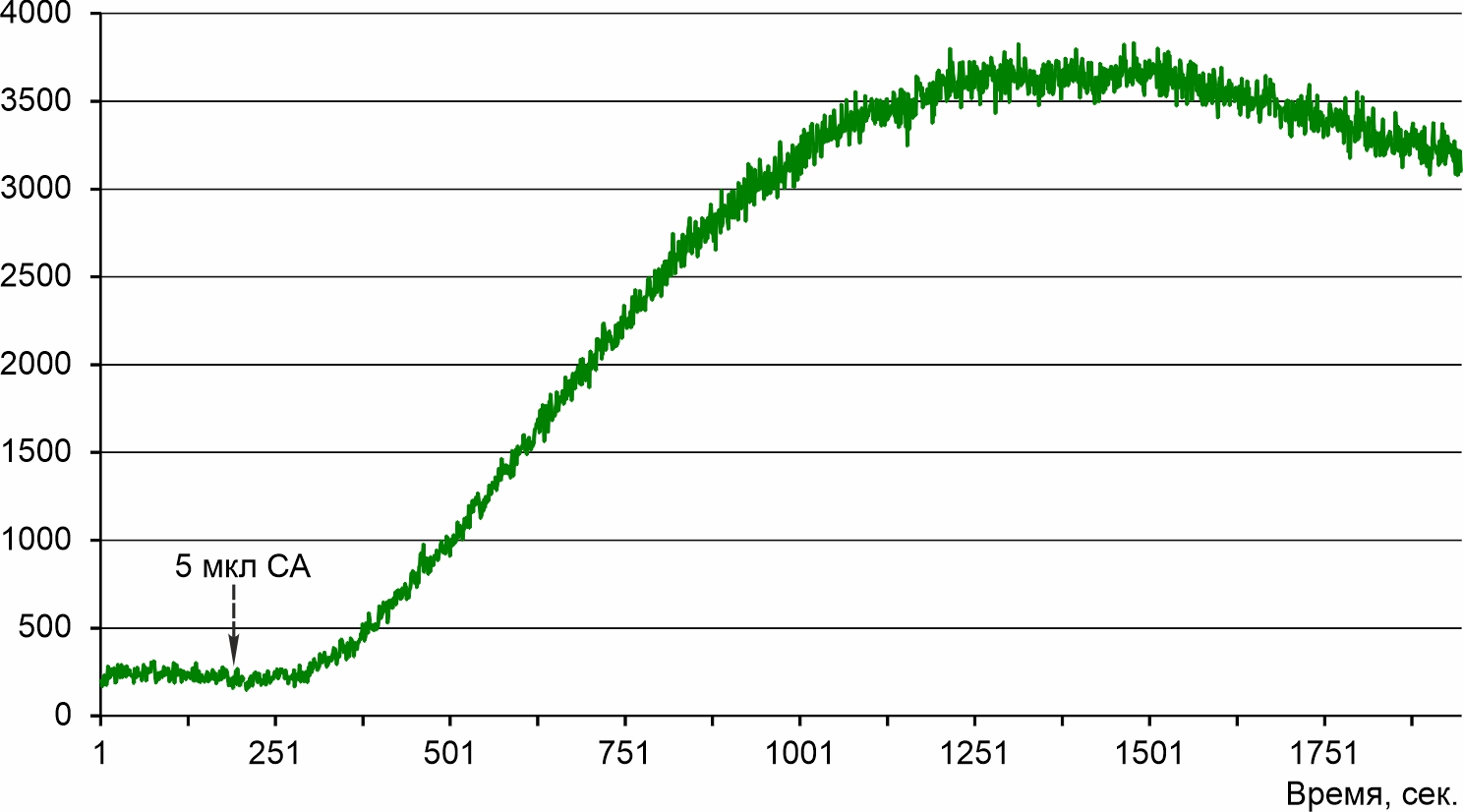
Рисунок 5 - Стимуляция люминесценции пеллеты культуры 2137 после добавления 5 мкл СА
4. Заключение
В результате проведенных исследований на ферментной системе светящегося базидиомицета M. gombakensis установлено, что СА не содержит компоненты биолюминесцентной реакции. СА является стимулятором люминесцентной реакции. При его добавлении в несколько раз увеличивается интенсивность люминесценции in vivo пеллет M. gombakensis и выделенных из них ферментных систем in vitro. Механизм стимулирующего эффекта СА в настоящее время не известен. Можно предположить, что СА изменяет свойства субстрата или переводит продукт реакции в субстрат реакции. Полученные результаты дополняют известную схему люминесценции базидиомицетов и требуют дополнительных исследований, прежде всего в части идентификации химических соединений СА, непосредственно отвечающих за стимуляцию.
