ЦИТОКИНЫ КАК РЕГУЛЯТОРЫ СИСТЕМНОГО ВОСПАЛЕНИЯ ПРИ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКЕ С ПОЧЕЧНЫМ СИНДРОМОМ
ЦИТОКИНЫ КАК РЕГУЛЯТОРЫ СИСТЕМНОГО ВОСПАЛЕНИЯ ПРИ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКЕ С ПОЧЕЧНЫМ СИНДРОМОМ
Аннотация
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – остро протекающая вирусная инфекция, в число природных очагов которой входит Самарская область – территория, где проводилось данное исследование. Заболевание проявляется «цитокиновым штормом», геморрагическим синдромом, гемодинамическими расстройствами и поражением почек с развитием острой почечной недостаточности, в связи с чем актуален вопрос о показаниях и способах антицитокиновой терапии. Это требует детальной характеристики цитокинового статуса больных в соответствии с периодами и тяжестью течения ГЛПС. С этой целью был проанализирован цитокиновый профиль 65 больных ГЛПС, у 12 из которых заболевание имело тяжелое течение. Было установлено наибольшее диагностическое и патогенетическое значение динамики ИЛ-12, ФНОα, ФНОβ, ИЛ-6 и ИЛ-10. В результате проведенного анализа отмечено потенциальное значение соотношения цитокинов ИЛ-6 и ИЛ-10 для совершенствования схемы терапевтического воздействия при ГЛПС.
1. Введение
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – острое вирусное природно-очаговое заболевание, проявляющееся геморрагическим синдромом, гемодинамическими расстройствами и поражением почек с развитием острой почечной недостаточности . Возбудитель ГЛПС относится к семейству Hantaviridae, роду Orthohantavirus . В настоящее время известно более 80 серологически и генетически отличающихся друг от друга типов хантавирусов, из них около 25 обладают патогенностью для человека , , .
В целом в качестве характерных особенностей ГЛПС, придающих ей медико-социальное значение, отмечаются возможность летального исхода, высокая частота резидуальных явлений, длительно сохраняющихся у реконвалесцентов, что значительно удлиняет сроки временной нетрудоспособности и негативно влияет на качество жизни пациентов. Сложность ранней диагностики ГЛПС связана с наличием атипичных, стертых форм заболевания, преобладанием в первые дни болезни общетоксического синдрома без патогномоничных симптомов .
Клинически различают следующие периоды болезни:
- инкубационный (от 1 до 5 недель, в среднем 2-3 недели);
- лихорадочный (начальный, общетоксический), продолжающийся в среднем от 3-х до 7-ми дней;
- олигоурический, проявляющийся геморрагическим синдромом и острой почечной недостаточностью с резким снижением суточного количества мочи вплоть до анурии (в среднем 6-12 дней);
- полиурический с резким возрастанием суточного количества мочи (в среднем 6-14 дней);
- период реконвалесценции (ранний – до 2 месяцев и поздний – до 2-3 лет) , .
Поскольку ГЛПС проявляется системным воспалением, это заболевание сопровождается «цитокиновым штормом» . Такие цитокины как ИФНα, ИЛ-6, ИЛ-1 определяют развитие лихорадки, инфекционно-токсического шока, продукцию белков острой фазы, а ФНОα, ИФНβ, ИЛ-6 повышают проницаемость сосудов и нарушают функции эндотелиальных клеток . В зависимости от воздействия на воспалительный процесс цитокины подразделяются на две группы – провоспалительные и противовоспалительные, а величина их соотношения в сыворотке крови пациента свидетельствует об активности и выраженности системного воспаления . Дело в том, что цитокины как продукты клеток иммунной системы могут обладать не только паракринным действием на клетки ближайшего микроокружения или аутокринным действием на клетки-продуценты, но и системным воздействием, высокая выраженность которого как раз и определяет развитие цитокинового шторма .
В связи с этим актуальным является уточнение взаимосвязи между отдельными цитокинами в соответствии со стадиями заболевания для дальнейшей разработки на этой основе терапии, корригирующей цитокиновый профиль на каждом этапе инфекционного процесса. Целью исследования служило определение роли цитокинов крови провоспалительного и противовоспалительного действия в каждый период ГЛПС и влияния цитокинового профиля на тяжесть течения заболевания.
2. Материал и методы исследования
Работа выполнялась в г. Самара, где этиология ГЛПС связана с хантавирусами типа Puumala, а основным природным резервуаром является грызун европейская рыжая полевка . Исследование включало иммунологическое наблюдение 65 пациентов с серологически верифицированным диагнозом ГЛПС, находящихся на стационарном лечении в Клиниках ФГБОУ ВО «Самарского государственного медицинского университета» Минздрава России. Контрольная группа включала 15 условно здоровых людей.
Во всех группах исследования число женщин было в 1,5-4 раза больше, чем мужчин, средний возраст составлял у пациентов с ГЛПС 41,9 ± 12,5 лет и 38 ± 13,1 лет в контрольной группе при колебаниях от 22 до 59 лет. Дизайн исследования был утвержден межвузовским этическим комитетом (протокол № 204 от 11.12.2019 г.). Все пациенты и условно здоровые люди, находящиеся под клиническим наблюдением, в соответствии с принципами Хельсинкской Декларации были предупреждены об участии в исследовании и подписали информированное добровольное согласие.
Диагноз ГЛПС устанавливался на основе серологических данных путем постановки реакции непрямой иммунофлуоресценции (РНИФ) с парными сыворотками. Сыворотку получали из венозной крови пациента на 5-7-й день от начала заболевания, забор крови осуществлялся дважды с интервалом в 5-7 дней .
Среди 65 больных ГЛПС, находящихся под стационарным наблюдением, у 53 человек (81,5%) заболевание имело среднетяжелое течение, а у 12 человек (18,5%) – тяжелое. Тяжесть течения ГЛПС устанавливалась в соответствии с клиническими рекомендациями, утвержденными Минздравом РФ .
Определение цитокинов в крови пациентов с ГЛПС проводилось методом иммуноферментного анализа в каждый из периодов заболевания. Исключение составлял только лихорадочный период, в ходе которого наблюдались только 17 пациентов, поскольку остальные больные поступали на стационарное лечение в олигоурический период. Иммуноферментный анализ (ИФА) осуществлялся из проб сыворотки крови с использованием комплекта аппаратуры, включающего планшетный фотометр «OPSYS MR» (ридер) фирмы «THERMOLABSYSTEMS» (Финляндия), планшетный вошер ПП2-428 фирмы «ИММЕДТЕХ» (Россия), принтер «EPSON» (Япония) для раздельного определения цитокинов в соответствии с инструкцией по применению аппаратуры и комплектов соответствующих моноклональных антител производства фирмы «Вектор Бест» (Россия). При этом устанавливалось содержание в крови провоспалительных цитокинов – интерлейкина (ИЛ)-1β, ИЛ-6, ИЛ-12, факторов некроза опухолей α и β (ФНОα и ФНОβ), интерферона γ (ИФНγ), а также противовоспалительных цитокинов (ИЛ-4, ИЛ-10) .
Статистическая обработка результатов проводилась на основе пакета статистических программ SPSS (версия 23) в соответствии с инструкцией по их применению. В работе использовалась дискриптивная и сравнительная непараметрическая статистика (отсутствовало нормальное распределение данных), корреляционный анализ, определение 95% доверительных интервалов показателей, ROC-анализ.
3. Результаты исследования
Результаты определения цитокинового профиля больных ГЛПС с разной степенью тяжести заболевания включали сравнение этих данных с группой контроля и представлены в таблице 1, а также на рисунке 1.
Как следует из таблицы и рисунка, цитокиновые профили больных ГЛПС значительно различались в соответствии со стадиями инфекционного процесса. Достоверные отклонения от контроля демонстрировали практически все цитокины, при этом общие тенденции изменения показателей по сравнению с контрольными значениями, как это наглядно показывает рисунок 1, для среднетяжелого и тяжелого течения заболевания полностью совпадают, хотя и регистрируются количественные различия.
Таблица 1 - Показатели цитокинового профиля у больных в динамике ГЛПС разной степени тяжести
Цитокины | Медиана [минимум; максимум] | р1; р2; р3 | ||
Больные ГЛПС среднетяжелого течения, n = 53 | Больные ГЛПС тяжелого течения, n = 12 | Здоровые люди (контроль), n = 15
| ||
1 | 2 | 3 | 4 | 5 |
Лихорадочный период ГЛПС, nтяж = 7, nср.тяж = 9 | ||||
ИЛ-4 (пг/мл) | 1,5 [1,5; 1,6] | 1,5 [1,5;1,6] | 2,2 [1,3; 4,2] | 0,999; 0,011*; 0,011* |
ИЛ-12 (пг/мл) | 12,1 [11,7; 13,1] | 12 [10,9; 12,1] | 9,1 [7,8; 14,4] | 0,513; <0,001*; <0,001* |
ИФНγ (пг/мл) | 80,3 [72,2; 88,6] | 88,6 [79,9; 94,8] | 40,8 [27,5; 51,5] | 0,376; <0,001*; <0,001* |
ИЛ-1β (пг/мл) | 2,86 [2,59; 3,04] | 2,6 [2,4; 2,9] | 3,8 [2,5; 5,2] | 0,184; 0,035*; 0,042* |
ИЛ-6 (пг/мл) | 26,4 [19,9; 26,8] | 26,4 [20; 29,6] | 6,2 [2,7; 9,2] | 0,513; <0,001*; <0,001* |
ФНОα (пг/мл) | 2,7 [2,55; 3] | 2,9 [2,7; 3] | 2 [0,8; 2,8] | 0,513; 0,258; 0,198 |
ФНОβ (пг/мл) | 48,5 [38,1; 71,7] | 48,5 [40,6; 51,1] | 1,4 [0,6; 2,9] | 0,487; <0,001*; <0,001*
|
ИЛ-10 (пг/мл) | 29 [24,9; 32,3] | 29,6 [14,8; 32,3] | 6,8 [3,4; 9,1] | 0,827; <0,001*; <0,001*
|
Олигоурический период ГЛПС, nтяж =12, nср.тяж = 53 | ||||
ИЛ-4 (пг/мл) | 1,55 [1,5; 1,7] | 1,6 [1,5; 1,8] | 2,2 [1,3; 4,2] | 0,834; 0,010*; 0,012* |
ИЛ-12 (пг/мл) | 14,2 [12,3; 14,3] | 12,3 [10,9; 13,7] | 9,1 [7,8; 14,4] | 0,049*; <0,001*; <0,001*
|
ИФНγ (пг/мл) | 86,5 [80,2; 88,6] | 86,5 [80,3; 101] | 40,8 [27,5; 51,5] | 0,511; <0,001*; <0,001*
|
ИЛ-1β (пг/мл) | 3,35 [3,22; 3,72] | 2,49 [2,07; 3,19] | 3,8 [2,5; 5,2] | 0,004*; 0,003*; <0,001* |
ИЛ-6 (пг/мл) | 35,1 [30,4; 39,4] | 23,8 [17; 32,3] | 6,2 [2,7; 9,2] | 0,006*; <0,001*; <0,001*
|
ФНОα (пг/мл) | 2,94 [2,87; 3,33] | 3 [2,74; 3,87] | 2 [0,8; 2,8] | 0,392; <0,001*; <0,001*
|
ФНОβ (пг/мл) | 56,2 [51; 71,7] | 52,3 [48,5; 82,1] | 1,4 [0,6; 2,9] | 0,556; <0,001*; <0,001*
|
ИЛ-10 (пг/мл) | 15,4 [13,9; 163] | 14,3 [11,2; 100,5] | 6,8 [3,4; 9,1] | 0,432; <0,001*; <0,001*
|
Полиурический период ГЛПС, nтяж = 12, nср.тяж = 53 | ||||
ИЛ-4 (пг/мл) | 1,6 [1,5; 1,7] | 1,7 [1,6; 1,8] | 2,2 [1,3; 4,2] | 0,102; 0,012*; 0,015* |
ИЛ-12 (пг/мл) | 16,6 [16; 17,8] | 12,7 [11,7; 13,5] | 9,1 [7,8; 14,4] | 0,020*; <0,001*; <0,001* |
ИФНγ (пг/мл) | 86,2 [81,7; 88,6] | 88,6 [80,3; 90,6] | 40,8 [27,5; 51,5] | 0,193; <0,001*; <0,001* |
ИЛ-1β (пг/мл) | 2,68 [2,36; 2,94] | 2,86 [2,620; 3,1] | 3,8 [2,5; 5,2] | 0,433; 0,003*; <0,001* |
ИЛ-6 (пг/мл) | 28,6 [23,5; 31,7] | 26,9 [17,7; 45,1] | 6,2 [2,7; 9,2] | 0,998; <0,001*; <0,001* |
ФНОα (пг/мл) | 3,89 [3,43; 4,51] | 3,22 [3; 3,47] | 2 [0,8; 2,8] | 0,039*; <0,001*; <0,001* |
ФНОβ (пг/мл) | 69,1 [59,1; 71,9] | 54,3 [46,8; 60,1] | 1,4 [0,6; 2,9] | 0,020*; <0,001*; <0,001* |
ИЛ-10 (пг/мл) | 31,8 [30,5; 35,1] | 33,4 [12,6; 215,9] | 6,8 [3,4; 9,1] | 0,999; <0,001*; <0,001* |
Период реконвалесценции ГЛПС, nтяж = 12, nср.тяж = 53 | ||||
ИЛ-4 (пг/мл) | 1,6 [1,4; 1,6] | 1,6 [1,6; 1,7] | 2,2 [1,3; 4,2] | 0,317; 0,012*; 0,012* |
ИЛ-12 (пг/мл) | 13,3 [12,9; 14,9] | 12,7 [11,7; 12,9] | 9,1 [7,8; 14,4] | 0,077; <0,001*; <0,001* |
ИФНγ (пг/мл) | 90 [83,5; 130,1] | 117,5 [109; 287] | 40,8 [27,5; 51,5] | 0,275; <0,001*; <0,001* |
ИЛ-1β (пг/мл) | 3,22 [2,99; 3,34] | 2,8 [2,74; 2,98] | 3,8 [2,5; 5,2] | 0,053; <0,001*; <0,001* |
ИЛ-6 (пг/мл) | 20,6 [16,2; 24,5] | 23,8 [18,5; 21,9] | 6,2 [2,7; 9,2] | 0,513; <0,001*; <0,001* |
ФНОα (пг/мл) | 3,6 [3,45; 3,78] | 3,27 [3; 3,47] | 2 [0,8; 2,8] | 0,127; <0,001*; <0,001* |
ФНОβ (пг/мл) | 53,2 [45,2; 60,1] | 52,3 [48,5; 53,6] | 1,4 [0,6; 2,9] | 0,827; <0,001*; <0,001* |
ИЛ-10 (пг/мл) | 17,5 [15,4; 18,3] | 13 [9,3; 15,2] | 6,8 [3,4; 9,1] | 0,046*; <0,001*; <0,001* |
Примечание: n – число пациентов в группе, р1 – вероятность различий в группах больных ГЛПС разной степени тяжести, р2 – вероятность различий в группах больных среднетяжелого течения ГЛПС и контроля, р3 – вероятность различий в группах больных тяжелого течения ГЛПС и контроля, * – достоверность различий по критерию Манна-Уитни при р <0,05
В лихорадочный период наблюдался рост содержания в крови цитокинов, сопряженных с клеточными (цитотоксическими) иммунными реакциями: ИЛ-12, ИФНγ, ФНОα, ФНОβ. Кроме того, наиболее значительно возрастал уровень ИЛ-10 – цитокина с иммуносупрессорными и противовоспалительными свойствами. Уровни остальных цитокинов, в том числе провоспалительного действия (ИЛ-1β, ИЛ-6), достоверно снижались. При этом совсем не выявлялись различия между цитокиновыми профилями больных со среднетяжелым и тяжелым течением ГЛПС.
В олигоурический период характер цитокинового профиля во многом изменился. К основным особенностям этого периода можно отнести примерно 2-кратное снижение уровня в крови ИЛ-10 при достоверном нарастании уровня ИЛ-6, особенно при тяжелом течении ГЛПС.
В полиурический период опять значительно возрос уровень ИЛ-10, содержание ИЛ-6 в крови оставалось на прежнем высоком уровне, а у цитокинов, участвующих в развитии клеточных цитотоксических реакций (ИЛ-12, ФНОα, ФНОβ) уровень содержания в крови при тяжелом течении заболевания был достоверно выше, чем при среднетяжелом течении.
Описанные тенденции изменения цитокинового профиля прослеживаются и в период реконвалесценции только с тем отличием, что достоверный характер различий между тяжелым и среднетяжелым течением ГЛПС на уровне цитокинового профиля проявлял только ИЛ-10, уровень которого в первом случае был выше.
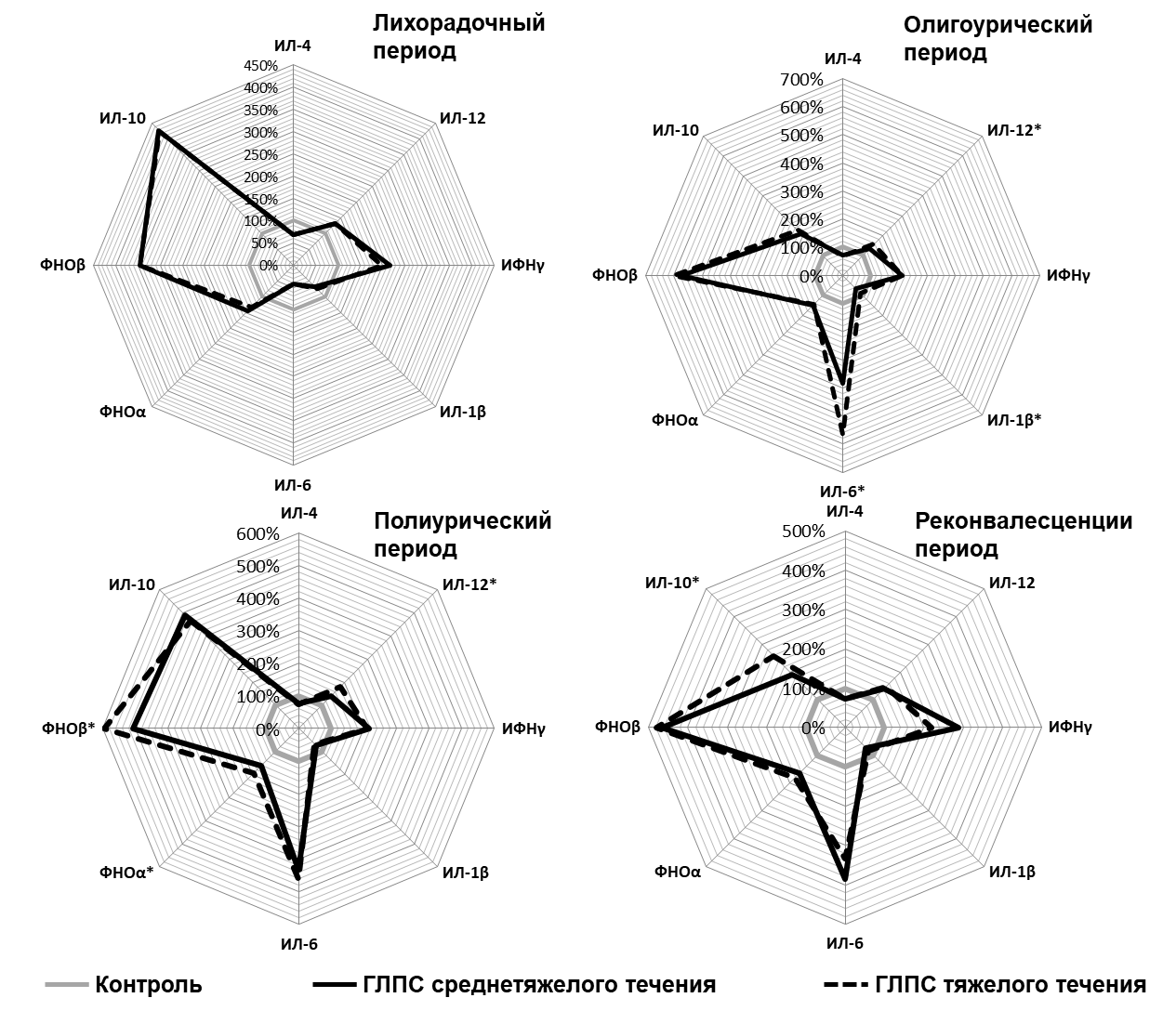
Рисунок 1 - Проценты отклонения от контроля цитокинового профиля крови пациентов с ГЛПС разного течения
Как следует из рисунка 2, все тестированные цитокины оказались в той или иной степени связанными между собой с преобладанием прямых корреляционных связей. Наибольшее функционально-регуляторное значение, судя по количеству корреляционных связей, имели ИЛ-12, продуцируемый преимущественно моноцитами, и ФНОβ, продуцируемый преимущественно Т-хелперами 1-го типа.
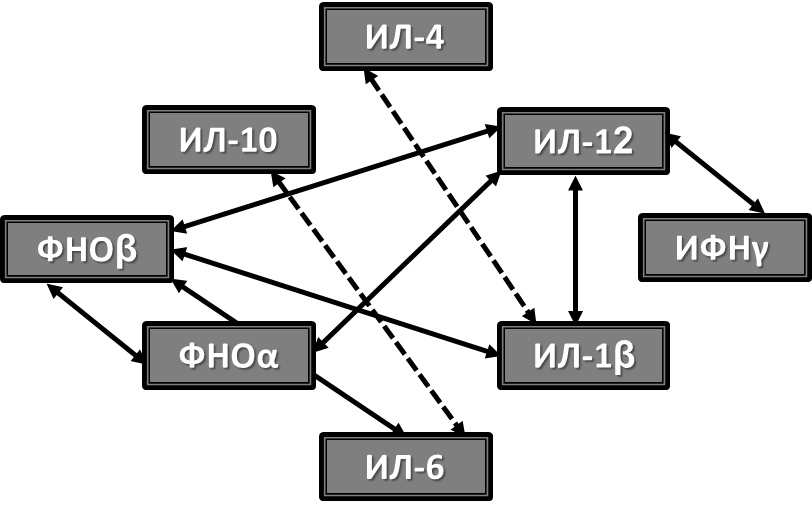
Рисунок 2 - Достоверные корреляционные связи между цитокинами при ГЛПС
Примечание: сплошная линия – положительные корреляции, пунктирная линия – отрицательные корреляции
4. Обсуждение результатов
Основным итогом исследования цитокинового профиля при ГЛПС послужили данные о ключевой роли цитокинов, способных принимать участие в цитотоксическом повреждении пораженных хантавирусами клеток. К числу этих цитокинов относятся ИЛ-12, ФНОα, ФНОβ, в меньшей степени – ИФНγ. Эти данные находят свое подтверждение и в современной научной литературе.
Особое значение в патогенезе ГЛПС придается провоспалительному и проапоптотическому цитокину ФНОα , , . Этот цитокин вырабатывается как клетками врожденного иммунитета (нейтрофилами, естественными киллерами, дендритными клетками, моноцитами/макрофагами), так и специфическими Т-лимфоцитами (CD8 + ЦТЛ) , .
ФНОα оказывает при ГЛПС двоякое действие. С одной стороны, он нарушает репликацию хантавирусов, способствуя клеточному апоптозу инфицированных клеток, а с другой стороны, этот же эффект усугубляет поражение эндотелия сосудов при данном заболевании , усиливает нетоз нейтрофилов . Некоторые авторы отмечают, что лечебное воздействие рибавирина при ГЛПС снижает неблагоприятные эффекты ФНОα .
Отмечено также, что генетический полиморфизм, связанный с высокой продукцией ФНОα, сочетается с более тяжелым течением ГЛПС . В то же время подчеркивается, что при низком уровне ФНОα диссеминация хантавирусов происходит быстрее, поскольку N белок возбудителя конкурирует с этим цитокином, присоединяясь к его рецепторам . В научной литературе подчеркивается также, что характерным для ГЛПС является рост ФНОβ – цитокина, который, по нашим данным, может претендовать даже на ключевую роль наряду с ИЛ-12.
Особо следует прокомментировать патогенетическое значение ИЛ-6. Значение этого цитокина при ГЛПС отмечено и в литературе. Так, показана способность ИЛ-6 снижать секрецию ФНОa и, особенно, интерлейкина-1 , активировать продукцию печенью белков острой фазы воспаления и стимулировать гипоталамо-гипофизарно-надпочечниковую систему . Более того, ИЛ-6 может вызывать повышение уровня антидиуретического гормона в крови и влиять таким образом на время наступления олигурического периода ГЛПС, что совпадает и с нашими данными по началу выраженной экспрессии этого цитокина с началом именно олигоурического периода.
В последние годы появились сведения о том, что ИЛ-6 может нарушать дифференцировку регуляторных Т-клеток в пользу Т-хелперов-17, определяющих развитие системного воспаления . В связи с этим целесообразно в дальнейшем рассмотреть перспективы использования при ГЛПС тяжелого течения таргетной терапии с использованием анти-ИЛ-6 моноклональных антител.
Отдельного внимания, с нашей точки зрения, заслуживает тот факт, что этот цитокин оказался связан достоверной негативной корреляцией с ИЛ-10. Дело в том, что ИЛ-10 придается особое значение в патогенезе ГЛПС. Этот цитокин секретируется как моноцитами, так и Т-хелперами, и способствует дифференцировке регуляторных Т-клеток (Трег), обладающих иммуносупрессорной активностью и способных секретировать в числе своих цитокинов и ИЛ-10 . Некоторые авторы придают этой особенности иммунного реагирования на хантавирусы как фактору, снижающему воспалительно-деструктивные процессы при ГЛПС , в то же время есть точка зрения, что именно рост числа FoxP3+ Т-лимфоцитов (Трег) определяет тяжесть течения хантавирусной инфекции . Полученные нами данные позволяют предположить, что патогенетическое значение ИЛ-10 может меняться в зависимости от стадии ГЛПС – в начале заболевания преобладают защитные свойства этого цитокина в виде снижения клеточной деструкции и воспалительных реакций, в конце заболевания – ИЛ-10 способствует завершению иммунного процесса, раннее наступление которого, например, при тяжелом течении ГЛПС, может провоцировать развитие резидуальных явлений.
Целесообразно отметить, что наблюдаемый характер отклонения цитокинов провоспалительного/противовоспалительного действия при ГЛПС, связанный с возможностью развития при данном заболевании цитокинового шторма, не уникален. Аналогичные отклонения наблюдаются и при других вирусных инфекциях, например, при Covid-19 . Однако степень этих отклонений, связь со стадиями заболевания, участие в ведущих патогенетических механизмах инфекционного процесса различаются, о чем свидетельствуют как данные литературы , так и полученные нами результаты.
5. Заключение
Обобщая полученные результаты можно констатировать, что цитокиновый профиль у больных ГЛПС отражает основные иммунологические механизмы при данном заболевании и зависит от стадии течения инфекционного процесса. Про этом количественные параметры содержания цитокинов в крови больных ГЛПС соответствуют тяжести течения заболевания.
Среди тестированных цитокинов провоспалительного и противовоспалительного действия наибольшее диагностическое и патогенетическое значение имеет динамика ИЛ-12, ФНОα, ФНОβ, ИЛ-6 и ИЛ-10. В результате проведенного анализа отмечено потенциальное значение соотношение цитокинов ИЛ-6 и ИЛ-10 для совершенствования схемы терапевтического воздействия при ГЛПС.
