ОЦЕНКА СОЧЕТАНИЯ АНАЛЬГЕЗИИ/АНЕСТЕЗИИ С УМЕРЕННОЙ ГИПОТЕРМИЕЙ НА МОДЕЛИ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ У КРЫС В ЭКСПЕРИМЕНТЕ
ОЦЕНКА СОЧЕТАНИЯ АНАЛЬГЕЗИИ/АНЕСТЕЗИИ С УМЕРЕННОЙ ГИПОТЕРМИЕЙ НА МОДЕЛИ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ У КРЫС В ЭКСПЕРИМЕНТЕ
Аннотация
Достоверно известно, что гипотермия одна из действенных мер лечебного воздействия после экспериментальной черепно-мозговой травмы. Цель исследования – оценить сочетание наркотической анальгезии/анестезии с умеренной гипотермией на модели ЧМТ у крыс в эксперименте. Вопреки нашей гипотезе, объем поражения, оцененный через 72 часа после ЧМТ, был заметно больше у крыс, в группе с гипотермией (p < 0,05). Репрезентативные фронтальные срезы головного мозга подтвердили, что объем контузии был почти в двое больше у животных с гипотермией в сравнении с нормотермией. У животных в группе №2, отмечались более выраженные структурные изменения в веществе мозга, проявляющееся наличием участков локального отека и преимущественно корковыми кровоизлияними и зонами периваскулярного отека.
1. Введение
Достоверно известно, что гипотермия одна из действенных мер лечебного воздействия после экспериментальной черепно-мозговой травмы (ЧМТ), однако, несмотря на огромный потенциал применения гипотермии после ЧМТ в эксперименте, в клинической практике встречаются противоречивые результаты. Это очевидное несоответствие может быть связано с рядом факторов, обусловленных экстраполяцией результатов экспериментальных моделей в клиническую практику.
Одной из потенциальных причин являются различия в режимах анестезии/анальгетиков в экспериментальных и клинических условиях. Выбор анестетика/анальгетика после ЧМТ может существенно повлиять на исход. В большинстве экспериментальных моделей ЧМТ гипотермия применялась к грызунам, подвергнутым анестезии ингаляционными анестетиками, такими, как изофлюран, галотан, эфир анестетический. В то же время в литературе встречается информация о том, что комбинация Ксилазин гидрохлорид + «Золетил 100» обладают определенной нейропротекцией
, , . Поскольку гипотермия продемонстрировала такое достоверное преимущество в экспериментальных моделях, казалось логичным, что гипотермия будет терапевтическим вмешательством, исследованным на крысах, получающих наркотическую анестезию/анальгезию после ЧМТ.Цель исследования – оценить сочетание наркотической анальгезии/анестезии с умеренной гипотермией на модели ЧМТ у крыс в эксперименте.
2. Методы и принципы исследования
Все манипуляции с животными проводились в соответствии с Руководством по содержанию и использованию лабораторных животных
. Эксперимент проводился на 20 животных (нелинейные белые крысы обоего пола массой 220-335 г.). Животным выполнено анестезиологическое пособие (наркоз), включающее интраперитонеальное введение (и/п) препаратов: «Ксилазина гидрохлорида» (из расчета 0,5 мл/кг массы тела) и «Золетил 100» (из расчета 8мг/кг массы тела) . Выполнялась респираторная поддержка. Моделирование черепно-мозговой травмы наркотизированным животным проводилось по стандартной методике . После чего трепанационное окно закрывалось цементом для пломбирования, кожа подшивалась. Животные были разделены на группы: Группа 1 (n=10) – ЧМТ + нормотермия (температура головного мозга поддерживалась на уровне 37 ± 0,5°С).Группа 2 (n=10) – ЧМТ+ гипотермия (крыс обкладывали гипотермическими пакетами-контейнерами, до достижения температуры мозга 32°С.). Гипотермию поддерживали в течение 1 часа, затем крыс отогревали постепенно в течение 1 часа со скоростью +1°C каждые 10-12 минут с помощью электрической грелки.
На аппаратном комплексе «BIOPAC» в соответствии со стандартными методиками производился мониторинг температуры тела, парциального давления кислорода (Р02), парциального давления углекислого газа (РС02), среднего артериального давления (САД), частоты сердечных сокращений (ЧСС), рН
. На 3 сутки часть животных выводилась из эксперимента путем эвтаназии, под наркозом, с соблюдением всех принципов гуманного отношения к животным. Полученный биоматериал (головной мозг) фиксировали в 10% растворе формалина, осуществлялось иссечение биоматериала, заливка в парафин, приготовление срезов, с последующим окрашиванием гематоксилином и эозином по стандартной методике.Статистическую обработку полученных данных проводили при помощи пакета программ «Statistica 10.0». Был применен параметрический t-критерий Стьюдента и критерий Манна-Уитни. Результаты представлены следующим образом, М ± m (М – среднее, m – ошибка среднего). Различия принимались за статистически значимые при p < 0,05.
3. Основные результаты
Температура головного мозга (Тгм), и ректальная температура (Тр) были значительно ниже во время гипотермического периода у крыс, с гипотермией, в сравнении с группой нормотермии (Тгм (группа 2) = 32,1 ± 0,1 Сº в сравнении с Тгм (группа 1) = 37,3 ± 0,04 °C, p < 0,05; Тр (группа 2)= 32,0 ± 0,1Сº в сравнении с Тр (группа 1)= 37,3 ± 0,1Сº, р < 0,05). Мозговая и ректальная температуры не отличались между группами до ЧМТ и в конце обогрева. Статистически значимых различий между остальными исследуемыми параметрами в рамках данного эксперимента не было выявлено (см. таб. 1).
Таблица 1 - Показатели САД, ЧСС, PO2, PCO2, pH, температуры головного мозга, и ректальной температуры через 1 час с момента начала эксперимента
Показатель | Группа 1 (n=10) – ЧМТ + нормотермия | Группа 2 (n=10) - ЧМТ+ гипотермия |
САД, мм.рт ст. | 123,45 ± 17,04 | 121,37 ± 13,21 |
Частота сердечных сокращений (ЧСС), (уд. в мин) | 332,4 ±6,9 | 332,8 ±7,1 |
PО2, мм.рт ст. | 55,8±3,1 | 54,7±3,2 |
PCО2, мм.рт ст. | 48,8±8,1 | 46,5 ± 7,2 |
pH | 7,42±0,01 | 7,42±0,01 |
Температура головного мозга (Тгм), Сº | 37,3 ± 0,04 | 32,1 ± 0,1* |
Температура ректальная (Тр),Сº | 37,3 ± 0,1С | 32,0 ± 0,1* |
Примечание: * – различия статистически значимы по отношению к группе 1 (р < 0,05)
Вопреки нашей гипотезе, объем поражения, оцененный через 72 часа после ЧМТ, был заметно больше у крыс, в группе с гипотермией (p < 0,05). Репрезентативные фронтальные срезы головного мозга подтвердили, что объем контузии был почти в двое больше у животных с гипотермией в сравнении с нормотермией. Умеренная гипотермия оказалась скорее вредной, чем полезной после экспериментальной ЧМТ у наркотизированных крыс (рис. 1).
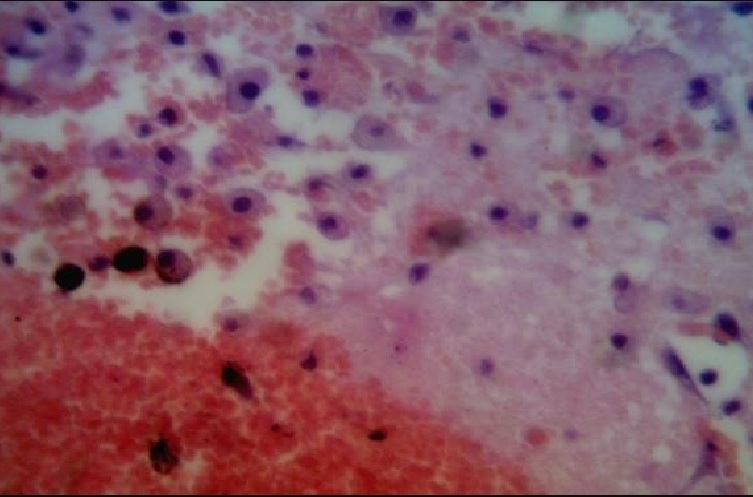
Рисунок 1 - Пример микрофотография коры полушарий головного мозга через 72 часа от начала эксперимента у крыс в группе №2, х100, окр. гематоксилин + эозин
Применение умеренной гипотермией в одиночку недостаточно, чтобы ослабить посттравматическую эксайтотоксичность . Еще одной причиной, почему после ЧМТ гипотермия и анестезиологическое обеспечение, включающее Ксилазин гидрохлорид + «Золетил 100» и/п неспособны обеспечить нейропротекцию, связано с СМК. На фоне ЧМТ стремительно развивается гипоперфузия, а системная гипотермия может еще больше снизить CМК, что можно наблюдать на экспериментальных моделях ЧМТ, вызванных жидкостно-перфузионным повреждением
, . По результатам нашего эксперимента, можно предположить, что комбинация ксилазин-золетилового наркоза и гипотермия после ЧМТ, возможно усиливает несоответствие перфузии и метаболизма головного мозга и дополнительно инициирует повреждение нейронов, но требуется проведение дальнейших исследований в этой области.Измененный метаболизм препарата с последующей прямой нейротоксичностью также может снижать эффективность гипотермии после ЧМТ с ксилазин-золетиловым наркозом. Другие механизмы также могут способствовать неблагоприятным последствиям гипотермии после ЧМТ на фоне применения ксилазин-золетилового наркоза. Гипотермия влияет на множество других каскадов повреждений, которые мы не обсуждали в данной статье, включая посттравматический окислительный стресс и экспрессию генов. Эффективность посттравматической гипотермии может варьироваться в зависимости от степени тяжести травмы, оказывая более высокие результаты при легкой ЧМТ. Хотя долгосрочные гистопатологические и функциональные результаты еще предстоит определить.4. Заключение
Удивительно, но объем контузии увеличился за счет применения умеренной гипотермии сразу после ЧМТ у крыс под ксилазин-золетиловым наркозом. Поскольку лечение с помощью гипотермии обеспечило достоверное преимущество при экспериментальной ЧМТ с анестезией ингаляционными анестетиками, это позволяет предположить, что режим анестезии/анальгетика после ЧМТ может резко влиять на ответ на другие терапевтические вмешательства, такие как гипотермия, но для установления корреляционных параллелей требуется проведение дальнейших исследований.
