Методы оценки окислительного стресса в качестве потенциальных биомаркеров при НАЖБП
Методы оценки окислительного стресса в качестве потенциальных биомаркеров при НАЖБП
Аннотация
Неалкогольная жировая болезнь печени (НАЖБП) признана неинфекционной эпидемией современных промышленно-развитых стран. НАЖБП начинается с простого стеатоза и прогрессирует в неалкогольный стеатогепатит, характеризующийся воспалением, фиброзом, апоптозом, окислительным стрессом, перекисным окислением липидов, приводящим в конечном итоге к циррозу печени и гепатоцеллюлярной карциноме. Известно, что окислительный стресс играет важную роль в патогенезе и тяжести НАЖБП. Для оценки патологического состояния и прогрессирования заболевания используется ряд маркеров окислительного стресса. В статье рассмотрены несколько биомаркеров окислительного стресса, которые можно измерить в клинической практике и которые могут быть полезны с диагностической целью.
1. Введение
Неалкогольная жировая болезнь печени (НАЖБП) – хроническое заболевание печени метаболического генеза у лиц с отсутствием экзогенных факторов токсического поражения печени (напр., экзогенный этанол), обусловленное накоплением липидов в составляющих печеночную дольку клеточных элементах, морфологически подтверждаемое стеатозом, стеатогепатитом, фиброзом или циррозом печени (ЦП) [1]. Диагноз НАЖБП верифицируется при накоплении липидов в виде триглицеридов (ТГ) в количестве более 5–10% массы гепатоцитов или при наличии более 5% печеночных клеток, содержащих депозиты липидов [1]. НАЖБП начинается с простого стеатоза и прогрессирует в неалкогольный стеатогепатит (НАСГ), характеризующийся воспалением, фиброзом, апоптозом, окислительным стрессом, перекисным окислением липидов [2]. Диагностика НАЖБП имеет особое значение из-за вероятности ее прогрессирования в ЦП или развития гепатоцеллюлярной аденокарциномы (ГЦК) [3], [9]. Кроме того, в случае диагностики на ранних стадиях можно предотвратить обострение заболевания, применяя такие простые подходы, как повышение физической активности и модификация диеты. В настоящее время золотым стандартом диагностики неалкогольной жировой болезни печени является биопсия печени, но этот метод не только инвазивен и дорог, но и имеет такие важные ограничения, как отказ пациентов от исследования ввиду возможных болевых ощущений, риск тяжелых осложнений, при взятии пробы, содержащий неповрежденный участок [4], [5].
Известно, что окислительный стресс (ОС) играет важную роль в патогенезе и утяжеляет течение НАЖБП [6]. Центральную роль в механизмах развития НАЖБП играет индукция ОС, ведущая к стимуляции процессов перекисного окисления липидов (ПОЛ), гиперпродукции цитокинов и к возникновению воспалительных изменений в печени [7], [8].
Ряд маркеров окислительного стресса используют для оценки патологического состояния и прогрессирования заболевания. Однако, диагностика НАЖБП все еще остается предметом дискуссий из-за наличия различных форм заболевания и морфологических изменений. На данный момент ни один маркер не является достаточным для диагностики и стадирования заболевания, и применение панели, включающей различные типы тестов, может быть более полезным. В этой статье мы рассмотрим несколько биомаркеров окислительного стресса, которые были определены на клиническом и экспериментальном уровнях по данным литературы при НАЖБП.
2. Окислительный стресс в патогенезе НАЖБП
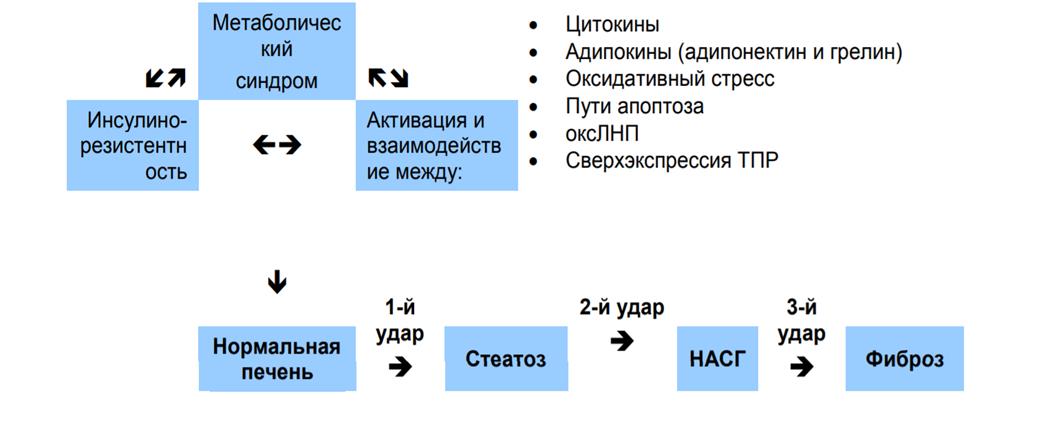
Рисунок 1 - «Гипотеза множественных ударов» НАЖБП
Примечание: оксЛНП – оксидированный липопротеин низкой плотности; ТПР – толл-подобный рецептор; источник: «Глобальные практические рекомендации всемирной гастроэнтерологической организации, неалкогольная жировая болезнь печени и неалкогольный стеатогепатит», 2012
Патофизиология НАЖБП первоначально объяснялась гипотезой «двух ударов» [10], [11]. Согласно этой гипотезе, первый удар отвечает за развитие стеатоза (накопление жира в печени), а второй - за ОС, вызывающий перекисное окисление липидов и прогрессирование от стеатоза до НАСГ [9], [11], [12]. В 2010 году патогенез НАЖБП был пересмотрен, Tilg and Moschen описали теорию «множественных ударов» в развитии НАЖБП (Рис.1) [13], [14]. В этой гипотезе метаболический синдром играет главную роль из-за инсулинорезистентности (ИР) и воспалительного процесса, опосредованного взаимодействием различных белков и иммунной системы [15]. Под воздействием генетических, экологических факторов, ожирения, воздействия микробиоты повышается уровень свободных жирных кислот (СЖК) и холестерина (ХС), развиваются ИР, пролиферация и дисфункция адипоцитов [13], [14]. В «теории множественных ударов» наиболее значимым фактором также является ОС [28].
Увеличенный поток СЖК в печень приводит к повышенному β-окислению СЖК и дисфункции митохондрий с ОС. [14], [15], [16], [17]. В свою очередь, митохондриальная дисфункция увеличивает производство прооксидантных веществ (активных форм кислорода и азота) и воспалительных цитокинов. Компоненты множественных «ударов» еще не полностью определены и требуют дополнительных исследований. Понимание механизма ОС, его регуляции, а также его роли в НАЖБП является важным для исследований, так как поможет в выборе биомаркеров для клинической диагностики НАЖБП.
ОС определяется как дисбаланс между продукцией прооксидативных веществ (свободные радикалы, СР) и состоянием защитной антиоксидантной системы [39].
ОС классифицируется по степени тяжести как «эустресс» (физиологический окислительный стресс) и «дистресс» (токсическое повреждающее молекул). Другими словами, низкое воздействие ОС полезно для окислительно-восстановительной реакции, тогда как высокое воздействие приводит к нарушению окислительно-восстановительной системы и вызывает повреждение важных молекул. При дистрессе высокая концентрация свободных радикалов приводит к повреждению различных клеточных структур за счет их окисления, таких как митохондии, органеллы, ДНК, белки, липиды и мембраны, таким образом, способствуя развитию многочисленных хронических заболеваний, включая НАЖБП. [18], [20]
Прооксидантые вещества – это активные формы кислорода (АФК), кислородсодержащие молекулы, которые проявляют более высокую химическую реактивность, чем кислород (O2), и активные формы азота (АФА), химически реактивные виды, содержащие кислород, азот и др. [41] (табл. 1). Некоторые АФК являются свободными радикалами (например, гидроксильный радикал, супероксидный радикал, они образуются in vivo преимущественно митохондриальной дыхательной цепью при окислительном метаболизме энергетических субстратов), другие АФК не являются радикалами (например, перекись водорода, хлорноватистая кислота, перекиси липидов и т.д.) [40].
АФА также подразделяются на свободные радикалы (оксид азота, диоксид азота и т.д.), и не свободные радикалы (триоксид динитрогена, пероксинитрит и др). (табл. 2) [40].
В небольшом количестве АФК являются важными для нормального функционирования иммунного ответа, метаболизма, а также клеточной пролиферации и дифференциации. В избытке АФК и АФА являются звеньями патогенеза при развитии различных заболеваний. Среди них особую патогенетическую роль играют супероксидный радикал и гидроксильный радикал (за счет их высокой химической активности) [29]. АФК и АФА обладают коротким жизненным циклом и поэтому являются сложными для измерения.
Таблица 1 - Основные АФК, имеющие патофизиологическое значение
Основные АФК |
| Источники |
Свободные радикалы | Гидрооксид радикал (∙OH) | Распад гидропероксидов путем взаимодействия активных молекул кислорода с водой |
Супероксидный радикал (O∙-2) | 1) Дыхательная цепь митохондрий; 2) Восстановление ксилорода ферментативным путём под действием таких ферментов, как NADPH-оксидазы | |
Гидроксильный радикал (HOОО•) | Образуется в реакции Фентона (реакция перекиси водорода с ионами железа, которая используется для разрушения многих органических веществ) | |
Нерадикальные вещества | Перекись водорода (H2O2) | Выделяется активированными макрофагами во время воспаления |
Гипогалоиды (HOCl, НОCI, НОBr, НОI, НОSCN) | Комбинированная активность NADPH-оксидазы и миелопероксидазы в фагоцитах | |
Гидроперекиси липидов (LООH) | Образуется в результате окисления полиненасыщенной жирной кислоты через реакцию липид-пероксильного радикала |
Таблица 2 - Основные АФА, имеющие патофизиологическое значение
Основные АФА |
| Источники |
Свободные радикалы | Монооксид азота II (NO•) (Оксид азота (II)) | Синтаза оксида азота - группа ферментов, катализирующих образование оксида азота и цитруллина из аргинина, кислорода и NADPH. |
Диоксид азота (NO∙2) (Оксид азота (IV)) | Активированные нейтрофилы | |
Нерадикальные вещества | Азотистый ангидрид (Оксид азота (III)) (N2O3) | Вырабатывается в патологических условиях, когда индуцибельная NO-синтаза повышена |
Пероксинитрит (ONOO−) | Образуется при реакции NO с супероксидом и, в свою очередь, вызывает образование других реактивных форм азота | |
Нитрит натрия (NO−2) | Продукт окисления оксида азота, образующийся при воспалительных заболеваниях | |
Ион нитрония (NO+2) | Активированные нейтрофилы |
Одним из источников СР, принимающих непосредственное участие в ПОЛ, является система цитохромов Р450 [30]. СР запускает ПОЛ, приводит к высвобождению малонового диальдегида (МДА) и 4-гидроксиноненала, индуцирует образование ряда цитокинов: фактора некроза опухоли альфа (ФНО α), тканевого фактора роста бета (ФР β), интерлейкина 6, 8 (ИЛ 6,8), которые играют ключевую роль в развитии воспаления и последующего фиброза [19], [20]. Чрезмерная продукция СР приводит к некрозу гепатоцитов, развитию воспалительной клеточной инфильтрации в портальных трактах и печеночных дольках. Таким образом, все эндогенные внутриклеточные источники прооксидантных веществ (митохондрии, эндоплазматический ретикулум, цитохром Р450, пероксисомы) активируют каскад реакций, приводящих к формированию стеатогепатита и прогрессированию НАЖБП [21].
Продукты ПОЛ, в частности МДА, который может стимулировать производство колдагена, некроз гепатоцитов, провоспалительные цитокины служат активаторами стеллатных (звездчатых) клеток, стимуляция которых сопровождается избыточной продукцией компонентов соединительной ткани с развитием перисинусоидального или перипортального фиброза, а при длительно текущем процессе — цирроза печени (ЦП) и гепатоцеллюлярной карциномы [20], [27].
3. Измерение маркеров окислительного стресса при НАЖБП
По данным исследований в настоящее время в качестве потенциальных неинвазивных биомаркеров окислительного стресса используются: продукты перекисного окисления липидов (липидный пероксид, малондиальдегид (МДА) и 4-Гидрокси-транс-2-ноненаль), 8-изопростан (продукт свободнорадикального окисления арахидоновой кислоты), продукты окислительной модификации аминокислот (3-нитротирозин, 2-оксогистидин и гидроксипролин), продукты повреждения ДНК, изоформы цитохрома P450, цитокины. [22], [23], [24] (Таблица 3).
Таблица 3 - Потенциальные неинвазивные биомаркеры окислительного стресса
Макромолекулы | Оксидативный стресс | Продукты повреждения |
Липиды | Перекисное окисление липидов | Малоновый диальдегид (МДА) |
4-гидроксиноненал | ||
Диеновые конъюгаты | ||
8-изопростан | ||
Белки | Окисление белков, перекрестная связь белков, окислительная модификация аминокислот | Карбонильные соединения (альдегиды, кетоны) |
Нитротирозин | ||
2-оксогистидин | ||
Гидроксипролин | ||
ДНК | Фрагментация РНК/ДНК (однонитевые и двунитевые разрывы) | 8-Оксо-2-дезоксигуанозин |
Модификация оснований, сахаров | 8-Оксогуанин | |
Цитохром Р450 | Изоформы цитохрома Р-450 | CYP2E1, CYP4A |
Цитокины | Перекисное окисление липидов, оксидативный стресс | ФНО α, ФР β, ИЛ 6,8 |
Маркеры окислительного стресса измеряются в печени, сыворотке, плазме и, в некоторых случаях, в образцах цельной крови. Основные методы анализа для обнаружения этих маркеров включают колориметрию, ИФА и иммуногистохимию.
По данным литературы в таблице 4 структурированы результаты измерения биомаркеров окислительного стресса, которые были определены на экспериментальных моделях НАЖБП. Были проанализированы результаты исследований в плазме и цельной крови, таких биомаркеров, как продукты повреждения липидов (перекиси липидов, МДА, 8-изопростан), продукты окисления белков, продукт окисления ДНК (8-OH-дезоксигуанозин), изоформы цитохрома Р-450 и цитокины (таблица 4). 8-изопростан также лучше определять в моче, так как в плазме быстрее происходит его распад на молекулы [38]. Повышенный уровень продукта ПОЛ 4-гидроксиноненала по данным, найденных нами исследований, был определен только в печени [45].
Концентрация/активность этих биомаркеров повышается, как правило, во всех рассмотренных клинических данных. По данным литературы во всех экспериментальных моделях НАЖБП МДА является наиболее удобным и достоверным биомаркером окислительного стресса [25], [31], [32].
Таблица 4 - Биохимические маркеры ОС, измеряемые при НАЖБП
Маркеры оксидативного стресса | Ткань | Динамика показателей |
Перекиси липидов | Плазма | ↑ [42] |
Малоновый диальдегид (МДА) | Плазма | ↑ [31, 32] |
Кровь | ↑ [25, 32] | |
8-изопростан | Плазма | ↑ [46] |
Моча | ↑ [38] | |
Оксид азота | Кровь | ↑ [43] |
Плазма | ↑ [44] | |
Изоформы P-450 | Кровь | ↑ [26] |
ФНО α | Кровь | ↑ [33, 34, 35, 36] |
ИЛ 6 | Кровь | ↑ [37] |
4. Заключение
Окислительный стресс играет важную роль в патофизиологии НАЖБП/НАСГ. Было показано, что несколько маркеров окислительного стресса важны для оценки окислительно-восстановительного состояния при НАЖБП. Среди рассмотренных биомаркеров окислительного стресса наиболее достоверными являются МДА, изоформы цитохрома Р-450, 8-изопростан. На данный момент ни один биомаркер не позволяет провести дифференциальную диагностику между стеатозом и НАСГ. Требуется продолжение исследований для разработки панелей биомаркеров для улучшения точности диагностики НАЖБП и НАСГ в частности.
