Роль структуры фрагментов сульфокислоты [алкил(арил)сульфонил]-триазолов в развитии адаптаций у Paramecium caudatum Ehrenberg
Роль структуры фрагментов сульфокислоты [алкил(арил)сульфонил]-триазолов в развитии адаптаций у Paramecium caudatum Ehrenberg
Аннотация
Исследовали токсичность 1,2,4-триазола и 1,2,4-триазолидов метан-бензол и п-толуолсульфокислот для Paramecium caudatum Ehrenberg, а также способность инфузорий приспосабливаться к их токсичности. Обнаружили, что синтезированные соединения достоверно отличаются по токсичности, с увеличением концентрации и времени их воздействия она возрастает. Было проведено предварительное культивирование инфузорий в течение 10 дней в водных растворах [алкил(арил)сульфонил]-триазолов в концентрации 0,0001 мг/мл. Затем инфузории переносили в растворы этих же веществ в концентрации 0,1 и 1 мг/мл и исследовали смертность. Оказалось, что на способность инфузорий адаптироваться влияет структура фрагмента сульфокислоты триазолидов. Лучше всего приспособление идёт к триазолидам, в состав которых входит метильная группа.
1. Введение
Понимание механизмов, с помощью которых организмы адаптируются к быстрым изменениям окружающей среды вследствие антропогенного воздействия, стало одним из важных вопросов в биологии, потому что адаптации являются основой эволюции. В своей фундаментальной работе Хочачка и Сомеро рассмотрели биохимические механизмы, лежащие в основе адаптаций [1]. Они утверждают, что уровень обмена веществ, и в частности энергетического метаболизма, определяют адаптивные возможности организма. Усилия ученых последних десятилетий были направлены на поиск биохимических механизмов адаптаций [2, С.127]. Они предположили, что организмам проще мигрировать из зоны, содержащей ксенобиотики, чем перестроить метаболизм клеток. По этой причине только у неподвижных форм можно одновременно наблюдать разные формы биохимических приспособлений после воздействия ксенобиотиками [3, С. 35].
Между тем существует ряд исследований, показавших, что строение и концентрация антропогенного ксенобиотика играет немаловажную роль в способности организмов адаптироваться [4, С.108], [5, С. 76-78], [6, С. 121].
Одной из перспективных групп организмов-индикаторов, позволяющих быстро выявить адаптивную реакцию организмов, являются протисты, в частности, инфузории. Их высокая чувствительность к токсическому действию различных поллютантов позволяет обнаружить загрязнения на самых ранних стадиях и при незначительных концентрациях [7, С.13].
Поэтому для выяснения роли структурных фрагментов производных 1,2.4-триазола в развитии биологического ответа мы использовали Paramecium caudatum Ehrenberg. Для исследования выбраны производные алкил- и арилсульфокислот 1,2,4-триазола, а также исходный 1,2.4-триазол.
2. Материал и методы
Общая методика получения [алкил(арил)сульфонил]-триазолов (I-III).
В раствор 1,2,4–триазола в безводном растворителе (ТГФ) добавили эквимольное количество триэтиламина и при перемешивании внесли по каплям эквимольное количество раствора хлорангидрида соответствующей сульфокислоты в безводном растворителе. После перемешивания в течение 1 часа выпавший осадок гидрохлорида триэтиламмония отфильтровали, фильтрат упарили в вакууме. Получили масло, закристаллизовавшееся при охлаждении (0+5ºC). Продукт реакции очищали перекристаллизацией из бензола. Получили белое мелкокристаллическое вещество.
1-(Метилсульфонил)-1Н-1,2,4-триазол (I). Выход 61%, т.пл. 90–91°C, ИК спектр, n, см−1: 1366, 1138 (–SO2N), 1324 (CH3–S); Спектр ЯМР 1Н (400 МГц, ДМСО-d6, внутренний стандарт - ТМС), d, м.д.: 3.43 с (3H CH3), 8.13 с (1H, H5 Het), 8.69 с (1H, H3 Het).
4-(Фенилсульфонил)-4Н-1,2,4-триазол (II). Выход 64%, т.пл. 102–103°C, ИК спектр, n, см−1: 1328, 1155 (–SO2N); Спектр ЯМР 1Н (400 МГц, ДМСО-d6, внутренний стандарт - ТМС), d, м.д.: 7.54 м (2H, H3, H5), 7.63 м (1H, H4), 7.73 м (2H, H2, H6), 8.31 с (2H, Н2, H5 Het).
4-(Толилсульфонил)-4Н-1,2,4-триазол (III). выход 61%, т.пл. 98–99°C, ИК спектр, n, см−1: 1375, 1141 (–SO2N); Спектр ЯМР 1Н (400 МГц, ДМСО-d6, внутренний стандарт - ТМС), d, м.д.: 2.32 с (3H CH3), 7.32 м (2Н, H3, H5), 7.66 м (2H, H2, H6), 8.30 с (2H, Н2, H5 Het).
Объектом исследования служили инфузории Paramecium caudatum Ehrenberg из моноклональной линии, выделенной из проб, взятых в Саратовском водохранилище. Инфузории содержались в органической среде на основе дрожжевого отвара [8, С.207-212] по методике полунепрерывного культивирования с ежедневной заменой части среды [9].
Инфузории содержали при температуре +24 ºС. В качестве культиваторов использовали стеклянные плоскодонные колбы объемом 100 мл.
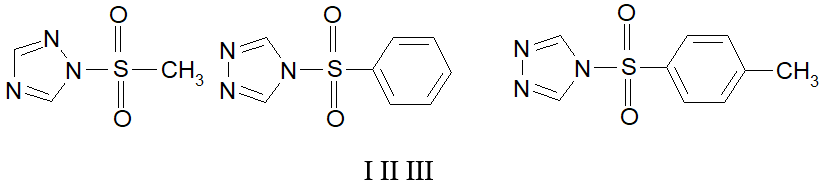
Рисунок 1 - Используемые растворы
Серия 1
С помощью микропипетки из культуры отбирали по 10 штук инфузорий и вносили в лунки планшета для исследования таким образом, чтобы для каждой концентрации синтезированного триазолида анализировали не менее 36 лунок. Объем среды в лунке доводили до 100 мкл путем добавления чистого раствора исследуемого вещества рабочей концентрации. Затем через 1 и 3 часа проводили подсчет погибших клеток. Каждый эксперимент проводили в трех повторах.
Серия 2
В течение 10 дней культура Paramecium caudatum Ehrenberg адаптировалась исследуемыми соединениями. Ежедневно сливали 1/3 объема культуры и доливали такое же количество питательной среды с исследуемым веществом в концентрации 0,001 мг/мл. Затем преадаптированных особей по 10 штук помещали в лунки планшета для исследований, чтобы для каждого вещества было проанализировано не менее 36 лунок.
Достоверность различий между опытом и контролем, действием различных веществ в разных концентрациях оценивали с помощью полного двухфакторного дисперсионного анализа [10]. Различия между выборками считались статистически значимыми при p≤0,05.
3. Результаты и обсуждения
Проведенные исследования показали, что токсический эффект исследуемых соединений носит дозозависимый характер, и смертность инфузорий возрастает с увеличением концентрации соединений и времени воздействия.
Проведённый статистический анализ показал, что соединения достоверно различаются по токсичности (p<0,05). С увеличением времени воздействия и концентрации веществ достоверно возрастает токсичность соединений, что выражается в повышении уровня смертности (таблица 1).
Таблица 1 - Гибель Paramecium caudatum Ehrenberg (%) при воздействиях 1,2,4-TriH и [алкил(арил)сульфонил]-триазолами (I-III)
Исследуемые концентрации (мг/мл) | 0,0001 | 0,001 | 0,01 | 0,1 | 1 | |||||
Время воздействия –(час) | 1 | 3 | 1 | 3 | 1 | 3 | 1 | 3 | 1 | 3 |
TriH | 0 | 0 | 4 | 6 | 72 | 77 | 84 | 86 | 95 | 95 |
I | 0 | 0 | 3 | 5 | 25 | 36 | 64 | 72 | 100 | 100 |
II | 0 | 0 | 2 | 3 | 18 | 22 | 49 | 52 | 100 | 100 |
III | 0 | 0 | 3 | 4 | 15 | 20 | 42 | 49 | 100 | 100 |
В концентрации 1 мг/мл синтезированные триазолиды вызывают 100% гибель инфузорий, в то время как 1,2,4-триазол вызывает смертность 95% особей. Обнаружили, что с увеличением молекулярной массы синтезированных триазолидов в концентрации 0,1 мг/мл их токсичность падает. В концентрации 0,0001 мг/мл все исследованные соединения оказались нетоксичными для инфузорий.
Результаты второй серии экспериментов представлены в таблице 2. Проведённый полный двухфакторный дисперсионный анализ показал, что предварительная преадаптация в течение 10 суток обнаруженной нетоксичной дозой достоверно (p<0,0001) снижает смертность инфузорий при последующем помещении их в токсичные концентрации – 0,1 и 1 мг/мл. Можно утверждать, что механизмы, используемые Paramecium caudatum Ehrenberg для адаптации, различны для анализируемых веществ. Наиболее сильно снижается смертность под действием соединений I и III, в структуру сульфокислоты которых входит метильная группа. Проведённый полный двухфакторный дисперсионный анализ показал, что предварительная преадаптация в течение 10 суток обнаруженной нетоксичной дозой достоверно (p<0,0001) снижает смертность инфузорий при последующем помещении их в токсичные концентрации – 0,1 и 1 мг/мл. Можно утверждать, что механизмы, используемые Paramecium caudatum Ehrenberg для адаптации, различны для анализируемых веществ.
Таблица 2 - Смертность инфузорий (в %) после преадаптирования культур 1,2,4-TriH и [алкил(арил)сульфонил]-триазолами (I-III) самих к себе нетоксичной дозой в течение 10 суток и последующим воздействии двумя токсичными дозами
Концентрации действующих веществ после преадаптации в течение 10 суток нетоксичной дозой | 0,1 мг/мл | 1 мг/мл | ||
Время ( в часах) воздействия действующей дозой | 1 | 3 | 1 | 3 |
TriH | 30 | 40 | 40 | 41 |
I | 19 | 20 | 21 | 25 |
II | 20 | 24 | 38 | 40 |
III | 10 | 11 | 15 | 16 |
Наиболее сильно снижается смертность под действием соединений I и III, в структуру сульфокислоты которых входит метильная группа.
Большинство ксенобиотиков, попав в организм, не оказывают прямого биологического эффекта и, подвергаясь биотрансформации, выделяются в виде метаболитов. Так как в процессе биотрансформации принимают участие ферменты, можно предположить, что для некоторых из них наличие метильных групп в структуре ксенобиотиков является фактором, индуцирующим их активность. Это совпадает с результатами исследований, полученными нами ранее при анализе возможности развития адаптивного ответа у Staphylococcus aureus [11 С. 27-29].
4. Заключение
1,2.4-Триазол и его производные [алкил(арил)сульфонил]-триазолы токсичны для Paramecium caudatum Ehrenberg в концентрациях от 0,001 до 1 мг/мл. С увеличением времени воздействия и концентрации их токсичность для инфузорий возрастает.
Преадаптация культур инфузорий в течение 10 дней нетоксичной дозой 0,0001мг/мл исследуемыми соединениями, приводит к развитию адаптивного ответа к высокотоксичным дозам, причём наиболее сильная адаптация развивается при преадаптации триазолидами, в структуру сульфокислоты которых входит метильная группа.
