ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ЭНДОТЕЛИЯ У БОЛЬНЫХ С АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ, ПРОЖИВАЮЩИХ В ВЫСОКО-ГОРЬЕ
Бесланеев И.А.1 , Курданова М.Х.2, Батырбекова Л.М.3, Курданов Х.А.4
1 Кандидат медицинских наук, ведущий научный сотрудник 2 Кандидат медицинских наук, ведущий научный сотрудник, 3 Кандидат медицинских наук, ведущий научный сотрудник 4 Директор, главный научный сотрудник, доктор медицинских наук, профессор. Центр медико-экологических исследований - филиал – Федерального государственного бюджетного учреждения науки - Государственного научного центра Российской Федерации - Института медико-биологических проблем Российской академии наук. Нальчик, Российская Федерация
ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ЭНДОТЕЛИЯ У БОЛЬНЫХ С АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ, ПРОЖИВАЮЩИХ В ВЫСОКОГОРЬЕ
Аннотация
В статье представлены данные об особенностях катаболизма L -аргинина по окисному и гидролизному типу у больных с артериальной гипертонией (АГ), проживающих в высокогорье в зависимости от концентрации оксида азота (NO), мочевины (М) и полиаминов (П). Показано, что у больных АГ 2 и 3 степени с различной геометрией левого желудочка происходит накопление Па и М в плазме крови и эритроцитах на фоне снижения концентрации NO. Эти изменения наиболее выражены в группах больных АГ с ремоделированием миокарда с гипертрофией левого желудочка (ЛЖ) при концентрической и эксцентрической гипотрофии ЛЖ. С помощью уравнений множественной регрессии показаны закономерности отражающие зависимость абсолютных и относительных значений параметров гемодинамики и морфофункциональной структуры ЛЖ от концентрации NO и Па в крови.
Ключевые слова: артериальная гипертония, дисфункция эндотелия, ремоделирование миокарда, оксид азота, полиамины, высокогорье.
Beslaneev I. A.1, Kurdanov M. Х.2, Batyrbekova L.M. 3, Kurdanov H. A.4
1 Candidates of medical sciences, the leading scientific employee 2 Candidate of medical sciences, the leading scientific employee, 3 Candidate of medical sciences, the leading scientific employee 4 Director, the main scientific employee, the doctor of medical sciences, the professor. The centre of medico-ecological investigations - branch the Federal state budgetary establishment of a science - State centre of science of the Russian Federation - Institute of medical and biologic problems of the Russian Academy of Sciences. Nalchik, Russian Federation
FUNCTIONAL CONDITION OF ENDOTHELIUM IN PATIENTS WITH ARTERIAL HYPERTENSION, LIVING IN HIGH MOUNTAINS
Abstract
The article presents data on the characteristics of the catabolism of L-arginine on oxide and hydrolysis type in patients with arterial hypertension (AH), living in the highlands depending on the concentration of nitric oxide (NO), urea (M) and polyamines (Pa). It were shown that in hypertensive patients 2 and 3 degrees with different geometry of the left ventricle, the accumulation of Pa and M in plasma and erythrocytes on the background of reducing the concentration of NO. These changes were most obvious at concentric and eccentric remodeling LV. With the help of multiple regression equations shown regularities reflecting the dependence of absolute and relative values of hemodynamic parameters and morphofunctional patterns of LV on the concentration of NO and Pa in the blood.
Keywords: arterial hypertension, endothelial dysfunction, myocardial remodeling, nitric oxide, polyamines, high mountains.
Дисфункция эндотелия (ДЭ) основным фактором патогенеза, течения и прогноза артериальной гипертонии (АГ), основного фактора риска сердечнососудистой патологии. Длительное течение АГ часто осложняется развитием ремоделирования миокарда (РМ), которое сопровождается увеличением массы миокарда, изменением полостей камер сердца, толщины стенок и геометрии желудочков. Основу морфологических изменений РМ составляют несбалансированные процессы апоптоза и пролиферации кардиомиоцитов с диспропорциональным накоплением коллагенов во внеклеточном матриксе [1,2].
Дисфункция эндотелия тесно связана с типами катаболизма L-аргинина: по окислительному пути (NO - синтазному) с образованием NO и гидролизному (аргиназому) пути с образованием мочевины (М) , L-орнитина и полиаминов (Па).
Тип катаболизма L-аргинина влияет на сосудистый тонус в зависимости от активности (NO - синтазного) и/или аргиназного путей катаболизма. Аргиназа может прямо влиять на синтез NO, снижая активность NO- синтаз и косвенно, снижая концентрацию L-аргинина в крови[3].
В многочисленных экспериментальных и клинических исследованиях показано, что снижение содержания NО в компонентах крови тесно связано с гиперактивацией аргиназы [4]. Увеличение концентрации аргиназы и L- орнитина в кардиомиоцитах и миоцитах артерий приводит к активации орнитнрдекарбоксилазы с накоплением в клеточных субклеточных структурах низкомолекулярных поликатионов - полиаминов (Па): путресцина, спермидина и спермина. Атомы азота Па несут положительный заряд и легко связываются с отрицательно заряженными молекулами ДНК и РНК. Па входят в состав хроматина, участвуют в репликации ДНК, стимулируют транскрипцию, трансляцию и апоптоз. Па активно взаимодействуют с другими биогенными аминами, тесно связаны с факторами роста, экспрессией генов, синтезом компонентов внеклеточного матрикса [4]. Увеличение концентрации мочевины М и Па в эндотелиоцитах, миоцитах и эритроцитах приводит к нарушениям вазодилатации, увеличению проницаемости капилляров, гиперкоагуляции, повреждению клеточных мембран и апоптозу. При значительном накоплении М и Па угнетается активность нейрональной и индуцируемой NO-синтазы в результате их сенсибилизации к эндогенному ингибитору асимметрическому диметиларгинину (ADMA) [5]
В условиях умеренной гипоксии активность аргиназы уменьшается, изменяется синтез и транспорт полиаминов и мочевины, а продукция NO увеличивается за счет адаптационных процессов: нитритредуктазной активности металопротеинов, гемоглобина, эритроцитоза, снижения элиминации NO свободными радикалами и других адаптативных процессов [6,7].
В связи с этим, нами были изучены концентрации конечных метаболитов L-аргинина и их взаимосвязи с параметрами гемодинамики и морфофункциональной структуры миокарда левого желудочка у больных АГ и здоровых лиц, проживающих в высокогорных районах Приэльбрусья.
Материал и методы
В высокогорных районах Приэльбрусья (2200 - 3400 м. над уровнем моря), обследовано 170 коренных жителей, которые были выделены следующие группы:
- 40 больных АГ 1 степени, (18 мужчин и 22 женщин, средний возраст 47,3±3,4 лет), индекс массы тела (ИМТ) 24,3±0,6 кг/м 2.
- 40 больных АГ 2 степени, (23 мужчин и 17 женщин), средний возраст 53,2±3,6 года, ИМТ 23,9±0,6 кг/м 2.
- 30 больных АГ 3 степени, (14 мужчин и 16 женщин), средний возраст 56,3±2,4 лет, ИМТ 22,8±0,7 кг/м 2.
- Контрольную группу составили 60 здоровых жителей высокогорья, (29 мужчин и 31 женщин), средний возраст 46,9±3,7 лет, ИМТ 23,6±0,3 кг/м 2.
Обследованные пациенты были сопоставимы по возрасту, полу и индексу массы тела. Все пациенты ознакомлены с методиками исследований, получено информированное согласие для дальнейшего их проведения. Протокол обследования одобрен Комитетом по этике.
Диагноз АГ и степень АД верифицировали на основании данных клинических, инструментальных, лабораторных и биохимических методов исследований. Стратификацию факторов риска и общего риска определяли в соответствии с рекомендациями Рабочей группы по лечению артериальной гипертонии Европейского общества гипертонии и Европейского общества кардиологов (ESH/ ESC) 2013г. [8].
Критерии исключения из исследования: пациенты с симптоматической гипертензией; с метаболическими и эндокринными заболеваниями; с признаками сопутствующих воспалительных заболеваний; с нарушениями ритма и проводимости; с выявленной стенокардией и/или постинфарктным кардиосклерозом в анамнезе; пациенты с ассоциированными клиническими состояниями в анамнезе; пациенты, принимающие лекарственную терапию, влияющую на концентрацию нитритов и нитратов в крови и уровни АД. Для исключения синдрома «белого халата», исследования проводили в обычной одежде.
Методы исследований
Всем пациентам было проведено обще-клиническое, лабораторно – инструментальное и биохимическое обследование. Проводилась компьютерная электрокардиография, эхо-кардиография. Больным АГ дополнительно проводилось ультразвуковое исследование почек, щитовидной железы и осмотр глазного дна.
Состояние сердечно-сосудистой системы оценивалось с помощью компьютерной электрокардиографии «Cardiette», (Италия), эхо-кардиографии «Aloka SSD-500», (Япония). Систолическое и диастолическое артериальное давление (САД и ДАД) определялось с помощью автоматических тонометров «AND» и «Omron» (Япония), суточных мониторов АД «Mobil-O-Graph», (Англия). Пульсовое и средне - динамическое артериальное давление (ПАД, АДСр) рассчитывали по общепринятым методам. Эхокардиографию проводили в М, В, М/В – режимах, в сечениях сердца по длинной и короткой оси ЛЖ из стандартных позиций, согласно общепринятым рекомендациям. Определяли конечно-систолический и конечно-диастолический размеры (КДР, см., КСР, см.), объемы (КДО, мл, КСО, мл.) ЛЖ. Ударный объем и ударный индекс ЛЖ (УИ=УО, мл/м2). Удельное периферическое сосудистое сопротивление (УПСС=ОПСС, дина*с/см3/м2). Показатели глобальной сократимости: фракцию выброса (ФВ %), относительное сокращение (ОС %). Рассчитывали массу миокарда ЛЖ (ММЛЖ), индекс массы миокарда (иММ, г/м2) и параметры характеризующие геометрию ЛЖ: относительную толщину стенки (ОТС ЛЖ); функциональный индекс соответствия (ФИС=УИ/иММ, мл/г/м2), где УИ, мл/м2 - ударный индекс ЛЖ; индекс напряжения миокарда ЛЖ (АДС/КСО, ед.); объемно-массовое отношение ЛЖ (иКДО/иММ, мл/г/м2); индекс дилатации (КДР/Р, см/м2), где Р - поверхность тела в м2. Индексы систолической (ИСс, ед.) и диастолической сферичности ЛЖ (ИСд, ед.) вычисляли как отношение диаметра ЛЖ к его длинной оси: ИСс = КСР/l, ИСд = КДР/l, где КСР – конечно-систолический размер ЛЖ, КДР – конечно-диасистолический размер ЛЖ, l - длинная ось ЛЖ; индекс артериальной жесткости (ИАЖ) - отношение (УИ/ПАД, мл/м2/мм.рт.ст.), где ПАД пульсовое артериальное давление. Конечный систолический и диастолический меридиональный стресс рассчитывали по формулам:
КСМС=0,334*САД*КСР/ТЗСс*(1+(ТЗСс/ КСР)) , г/см2,
КДМС=0,334*ДАД*КДР/ТЗСд*(1+(ТЗСд/КДР)), г/см2, где ТЗСс - толщина задней стенки ЛЖ в систолу, ТЗСд - толщина задней стенки ЛЖ в диастолу[9].
Гипертрофию ЛЖ констатировали при иММ>124 г/м2 у мужчин и >109 г/м2 у женщин. Гипертрофию стенки ЛЖ оценивали по их относительной толщине – ОТС ЛЖ. Согласно рекомендациям Всероссийского Научного общества кардиологов (IV пересмотр) 2010 г., выделяли следующие типы геометрии миокарда ЛЖ:
- Нормальная геометрия (НГЛЖ), при нормальном иММ и ОТС ЛЖ<0,42 ед.
- Концентрическое ремоделирование (КРЛЖ), при нормальном иММ и ОТС ЛЖ >0,42 ед.
- Концентрическая гипертрофия (КГЛЖ), при увеличенном иММ и ОТС ЛЖ>0,42 ед.
- Эксцентрическая гипертрофия (ЭГЛЖ), при увеличенном иММ и ОТС ЛЖ<0,42 ед.
Продукцию оксида азота (NO) оценивали по концентрации его стабильных метаболитов: нитритов (NO2-) и нитратов (NO3-) в плазме крови и эритроцитах. Концентрацию NO2- и NO3- определяли в безбелковых фильтратах плазмы крови и эритроцитах спектрофотометрическим методом (СФ-4-А, Россия) с помощью реактива Грисса по методу Грина. Концентрацию NO3 определяли в безбелковых фильтратах плазмы и эритроцитов, используя бруциновый реактив [10]. Метаболизм L-аргинина по окисному (NO-синтазному) и гидролизному (аргиназному) пути оценивали по концентрации конечных продуктов каждой реакции: стабильных метаболитов NO - NO2- и NO3- и М и Па, которые определялись в плазме крови и эритроцитах с помощью спектрофотометрического и колориметрического методов.
Статистический анализ
Исследованные величины представлены в виде среднего значения и ее стандартной средней ошибки (M±m). Для сравнения независимых групп использовали t – критерий Стьюдента и тест Манна-Уитни. Анализ корреляционных связей был проведен стандартным методом математического моделирования с помощью программы «Statistica v. 10.01» в модулях «корреляция» и «множественная регрессия». Значимость факторов оценивали по F - критерию Фишера. Результаты обработаны на ПК и считались статистически значимыми при коэффициенте достоверности р<0,05.
Результаты и их обсуждение
В завершенном виде, распределение всех больных АГ по типам геометрии ЛЖ, представлено ниже по группам в цифрах и процентах от общего числа наблюдений: 1 гр. - НГЛЖ (n=52/47,3%); 2 гр. - КРЛЖ (n=37/33,6%); 3 гр. - КГЛЖ (n=12/10,9%); 4 гр. - ЭГЛЖ (n=9/8,2%). Здоровые лица составили контрольную группу – К. гр.
При сопоставимой длительности течения АГ в группах с различными типами геометрии ЛЖ, уровни АДСр были достоверно выше у больных в 2 гр. 3 гр. и 4 гр. (на 20%, 30% и 24%) по сравнению с 1 гр. (Таблица 1).
Таблица 1 – Показатели гемодинамики и морфофункциональной структуры в группах больных с различными типами геометрии миокарда левого желудочка (N=110) и здоровых лиц (M±m)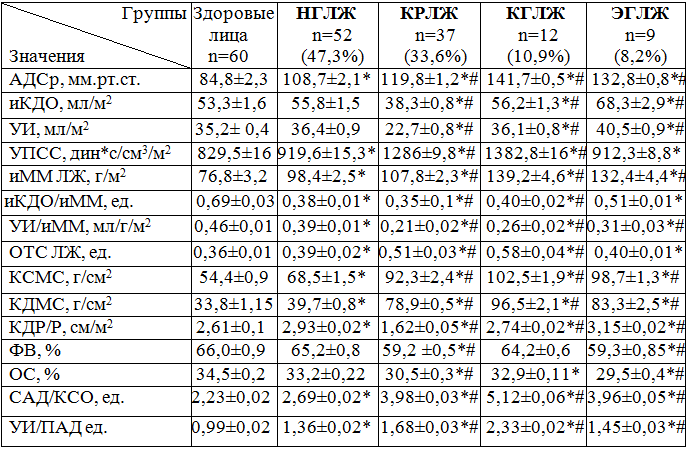
Примечания: * - различия достоверны между группой здоровых лиц и группами больных АГ с НГЛЖ, КРЛЖ, КГЛЖ и с ЭГЛЖ, р<0,05 - р<0,001. # - различия достоверны между группой больных АГ с НГЛЖ и группами больных c КРЛЖ, КГЛЖ и ЭГЛЖ, р<0,05 - р<0,01.
Как видно из таблицы, иКДО в К. гр. достоверно не отличался от иКДО у больных в 1 гр. и значительно снижен во 2 гр. (на 44%). Высокие показатели иКДО выявлены у больных в 4 гр. (на 64% и 19%) выше по сравнению с больными во 2 гр. и 3 гр. Ударный индекс (УИ, мл/м2) достоверно снижен у больных во 2 гр. (на 66%) и увеличен в 4 гр. (на 9%) по сравнению с К. гр. Высокие показатели УПСС выявлены у больных во 2 гр. и 3 гр. (на 32% и 39%) выше, чем в к. гр. У больных АГ в 4 гр. УПСС было увеличено (на 5%) по сравнению с 1. гр.
Значения иММ (г/м2) группах больных АГ увеличены в 3 гр. и 4 гр. (на 30% и 32%) по сравнению с больными в 1 гр. Низкие значения объемной нагрузки на миокард (иКДО/иММ, мл/г/м2) выявлены у больных во 2 гр. и 3 гр. (на 65% и 38%) ниже, чем в К. гр. Увеличенное значение иКДО/иММ (на 40 %) выявлено у больных 4 гр. по сравнению с 2 гр. Относительная толщина стенки – (ОТС ЛЖ) увеличена (на 12 - 35%) в 2 гр. и 3 гр. по сравнению с показателями в 1 гр. у больных АГ в 1 гр. и 2 гр. выявлены высокие показатели КСМС (на 18 и 30%) выше, чем в К. гр. У больных АГ с гипертрофией ЛЖ высокие цифры КСМС установлены в 2 гр. и 4 гр. (на 63% и 59%) выше аналогичных показателей в К. гр. Высокие показатели КДМС выявлены у больных в 2 гр. 4 гр. и 3 гр. (на 21%, 65% и 64%) выше, чем в К. гр.
Индексы сферичности достоверно увеличены у больных в 4 гр. (на 11%). У больных в 1 гр. и 2 гр. индексы сферичности ЛЖ достоверно не отличались от показателей в К. гр. Индекс КДР/Р, см/м2 снижен во 2 гр. (на 43%) и увеличен у больных в 4 гр. (на 24%). Показатель напряженности миокарда (САД/КСО) увеличен у больных АГ в 1 гр. во 2 гр. и 3 гр. (на 17%, 44% и 35 %) по сравнению с К. гр.
Показатели сократимости - ФВ и ОС, снижены в 3 гр. и 4 гр. больных АГ (на 5% и 10%) по сравнению с к. гр.
Функциональный индекс соответствия (УИ/иММ) снижен во 2 гр. и 3 гр. (в 1,5 - 1,8 раза) по сравнению с больными в 1 группе. Индекс артериальной жесткости (УИ/ПАД) увеличен в 1 гр. во 2 гр. 3 гр. и 4 гр. (на 27- 35 %) по сравнению с К. гр.
Концентрация стабильных метаболитов оксида NO, мочевины (М) и полиаминов (Па) представлены в таблице 2.
Таблица 2 - Показатели концентрации мочевины (М), полиаминов (Па) и оксида азота (NO) в крови в группах больных артериальной гипертонией с различными типами геометрии миокарда левого желудочка и здоровых лиц (M±m)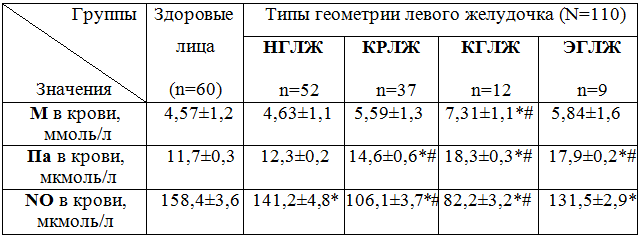
Примечания: М – мочевина; Па – суммарная концентрация полиаминов; NO – суммарная концентрация нитритов и нитратов в плазме крови и эритроцитах;
Как видно из таблицы, концентрация мочевины в плазме крови увеличена у больных АГ в 2 гр. и 3 гр. (на 18 - 27%) по сравнению с К. гр. Концентрация полиаминов в крови достоверно не отличается в 1 гр. и в К. гр. и увеличена у больных АГ в 2 гр. 3 гр. и 4 гр. (на 18% 36% и 26%). Суммарная концентрация стабильных метаболитов NO в крови незначительно снижена в 1 гр. и достоверно снижена у больных АГ в 2 гр. 3 гр. и 4 гр. (на 49%, 92% и 19%).
При помощи корреляционного анализа и уравнений множественной регрессии выявлены взаимосвязи морфофункциональных параметров миокарда ЛЖ, показателей гемодинамики с концентрацией NO и Па в крови.
Наиболее значимые прямые взаимосвязи выявлены у больных АГ в 2 гр. и 3 гр. между АДСр и ММЛЖ, ОТС ЛЖ, Упсс (r=0,462 - r=0,673; p<0,05); между АДСр и КСМС, КДМС (r=0,564; r=0,435; p<0,05).
Обратные взаимосвязи установлены между АДСр и УИ во 2 гр. и 3 гр. (r=-0,474; r=-0,407; p<0,05). Между концентрацией NO в крови и АДСр выявлены обратные корреляционные связи во всех группах больных АГ (r=-0,448 - r=-0,838; p<0,05).
Между концентрацией NO в крови и иММ, ОТС ЛЖ, УПСС во всех группах больных АГ также выявлены обратные взаимосвязи разной выраженности (r=-0,452 – r=-0,669; p<0,05). Выявлена прямая зависимость между концентрацией Па в крови и иММ (r=0,439; p<0,05) и обратная зависимость между концентрацией NO и Па в крови (r=-0,535; p<0,05) у больных АГ во 3 гр. и 4 гр. Между индексами сферичности (ИСс, ИСд, ед.) и концентрацией NO в крови выявлены прямые корреляционные связи (r=0,443; r=0,478; p<0,05) в 4 гр., слабовыраженные в других группах больных АГ и в К.гр.
Заключение
Дисфункция эндотелия у больных АГ, жителей высокогорья сопровождается активацией катаболизма L-аргинина по не окисному (аргиназному) типу с увеличением концентрации полиаминов и мочевины в крови на фоне снижения продукции NO.
Изменение катаболизма L-аргинина более выражены в группах больных АГ с концентрической гипертрофией ЛЖ и эксцентрической гипертрофией ЛЖ. В этих группах выявлены обратные корреляционные связи между концентрациями NO и Па в крови и прямые взаимосвязи между индексом ММ, ОТС ЛЖ и концентрацией Па в крови. В группах больных с КРЛЖ, НГЛЖ и у здоровых лиц аналогичные корреляционные связи были слабо выражены или отсутствовали.
Полученные результаты могут свидетельствовать о важной роли аргиназы и метаболитов аргиназного пути катаболизма L - аргинина - полиаминов в процессах ремоделирования миокарда и течение дисфункции эндотелия у больных АГ в условиях высокогорной гипоксии.
Литература
- Brunner H, Cockcroft JR, Deanfield J. et al. Endothelial function and dysfunction. Part II: association with cardiovascular risk factors and diseases. / A statement by the Working Group on Endothelins and Endothelial Factors of the European Society of Hypertension // J. Hypertens. – 2005. - Vol. 23. - P. 233-246.
- GonzalezA, LopezB, RavassaS et al. Biochemical markers of myocardial remodeling in hypertensive heart diseases // Cardiovasc Res. – 2009.- Vol. 81.- P. 509-518.
- Intengan HD, Schiffrin EL. Vascular remodeling in hypertension. Roles of apoptosis, inflammation, and fibrosis // Eu Heart Journal.- 2005.- Vol. 26, No 9.- P. 921- 927.
- Durante W, Johnson FK, Johnson RA. Arginase: a critical regulator of nitric oxide synthesis and vascular function // Clin. Exp. Pharm. Physiology – 2007.- Vol. 34, No 9. - P. 906-911.
- Morris SM. Arginine metabolism in vascular biology and disease //Vasc. Med.- 2005. – Vol. 10, (Suppl 1). S83-S87.
- Crawford H, Isbell T. S. et al. Hypoxia, red blood cells and nitrite regulate NO-dependent hypoxic vasodilatation // Blood.- 2006. – Vol. 107, No 2.- P. 566-574.
- Erzurum S.C., Ghosh S, Janocha A.J. et al. Higher blood flow and circulating NO products offset high-altitude hypoxia among Tibetans. Proc. Natl. Acad. Sci. USA.- 2007.- Vol, No 45.- P. 17593-17598.
- 2013 ESH/ESC Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Journal of Hypertension.- 2013.- Vol. 31, No 7.- P.1281-1357. pp. 1284-1340.
- Нечесова Т.А., Коробко И.Ю., Кузнецова Н.И. Ремоделирование левого желудочка: патогенез и методы оценки // Медицинские новости.- 2008. - №11. - С. 7-13.
- Tsikas D. Methods of quantitative analysis of the nitric oxide metabolites nitrite and nitrate in human biological liquids // Free Radical Research.- 2005.- Vol. 39, No 8.- P. 797-815.
Referents
- Brunner H, Cockcroft JR, Deanfield J. et al. Endothelial function and dysfunction. Part II: association with cardiovascular risk factors and diseases. / A statement by the Working Group on Endothelins and Endothelial Factors of the European Society of Hypertension // J. Hypertens. – 2005. - Vol. 23. - P. 233-246.
- GonzalezA, LopezB, RavassaS et al. Biochemical markers of myocardial remodeling in hypertensive heart diseases // Cardiovasc Res. – 2009.- Vol. 81.- P. 509-518.
- Intengan HD, Schiffrin EL. Vascular remodeling in hypertension. Roles of apoptosis, inflammation, and fibrosis // Eu Heart Journal.- 2005.- Vol. 26, No 9.- P. 921- 927.
- Durante W, Johnson FK, Johnson RA. Arginase: a critical regulator of nitric oxide synthesis and vascular function // Clin. Exp. Pharm. Physiology – 2007.- Vol. 34, No 9. - P. 906-911.
- Morris SM. Arginine metabolism in vascular biology and disease //Vasc. Med.- 2005. – Vol. 10, (Suppl 1). S83-S87.
- Crawford H, Isbell T. S. et al. Hypoxia, red blood cells and nitrite regulate NO-dependent hypoxic vasodilatation // Blood.- 2006. – Vol. 107, No 2.- P. 566-574.
- Erzurum S.C., Ghosh S, Janocha A.J. et al. Higher blood flow and circulating NO products offset high-altitude hypoxia among Tibetans. Proc. Natl. Acad. Sci. USA.- 2007.- Vol, No 45.- P. 17593-17598.
- 2013 ESH/ESC Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Journal of Hypertension.- 2013.- Vol. 31, No7.- P.1281-1357. pp. 1284-1340.
- Nechesova T. A., Korobko I. Yu., Kuznetsova N. I. Left ventricular remodelling: pathogenesis and methods evaluation // Medicinscie novosti.- 2008. - No 11. - S. 7-13.
- Tsikas D. Methods of quantitative analysis of the nitric oxide metabolites nitrite and nitrate in human biological liquids // Free Radical Research.- 2005.- Vol. 39, No 8.- P. 797-815.
