ОЦЕНКА ГЕМОРРАГИЧЕСКИХ ОСЛОЖНЕНИЙ ПОСЛЕ РЕПЕРФУЗИОННОЙ ТЕРАПИИ ОСТРОГО ИШЕМИЧЕСКОГО ИНСУЛЬТА С ПОМОЩЬЮ ЛУЧЕВЫХ МЕТОДОВ ДИАГНОСТИКИ
ОЦЕНКА ГЕМОРРАГИЧЕСКИХ ОСЛОЖНЕНИЙ ПОСЛЕ РЕПЕРФУЗИОННОЙ ТЕРАПИИ ОСТРОГО ИШЕМИЧЕСКОГО ИНСУЛЬТА С ПОМОЩЬЮ ЛУЧЕВЫХ МЕТОДОВ ДИАГНОСТИКИ
Аннотация
Цель исследования — определить частоту и факторы риска геморрагической трансформации (ГТ) у пациентов с острым ишемическим инсультом (ОИИ) после тромболитической терапии (ТЛТ), тромбэкстракции (ТЭ) и их сочетанного применения.
Материалы и методы. Обследовано 460 пациентов с ОИИ в возрасте от 23 до 97 лет, из них 263 пациентам выполнили ТЛТ, 197 пациентам — инвазивные вмешательства (ТЭ, сочетание ТЭ с ТЛТ и со стентированием). Анализ церебрального кровотока проводился с помощью дуплексного сканирования (ДС) брахиоцефальных (БЦА) и интракраниальных артерий, компьютерной ангиографии сосудов головного мозга, а также рентгеноконтрастной церебральной ангиографии (ЦАГ) у пациентов, получивших инвазивное лечение.
Результаты. Среди инсультов, осложнившихся ГТ, ведущее значение имеет кардиоэмболический подтип. Кардиальная патология, особенно нарушения ритма, является не только наиболее частым потенциальным источником церебральной эмболии, но и предиктором ГТ. Наличие гипертонической болезни, перенесенного ОИИ в анамнезе, гемодинамически значимого стенозирования БЦА и повышение скорости кровотока в интракраниальных артериях могут служить факторами риска развития ГТ в раннем периоде после реперфузии. С помощью ДС интракраниальных артерий выявлена значимая взаимосвязь скорости кровотока и индексов периферического сопротивления с риском развития ГТ.
Заключение. Тяжесть неврологического дефицита, размер очага ишемии, кардиоэмболический подтип инсульта и кардиальная патология (в частности, нарушения ритма, гипертоническая болезнь), данные ультразвукового ДС (гемодинамически значимое стенозирование БЦА и повышение скорости кровотока в интракраниальных артериях) являются значимыми предикторами ГТ.
1. Введение
Геморрагическая трансформация (ГТ) — одна из наиболее частых и серьезных проблем в лечении острого ишемического инсульта (ОИИ), влияющая как на план лечения, так и на клинический прогноз. ГТ — наиболее опасное осложнение тромболизиса, ограничивающее показания к его применению. Своевременная идентификация предикторов ГТ может стать полезной для коррекции тактики реперфузионной терапии и поводом для более интенсивного динамического наблюдения, а также может служить основанием для отказа от вторичного профилактического назначения антиагрегантов и/или антикоагулянтов .
Частота встречаемости ГT, по данным мультиспиральной компьютерной томографии (МСКТ), колеблется от 10% до 40%, по результатам аутопсии — от 40% до 70%. Указанный широкий диапазон связывают с различными индивидуальными факторами риска. Частота симптомной ГТ составляет от 0,6% до 20%, после эндоваскулярного лечения — 6,0% . Дуплексное сканирование (ДС) рассматривается как доступный неинвазивный диагностический инструмент для исследования церебральной гемодинамики, который можно неоднократно воспроизводить у постели пациента . В современной литературе отсутствуют рекомендации по использованию методик нейровизуализации для прогнозирования риска ГT. Наиболее высокий уровень доказательности при прогнозировании ГТ представлен в метаанализе различных модальностей МСКТ, включая бесконтрастную, с использованием контраста, перфузионную и компьютерно-томографическую ангиографию (КТА) .
2. Методы и принципы исследования
В настоящее проспективное исследование включало 460 пациентов с ОИИ, из них 45,6% (210) мужчин, 54,4% (250) женщин в возрасте от 23 до 97 лет. Медиана возраста пациентов составила 71 [62; 79] лет. Значимых различий пациентов мужского и женского пола по возрасту выявлено не было (р=0,493). Из исследования были исключены пациенты с аневризмами, артериовенозными мальформациями и непроницаемостью височных акустических окон для ультразвука.
В соответствии с примененным видом реваскуляризации пациенты были разделены на группы (табл. 1): в группе 1 проводилась внутривенная ТЛТ (n=263), в группе 2 – ТЭ (n=87), в группе 3 использовали сочетание ТЛТ и ТЭ (n=91), в группе 4 – ТЭ сопровождалась установкой стента (n=19).
Таблица 1 - Распределение пациентов с ОИИ по группам в соответствии с видом реперфузионной терапии
Группа | Число пациентов (абс.) | Число пациентов (%) |
ТЛТ | 263 | 57,2 |
ТЭ | 87 | 18,9 |
ТЛТ и ТЭ | 91 | 19,8 |
ТЭ и стентирование | 19 | 4,1 |
Всего | 460 | 100,0 |
Комплексное обследование пациентов всех групп включало: неврологический осмотр, лабораторные исследования (в том числе определение концентрации тромбоцитов и коагулограмма), электрокардиографию, эхокардиографию, ДС брахиоцефальных и интракраниальных артерий, МСКТ и КТА сосудов головного мозга. Пациентам, получившим инвазивное лечение, проводилась рентгенконтрастная церебральная ангиография (ЦАГ).
Ультразвуковое исследование выполняли на ультразвуковом аппарате GE Vivid E9 и Vivid IQ (в условиях реанимационных палат) с помощью линейного датчика частотой 4,5–12,0 МГц при исследовании сосудов шеи и секторного датчика частотой 1,5–4,0 МГц при исследовании интракраниальных артерий. МСКТ проводили на аппарате Somatom Emotion 16 с системой внутривенного болюсного контрастирования MEDRAD Stellant Injection System и томографе Canon Aquilion Prime SP и GE Revolution EVO. ЦАГ выполняли на ангиографической установке GE Innova IGS 540.
При оценке неврологического статуса использовали шкалу тяжести инсульта Национального института здоровья (National Institutes of Health Stroke Scale, NIHSS) и модифицированную шкалу функциональных исходов Rankin (mRs).
Объем ДС магистральных артерий шеи включал оценку проходимости, степени стенозирующего поражения общих сонных (ОСА), внутренних сонных (ВСА), позвоночных (ПА) и подключичных артерий. Определяли пиковую систолическую скорость (ПСС), усредненную по времени максимальную скорость (TAMX) и конечную диастолическую скорость (КДС), а также индексы периферического сопротивления — резистивный (RI) и пульсационный (PI) индексы. Для оценки степени стеноза использовали гемодинамические (линейные скорости кровотока в пре-, постстенотическом участках и в зоне стеноза) и планиметрические (диаметр свободного просвета сосуда в зоне максимального стенозирования) критерии. Выявленные стенотические поражения оценивали методом ECST, при котором стеноз определяют по сопоставлению диаметра (или площади) свободного просвета артерии с диаметром (или площадью) сосуда в зоне стеноза, и методом NASCET, при котором диаметр свободного просвета артерии сопоставляют с диаметром артерии дистальнее зоны стеноза. Критерии оценки степени стеноза сонных артерий, которые были использованы в исследовании, представлены в таблице 2 , .
Таблица 2 - Критерии диагностики степени стеноза (ECST) каротидных артерий
Степень стеноза | Параметры | |||
ПСС ВСА, см/с | ВСА/ОСА отношение ПСС | КДС ВСА, см/с | Остаточный просвет | |
Норма | Менее 125 | Менее 1,8 | Менее 40 | Нет |
Менее 50% | 130-150 | Менее 2,0 | Менее 40 | Не менее 50% |
50-69% | 160-230 | 2,0-4,0 | 40-100 | Менее 50% |
70-80% | 250-300 | Более 4,0 | 120-140 | Менее 70% |
Субокклюзия | Более 300см/с, вариабельна | Более 4,0, вариабельно | Более 140, вариабельна | Просвет минимальный (около 1,0мм) |
Окклюзия | Не определяется | Не определяется | Не определяется | Просвет не визуализируется |
При ДС интракраниальных артерий оценивали проходимость, скоростные показатели (ПСС, TAMX, КДС) и резистивный индекс (RI) в средней (СМА), задней (ЗМА) и передней (ПМА) мозговых артериях, позвоночной (ПА) и базилярной (БА) артериях с определением коэффициента асимметрии до лечения, а также на 1, 3 и 7 сутки после проведенной терапии. Гемодинамику в СМА оценивали как нормальную при значениях ПСС и TAMX в СМА 70–160 см/с и 45–90 см/с, в ПМА – 60–150 см/с и 35–70 см/с, в ЗМА — 50–85 см/с и 30–50 см/с, в ПА – 45–70 см/с и 30–45 см/с, в БА – 50–90 см/с и 35–50 см/с соответственно. Значения ниже приведенных расценивали как гипоперфузию, выше — гиперперфузию (табл. 3) , .
Таблица 3 - Критерии оценки кровотока в интракраниальных артериях
Характеристика кровотока | Гипоперфузия | Гиперперфузия | ||
ПСС, см/с | ТAMX, см/с | ПСС, см/с | ТAMX, см/с | |
СМА | <60 | <40 | >220 | >85 |
ПМА | <45 | <30 | >155 | >70 |
ЗМА | <40 | <25 | >145 | >50 |
ПА | <20 | <15 | >120 | >30 |
БА | <30 | <20 | >140 | >40 |
Во всех случаях результаты ДС интракраниальных артерий были сопоставлены с данными КТА сосудов головного мозга в качестве референсного метода. В группах инвазивного лечения пациентам (197 человек) в качестве референсного метода выполнялась ЦАГ. МСКТ головного мозга выполняли всем обследованным до и после лечения с целью исключения внутримозгового кровоизлияния и оценки степени ишемических изменений. Для количественной оценки степени ишемического повреждения головного мозга применяли шкалу ASPECTS.
Статистическая обработка полученных данных проводилась с помощью пакета программ Statistica 12.0, SPSS Statistics 17.0. При анализе данных использовали: среднее арифметическое (М), стандартное отклонение (SD), медиана и квартили (Me [LQ; UQ]). Для оценки корреляционной связи параметров использовался метод Спирмена. Сравнение групп по количественным показателям проводили с помощью U-критерия Манна-Уитни, по качественным показателям — при помощи точного критерия Фишера или Хи-квадрат (χ²). При проверке статистических гипотез допустимым уровнем ошибки первого типа считалось значение, не превышающее показатель 0,05. Определяли значения чувствительности, специфичности, прогностической ценности положительного (ПЦПР) и прогностической ценности отрицательного (ПЦОР) результатов. При проведении ROC-анализа (receiver operating characteristic) рассчитывали специфичность, чувствительность, а также площадь под ROC-кривой — AUC (Area Under Curve).
3. Основные результаты
Геморрагические осложнения выявлены после лечения у 42 (9,1%) пациентов: у 23 (8,7%) пациентов 1 группы, 10 (11,5%) человек 2 группы и 9 (9,9%) пациентов 3 группы. В исследовании учитывали внутричерепные кровоизлияния, выявленные при МСКТ, которые были симптомные с ухудшением неврологического дефицита не менее 4 баллов по NIHSS. Установлено, что частота ГТ была существенно выше при большом размере очага (рис. 1): среди пациентов с очагом ишемии более 2 см — 70,3%, при очаге менее 2 см — 13,5% (p=0,001).
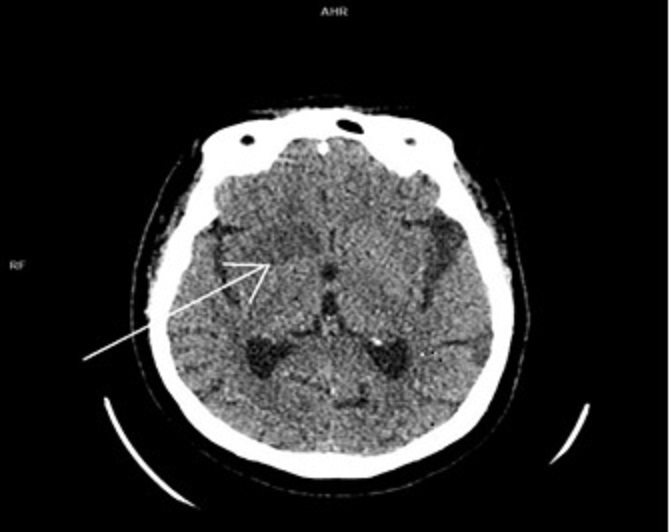
Рисунок 1 - Пациент Н., 70 лет, с острым ишемическим инсультом до эндоваскулярной тромбэкстракции, осложнившейся геморрагическим пропитываем очага ишемии
Примечание: мультиспиральная компьютерная томография головного мозга без контрастного усиления в аксиальной проекции: зона снижения денситометрической плотности в правой лобной доле (+22 HU) размерами 29 х 19 мм (стрелка) – ASPECTS 8 (бассейн правой СМА)
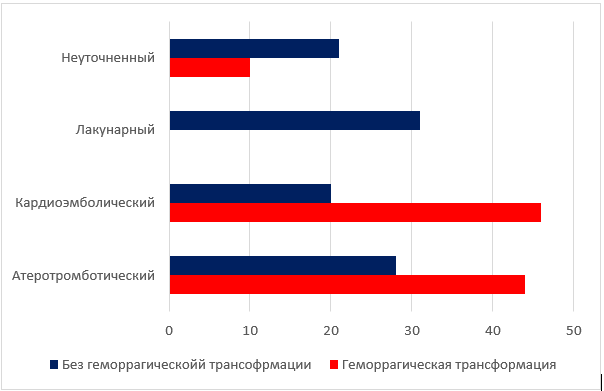
Рисунок 2 - Частота встречаемости различных типов ишемического инсульта среди пациентов с геморрагической трансформацией и без нее
Сопутствующая сердечно-сосудистая патология представлена в таблице 4, у лиц с ГТ инсульта встречалась значимо чаще, чем у пациентов без ГТ (табл. 4) — 73,8% и 38,5% соответственно (p=0,0001). Аналогичные результаты получены по частоте ОИИ в анамнезе (42,9% и 14,8% соответственно), гипертонической болезни (88,1% и 78,3% соответственно), нарушений ритма (66,7% и 25,2% соответственно) и гемодинамически значимых каротидных стенозов (38,1% и 3,3% соответственно) (рис. 3). Статистически значимых различий по частоте встречаемости сахарного диабета подтвердить не удалось (p=0,462).
Таблица 4 - Частота встречаемости факторов риска эмболии и тромбоза у пациентов с геморрагической трансформацией и без нее
Фактор риска | Геморрагическая трансформация (n=42) | Без геморрагической трансформации (n=418) | р | ||
Абс. | % | Абс. | % | ||
Гипертоническая болезнь | 37 | 88,1 | 327 | 78,3 | 0,045 |
Сахарный диабет | 11 | 26,2 | 104 | 24,9 | 0,462 |
Кардиальная патология* | 31 | 73,8 | 161 | 38,5 | 0,002 |
Нарушения ритма | 28 | 66,7 | 105 | 25,2 | 0,0001 |
ОИИ в анамнезе | 18 | 42,9 | 62 | 14,8 | 0,003 |
Гемодинамически значимые экстракраниальные стенозы | 16 | 38,1 | 14 | 3,3 | 0,0001 |
Примечание: кардиальная патология – ишемическая болезнь сердца, инфаркт миокарда, пороки сердца, кардиомиопатии
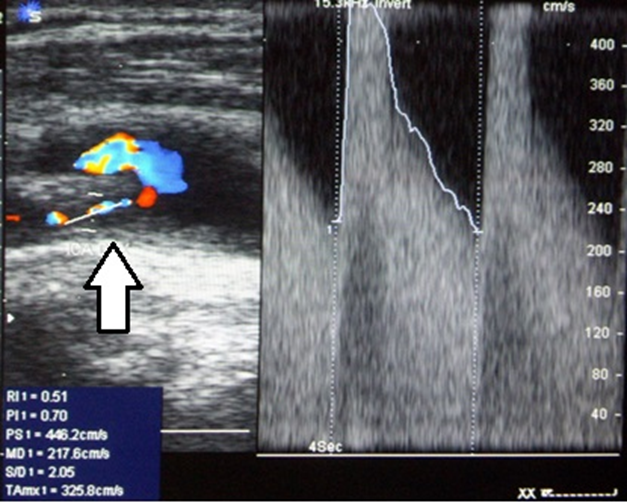
Рисунок 3 - Пациент В., 67 лет, с ишемическим инсультом, осложнившимся геморрагической трансформацией очага ишемии после тромболитической терапии
Примечание: Дуплексное сканирование сонных артерий на экстракраниальном уровне: стеноз правой ВСА 80% (NASCET) с ускорением систолической скорости кровотока до 446 см/с и диастолической скорости кровотока до 217 см/с (стрелка)
Таблица 5 - Результаты оценки клинического и функционального статусов у пациентов с геморрагической трансформацией и без нее
Шкала оценки | С геморрагической трансформацией | Без геморрагической трансформации | p |
NIHSS | 16,7 ±5,2 | 8,2 ± 4,5 | 0,0001 |
mRS | 4 [3; 6] | 3 [2; 4] | 0,001 |
При использовании метода корреляционных деревьев получено пороговое значение NIHSS, связанное со значимо большей частотой ГТ (рис. 4): более 15 баллов, позволяющее с высокой специфичностью (70,3%) и чувствительностью (82,5%) прогнозировать риск развития ГТ (AUC – 0,848).
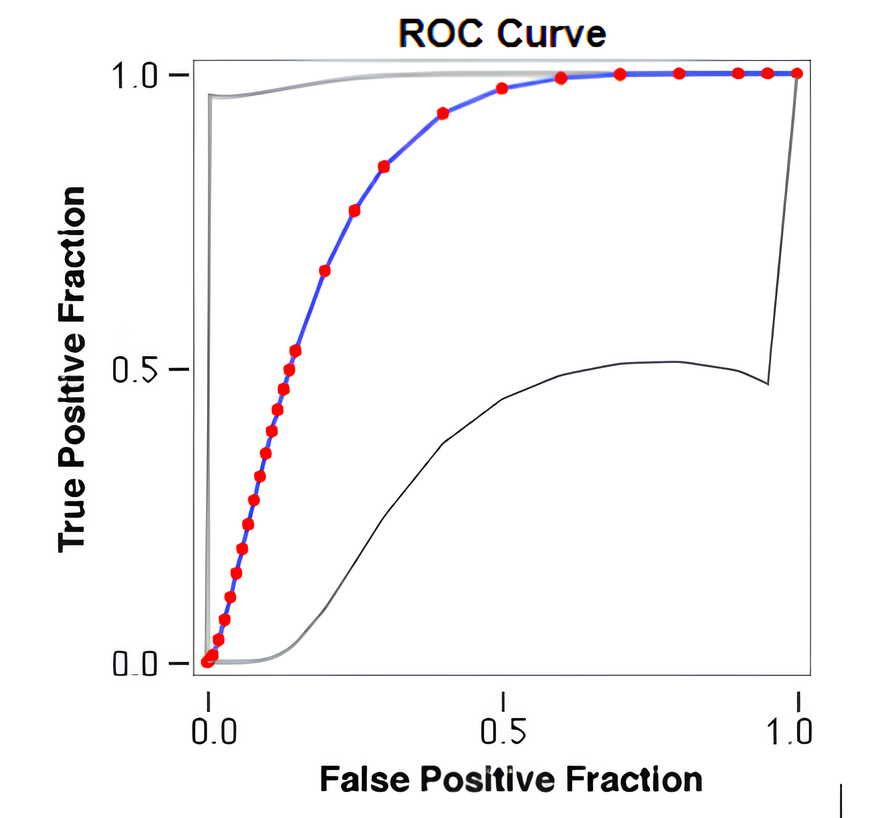
Рисунок 4 - ROC-кривая взаимосвязи тяжести неврологического дефицита и риска развития геморрагической трансформации после острого ишемического инсульта
Несмотря на то, что наличие синдрома гиперперфузии после реваскуляризации (37,3% в группе ТЛТ и 36,5% в группах инвазивного лечения на первые сутки) имело положительную корреляционную взаимосвязь с благоприятным исходом (r=0,79, р=0,023), в совокупности с другими факторами риска, такими как сопутствующие заболевания, стенозы брахиоцефальных артерий, гиперперфузия имела высокую прогностическую ценность развития ГТ (p=0,001) по данным множественной логистической регрессии.
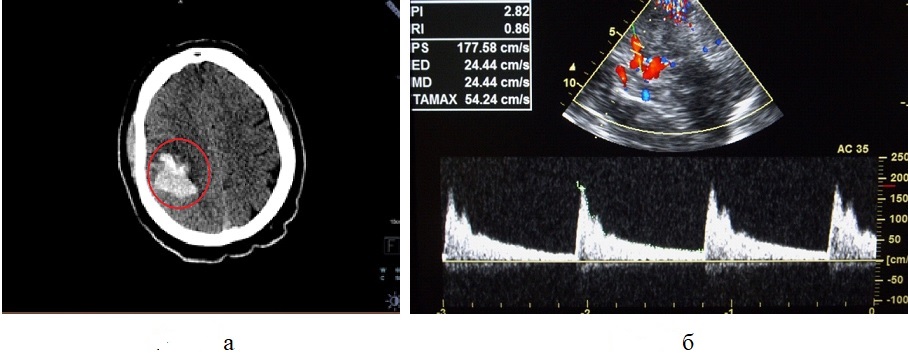
Рисунок 5 - Пациент С., 58 лет, с ишемическим инсультом после сочетанного применения тромболитической терапии и тромбэкстракции, осложнившегося геморрагической трансформацией очага ишемии
Примечание: а – Мультиспиральная компьютерная томография головного мозга без контрастного усиления в аксиальной проекции; геморрагическая трансформация очага ишемии в конвекстиальных отделах лобной и теменной долей справа (круг); б – Транскраниальное дуплексное сканирование артерий головного мозга через височное окно; увеличение пиковой систолической скорости кровотока до 177 см/с и повышение индексов периферического сопротивления (RI=0,86; PI=2,82) в правой СМА у пациента с геморрагической трансформацией очага ишемии
Таблица 6 - Распределение пациентов разных групп по результатам дуплексного сканирования интракраниальных артерий в ранние сроки после лечения
Результат ДС | Сроки после лечения | Группа 1 (n=263) | Группа 2 (n=87) | Группа 3 (n=91) | Группа 4 (n=19) | Всего (n=460) | |||||
абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | ||
Нормальный кровоток | 1 сутки | 46 | 17,5 | 24 | 27,6 | 31 | 34,1 | 7 | 36,8 | 108 | 23,5 |
3 сутки | 67 | 25,5 | 31 | 35,6 | 38 | 41,7 | 10 | 52,6 | 146 | 31,7 | |
7 сутки | 74 | 28,1 | 35 | 40,3 | 42 | 46,1 | 11 | 57,9 | 162 | 35,2 | |
Гиперперфузия | 1 сутки | 98 | 37,3 | 32 | 36,8 | 35 | 38,5 | 5 | 26,3 | 170 | 37 |
3 сутки | 75 | 28,5 | 24 | 27,6 | 26 | 28,6 | 4 | 21,1 | 129 | 28,3 | |
7 сутки | 68 | 25,9 | 20 | 23 | 22 | 24,2 | 3 | 15,8 | 113 | 24,6 | |
Гипоперфузия | 1 сутки | 56 | 21,3 | 10 | 11,5 | 10 | 11 | 0 | 0 | 76 | 16,5 |
3 сутки | 42 | 16 | 10 | 11,5 | 9 | 9,9 | 0 | 0 | 61 | 13,3 | |
7 сутки | 42 | 16 | 9 | 10,3 | 8 | 8,8 | 0 | 0 | 59 | 12,8 | |
Кровоток затрудненной перфузии | 1 сутки | 29 | 11,1 | 12 | 13,8 | 9 | 9,9 | 5 | 26,3 | 55 | 11,9 |
3 сутки | 30 | 11,4 | 12 | 13,8 | 12 | 13,2 | 3 | 15,8 | 57 | 12,4 | |
7 сутки | 35 | 13,3 | 15 | 17,3 | 13 | 14,3 | 3 | 15,8 | 66 | 14,3 | |
Отсутствие кровотока | 1 сутки | 34 | 12,9 | 9 | 10,3 | 6 | 6,6 | 2 | 10,5 | 51 | 11,1 |
3 сутки | 42 | 16 | 9 | 10,3 | 6 | 6,6 | 2 | 10,5 | 59 | 12,8 | |
7 сутки | 44 | 16,7 | 9 | 10,3 | 6 | 6,6 | 2 | 10,5 | 61 | 13,3 | |
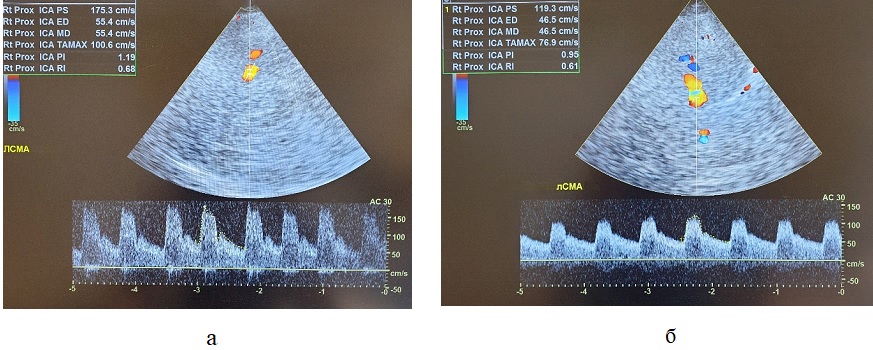
Рисунок 6 - Пациент Л., 73 лет, с ишемическим инсультом после тромболитической терапии, осложнившейся геморрагической трансформацией очага ишемии. Транскраниальное дуплексное сканирование артерий головного мозга через височное окно
Примечание: а – Первые сутки после тромболитической терапии: синдром гиперперфузии в виде ускорения пиковой систолической скорости кровотока до 175 см/с и усредненной по времени максимальной скорости кровотока (TAMAX) до 101 см/с в левой СМА у пациента с геморрагической трансформацией очага ишемии; б – 7-е сутки после тромболитической терапии: скоростные показатели в пределах нормативных значений – пиковая систолическая скорость кровотока 119 см/с, усредненная по времени максимальная скорость кровотока (TAMAX) 77 см/с в левой СМА у пациента с геморрагической трансформацией очага ишемии.
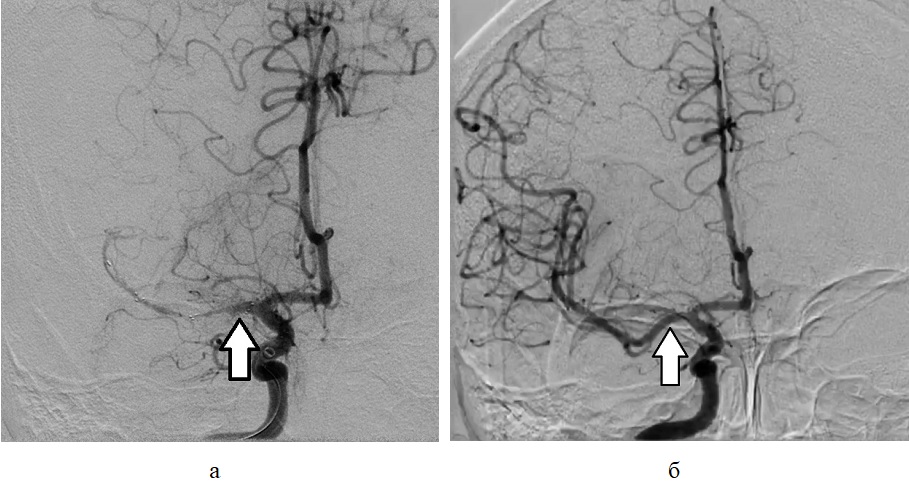
Рисунок 7 - Пациент А., 66 лет, с ишемическим инсультом, осложнившимся геморрагической трансформацией очага ишемии после тромбэкстрации
Примечание: рентгенконтрастная церебральная ангиография во фронтальной проекции: а – Отсутствие контрастирования СМА (стрелка) – тромбоз М1 сегмента СМА; б – Восстановление кровотока в СМА (стрелка) после тромбэкстракции
Таблица 7 - Распределение пациентов разных групп по результатам восстановления кровотока по данным дуплексного сканирования интракраниальных артерий
Степень восстановления кровотока | Группа 1 (n=263) | Группа 2 (n=87) | Группа 3 (n=91) | Группа 4 (n=19) | Всего (n=460) | |||||
абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
Полное восстановление | 117 | 44,5 | 54 | 62,1 | 64 | 70,3 | 14 | 68,4 | 249 | 54,1 |
Частичное восстановление | 102 | 38,8 | 24 | 27,6 | 21 | 23,1 | 3 | 21,1 | 150 | 32,6 |
Восстановление отсутствует | 44 | 16,7 | 9 | 10,3 | 6 | 6,6 | 2 | 10,5 | 61 | 13,3 |
4. Обсуждение
ГТ определяется как спонтанное кровоизлияние в ишемизированную зону после инфаркта мозга. Установлено, что риск развития ГТ повышается при наличии обширных ишемических очагов. Кроме того, большинство авторов связывают осложнение с кардиоэмболическим подтипом инсульта, чаще всего на фоне кардиальной патологии. Источником вторичной геморрагии в данном случае служит эмбол, вызвавший окклюзию церебральной артерии и подвергшийся фибринолизу, в условиях нарушения проницаемости капилляров. Понятно, что при проведении системной ТЛТ риск ГТ увеличивается. Другой возможной причиной ГТ является восстановление коллатерального кровообращения при отсутствии реканализации инфаркт-ассоциированной артерии. Способствующим фактором при данном механизме является повышенное артериальное давление .
Клинически выделяют бессимптомные и симптоматические формы ГТ. В исследовании ECASS II (2001) симптоматические ГТ предложено констатировать при увеличении оценки по шкале инсульта Национального института здравоохранения (NIHSS) на четыре или более баллов при установлении связи клинического ухудшения с кровоизлиянием . Ряд авторов предлагают рассматривать ГТ как признак реканализации, но, учитывая иные патофизиологические механизмы, в том числе окислительный стресс, воспаление, инфильтрацию лейкоцитами, нарушение внеклеточного протеолиза, приводящих к повреждению гематоэнцефалического барьера, реперфузия не является обязательным условием для возникновения ГТ.
Среди клинических факторов, ассоциированных с повышенным риском ГТ, в литературе приводят пожилой возраст, фибрилляцию предсердий, кардиоэмболический механизм инсульта, высокий балл по шкале NIHSS, гипергликемию, тромбоцитопению, отсроченную реперфузию, внутривенное введение рекомбинантного тканевого активатора плазминогена IV (rt-PA), одновременное применение антитромботических средств, антикоагулянтов, фибринолитических средств и эндоваскулярное лечение.
Массивный инфаркт головного мозга также относят к наиболее опасным факторам развития ГТ . Объем ишемического повреждения головного мозга является доказанным предиктором развития ГТ, значимость которого подтверждена при пороговом значении более 2 см. Вероятно, данный феномен объясняется тем, что внутри крупного очага ишемии выше риск формирования ишемической васкулопатии и повреждения сосудистой стенки , . С размером очага ишемии также коррелирует тяжесть неврологического дефицита, которая, в свою очередь, по данным настоящего исследования, может быть использована в качестве сильного предиктора ГТ. Результаты исследования совпадают с данными других авторов, которые отметили значимую корреляцию тяжести инсульта по NIHSS и размеров инфаркта с риском развития ГТ . По мнению ряда авторов, вторичные геморрагии чаще осложняют инсульты умеренной и выраженной степени тяжести (15 и более баллов по NIHSS) . В настоящей работе получены сходные результаты с пороговым значением NIHSS 15 балов. Преобладание среди инсультов, осложненных ГТ, кардиоэмболического подтипа, выявленное в данном исследовании, согласуется с данными литературы . Наличие значимого стенозирования экстракраниальных артерий явилось одним из факторов риска ГТ, возможно, за счет исходного дефицита церебрального кровотока и формирования очага ишемии большего размера, развития многочисленных коллатеральных ветвей как возможного источника геморрагии.
Проанализирована взаимосвязь потенциальных источников кардиогенной церебральной эмболии при ГТ: отмечено влияние гипертонической болезни, патологии сердечно-сосудистой системы, в частности, нарушений ритма, а также перенесенного ОИИ в анамнезе. В литературе имеются указания на взаимосвязь ГТ с фибрилляцией предсердий . Роль артериальной гипертензии в развитии ГТ изучалась многими исследователями , . Ряд авторов отрицает наличие взаимосвязи гипертонической болезни с риском ГТ, утверждая, что не хроническое повышение артериального давления, а только систолическая и/или диастолическая артериальная гипертензия в первые 24–48 ч от дебюта инсульта, то есть в период наиболее высокого риска развития спонтанных и посттромболитических ГТ, имеет значение для развития вторичной геморрагии и определяет ее объем , .
Помимо возможности регистрации микроэмболических сигналов, ДС интракраниальных артерий может существенно дополнять ангиографические данные, в том числе для контроля реканализации. Изменения скорости кровотока в инфаркт-ассоциированных интракраниальных артериях могут быть связаны с возникновением дальнейших сосудистых событий после инсульта . Увеличение пиковой систолической скорости кровотока в реканализированной артерии по отношению к контралатеральной артерии у пациентов после успешной реканализации ассоциировано с повышенным риском ГТ . Подобные утверждения встречаются в работах других авторов, которые сообщают о взаимосвязи повышения средней скорости кровотока после успешной реканализации с риском развития геморрагических осложнений . Нами подтверждена взаимосвязь повышения скоростных показателей интракраниального кровотока после реперфузии с частотой формирования ГТ, что согласуется с данными Baracchini C. с соавт. (2019) и Kneihsl M. с соавт. (2018) , . Отмечено, что гиперперфузия в ранние сроки после лечения ОИИ не имеет самостоятельного влияния на риск развития геморрагических осложнений, но в совокупности с другими перечисленными выше факторами может служить предиктором данного осложнения.
5. Заключение
Таким образом, геморрагическая трансформация ОИИ ассоциирована с тяжелым или умеренной тяжести (15 баллов и более по NIHSS) инсультом и большими (более 2 см) размерами очага повреждения. Среди инсультов, осложнившихся ГТ, ведущее значение имеет кардиоэмболический подтип. Кардиальная патология (гипертоническая болезнь, нарушения ритма), наличие перенесенного ОИИ в анамнезе являются факторами риска развития геморрагических осложнений в раннем периоде после реперфузии. Помимо клинических факторов, выявление гемодинамически значимого стенозирования экстракраниальных артерий и повышения скорости кровотока в интракраниальных артериях ультразвуковым методом имеет существенное значение в прогнозировании геморрагических осложнений в раннем периоде после реперфузии.
На основании исследования можем рекомендовать проводить оценку гемодинамики в церебральных артериях в раннем периоде после реваскуляризации не менее трех раз (1, 3 и 7 сутки после лечения). В случае, если синдром гиперперфузии на 7 сутки не регрессирует или увеличивается, то необходимо выполнение МСКТ головного мозга для исключения ГТ. Изменения гемодинамики в интракраниальных артериях в виде снижения КДС менее 30-35см/с и повышения RI более 0,76 свидетельствуют о нарастании отека головного мозга и развитии геморрагического осложнения, также являются показаниями к выполнению МСКТ.
