ANTIVIRAL ACTIVITY OF SODIUM CAPRYLATE AGAINST CONCERNING OF BOVINE VIRAL DIARRHEA VIRUSES OF CATTLE
Глотова Т.И.1, Глотов А.Г2., Семенова О.В3., Зубкова Н.В.4
1Доктор биологических наук, профессор; 2доктор ветеринарных наук, профессор; 3кандидат биологических наук ГНУ Институт экспериментальной ветеринарии Сибири и Дальнего Востока Россельхозакадемии; 4доктор биологических наук, филиал ФГУП НПО «Микроген» Минздравсоцразвития
ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ НАТРИЯ КАПРИЛАТА В ОТНОШЕНИИ ВИРУСА ВИРУСНОЙ ДИАРЕИ КРУПНОГО РОГАТОГО СКОТА В ОПЫТАХ IN VITRO
Аннотация
В экспериментах in vitro показана противовирусная активность каприлата натрия в отношении вируса вирусной диареи-болезни слизистых оболочек крупного рогатого скота.
Ключевые слова: противовирусная активность, цитотоксичность, инфекционная активность.
Glotova T.I.1, Glotov A.G.2, Semenova O.V.3, Zubkova N.V.4
1Doctor of Biological Sciences, Professor, head of the Laboratory of Virology, 2Doctor of Veterinary Sciences, Professor, head of the Laboratory of Virology, 3PhD in biological, Institute of Experimental Veterinary of Siberia and the Far East, 4Doctor of Biological Sciences branch of NPO "Microgen" the Health Ministry
ANTIVIRAL ACTIVITY OF SODIUM CAPRYLATE AGAINST CONCERNING OF BOVINE VIRAL DIARRHEA VIRUSES OF CATTLE
Abstract
In experiences in vitro investigated antiviral activity of sodium caprylate against concerning of bovine viral diarrhea viruses of cattle.
Keywords: the antiviral activity, cytotoxicity, infectivity.
Натрия каприлат – это натриевая соль каприловой (октановой) кислоты (С7Н15COOH), которая является одноосновной предельной карбоновой кислотой. В водном растворе натрия каприлат диссоциирует, образуя каприлат-ион, который уже более 50 лет используется производителями препаратов крови в качестве фракционирующего агента и стабилизатора альбумина [2, 4]. Недавно стало известно, что он обладает вирусинактивирующим действием, механизм которого еще недостаточно изучен. Полагают, что вирулицидным эффектом обладают недиссоциированные формы каприловой кислоты, образующиеся в водных растворах натрия каприлата при кислом значении рН, оптимально 4,0-4,8. Благодаря наличию неполярных связей С-О и С-Н, этот агент может внедряться в оболочку вируса, разрыхляя ее и препятствуя слиянию суперкапсида вируса с мембраной клетки [9, 10].
В последние годы эти свойства каприлат-иона заинтересовали производителей препаратов крови, и они начали использовать каприлат натрия в технологии производства иммуноглобулинов с целью повышения их вирусной безопасности, а также для достижения более высокого уровня очистки и выхода целевого продукта. Эффективность новой технологии в отношении основных гемотрансмиссивных вирусов подтверждена экспериментально. Кроме того, были продемонстрированы ее преимущества по сравнению с традиционной для иммуноглобулинов сольвент-детергентной обработкой [8 - 10].
В России каприлатная обработка иммуноглобулинов находится на стадии внедрения, оптимальные технологические режимы пока не отработаны. Поэтому изучение вирулицидных свойств этого реагента на модельных вирусах в опытах in vitro является чрезвычайно актуальной проблемой.
Целью настоящей работы было определение цитотоксичности и противовирусной активности натрия каприлата в отношении вируса ВД-БС КРС при различных схемах его применения в условиях in vitro в культуре клеток.
Материалы и методы
В работе использовали референтный цитопатогенный штамм ВК-1 (ВИЭВ, г. Москва) вируса вирусной диареи - болезни слизистых оболочек крупного рогатого скота (ВД-БС КРС); перевиваемую культуру клеток коронарных сосудов теленка (КСТ) (ВИЭВ, г. Москва); натрия каприлат (Sigma-Aldrich) (стерильный раствор 200 ммоль; рН 4,5-4,8).
Цитотоксическое действие натрия каприлата определяли в суточном монослое культуры клеток КСТ, выращенной в 96-луночных планшетах, в соответствии с «Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ» [3]. Десятикратные разведения натрия каприлата от 200 ммоль/см3 до 0,002 ммоль/см3 (уточнить единицу измерения) вносили в лунки на стадии формирования монослоя по 100 мкл в четыре параллельных ряда на каждое разведение и инкубировали в течение трех - пяти суток при температуре 37ºС в атмосфере 5% СО2 и 98% влажности, наблюдая в течение всего времени за изменениями в исследуемой системе. Результаты учитывали по появлению цитодеструкции и изменению морфологических свойств культуры клеток.
Противовирусную активность натрия каприлата в отношении вируса ВД-БС КРС определяли в культуре клеток КСТ, выращенной в 24-луночных микропланшетах. Монослой заражали вирусом ВД-БС КРС в дозе 5 lgТЦД50/0,1см3. Через 1,5 часа его отмывали питательной средой без сыворотки крови и вносили раствор натрия каприлата в нетоксичных для культуры клеток дозах (20,0 ммоль/см3, 2,0 ммоль/см3, 0,2 ммоль/см3), в контрольном опыте добавляли питательную среду без натрия каприлата.
Титры вируса определяли микрометодом в 96-луночных планшетах с монослоем культуры клеток КСТ, использованием не менее 4 параллельных рядов и выражали в ТЦД50/0,1 см3 (50%-я тканевая цитопатическая доза).
Противовирусный эффект натрия каприлата изучали в культуре клеток КСТ, которую обрабатывали нетоксичной дозой натрия каприлата (20,0 ммоль/см3), обладающей наибольшей противовируной активностью, в объеме 100 мкл на лунку за 1 ч до заражения клеток вирусом ВД-БС КРС (в дозе 1 ТЦД на клетку), в момент заражения и через 1 ч после инфицирования. В контрольные лунки не добавляли препарат. Результаты исследования способности каприлата натрия защищать инфицированные клетки путем предотвращения развития цитопатогенного действия вируса учитывали через 72 часа инкубации в сравнении с контрольной группой.
Статистическую обработку данных проводили в соответствии с общепринятыми методами [1].
Результаты и обсуждения
Вирус гепатита С, как известно, представляет опасность для реципиентов плазмы крови и препаратов, из нее изготовленных. Случаи инфицирования пациентов этим вирусом после применения некоторых препаратов из плазмы крови, включая иммуноглобулины, были зафиксированы [5]. Но одной из главных причин, по которой в настоящее время затруднен поиск эффективных вирусинактивирующих реагентов, направленных против гепатита С, является отсутствие удобной модельной биосистемы для размножения возбудителя этого заболевания, при которой бы количественно регистрировались жизнеспособные полноценные вирусные частицы.
ВД-БС КРС филогенетически близок к вирусу гепатита С, относится к тому же семейству Flaviviridae и имеет сходные биологические характеристики, при этом он абсолютно безопасен для исследователей. Поэтому он является наиболее приемлемой моделью вируса гепатита С для проведения исследований по оценке противовирусной активности реагентов, используемых в технологии производства препаратов крови [6].
Изучение цитотоксичности необходимо для того, чтобы правильно выбирать вирусинактивирующую дозу препарата. Оценку цитотоксичности проводили по четырех крестовой системе, анализируя морфологию клеток и целостность монослоя.
В результате разведения препарата от 20,0 ммоль/см3 и выше не оказывают цитотоксического действия на клетки.
Исследование противовирусной активности препарата проводили, используя три нетоксичные для культуры клеток дозы натрия каприлата (0,2; 2,0 и 20,0 ммоль/см3). Культуру клеток КСТ инфицировали 5,0 lg ТЦД50/0,1см3 вируса ВД-БС КРС штамм ВК-1.
На рисунке 1 представлены результаты снижения инфекционного титра вируса при обработке различными дозами натрия каприлата. Наибольшая редукция отмечена при концентрации натрия каприлата 20,0 ммоль/см3, титр вируса снизился до 2,37 lgТЦД50/0,1см3 в сравнении с контролем - 5,25 lgТЦД50/0,1см3. Остальные дозы натрия каприлата (2,0 ммоль/л и 0,2 ммоль/см3) снижали инфекционный титр вируса до 2,5 и 2,87 lgТЦД50/0,1см3. Следовательно, разница титров вируса в опытных и контрольных образцах была более чем в 2,5 lgТЦД50/см3, что свидетельствует о выраженной противовирусной активности натрия каприлата.
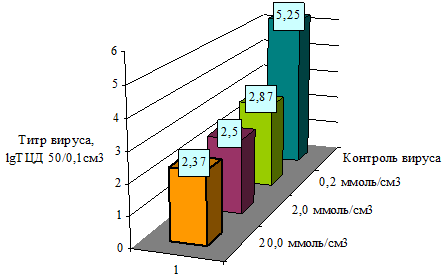
Рис. 1 – Определение противовирусной активности натрия каприлата в отношении вируса ВД-БС КРС
Актуальным является поиск противовирусных препаратов, оказывающих лечебное и лечебно-профилактическое действие, эффективно подавляющих или снижающих репликацию вируса в клетках. Поэтому целью следующего этапа работы было изучение способности натрия каприлата защищать инфицированные клетки путем предотвращения развития цитопатогенного действия вируса. Для этого выбрали наиболее эффективную в противовирусном отношении концентрацию испытуемого препарата – 20,0 ммоль/см3. По результатам наших исследований каприлат натрия в этой концентрации защищает 100% клеток от цитопатогенного действия вируса.
Натрия каприлат вносили в культуру клеток за 1 ч до заражения, в момент заражения и через 1 ч после адсорбции вируса на клетках. В контрольные лунки с инфицированной культурой клеток его не вносили. Результаты исследования представлены на рисунке 2.
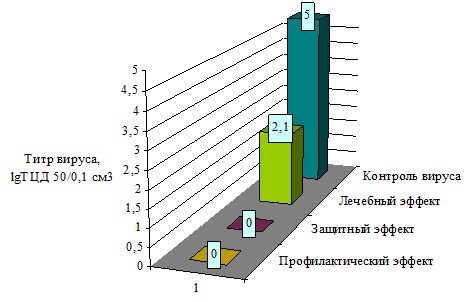
Рис. 2 - Противовирусный эффект натрия каприлата (концентрация - 20 ммоль/см3) в отношении вируса ВД-БС КРС
Полученные результаты свидетельствуют о том, что натрия каприлат обладает выраженным вирулицидным действием в отношении вируса ВД-БС и может быть использован для дальнейших исследований с целью изучения возможности его применения для обработки препаратов крови в качестве эффективного вирусинактивирующего реагента, направленного против вируса гепатита С.
Литература
1. Ашмарин И.П. Быстрые методы статистической обработки и планирования экспериментов / И.П. Ашмарин, Н.Н. Васильев, В.А. Амбросов. - Л.: Изд-во Ленингр. ун-та, 1974. – 76 с.
2. Иванов А.А. Определение каприлат-ионов в препарате крови «Раствор альбумина 10% для инфузий» методом ионэксклюзионной хроматографии / А.А. Иванов, В.Ю. Решетняк // Химико-фармацевтический журнал. – 2004. - № 5. - С.48-49.
3. Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - 2-е изд. – Москва, 2005. - 832 c.
4. Allary, M. Use of sodium caprylate for the separation of plasma proteins /M. Allary, J. Saint-Blancard// Ann Pharm Fr. – 1973. Vol. 7, №31. – Р. 513-520.
5. Bresee, J.S. Hepatitis C virus infection associated with administration of intravenous immune globulin. A cohort study / J.S. Bresee, E.E. Mast // JAMA. - 1996. Vol.19, № 276. – Р. 1563-1567.
6. Buckwold, V.E. Bovine viral diarrhea virus as a surrogate model of hepatitis C virus for the evaluation of antiviral agents / V.E. Buckwold, B.E. Beer //Antiviral Res. – 2003. Vol.1, № 60. - P.1-15.
7. Horowitz, B. Viral safety of solvent-detergent treated blood products / B. Horowitz, A.M. Prince // Dev Biol Stand. - 1993, №81. - P. 147-161.
8. Korneyeva, M. Enveloped virus inactivation by caprylate: a robust alternative to solvent-detergent treatment in plasma derived intermediates// M. Korneyeva, J. Hotta // Biologicals. – 2002. Vol. 2, №30. – Р.153-162.
9. Lebing, W. Properties a new intravenous immunoglobulin (IGIV-С, 10%) produced by virus inactivation with caprylate and column chromatography/ W. Lebing, K.M. Remindon //Vox Sang. – 2001. Vol. 84, № 3. - Р.193-201.
10. Lundblad, J.L. Inactivation of lipid-enviloped viruses in proteins by caprilate/ J.L. Lundblad, R.L. Seng // Vox Sang. – 1991, №60. – Р. - 75-81.
References
Ашмарин И.П. Быстрые методы статистической обработки и планирования экспериментов / И.П. Ашмарин, Н.Н. Васильев, В.А. Амбросов. - Л.: Изд-во Ленингр. ун-та, 1974. – 76 с.
Иванов А.А. Определение каприлат-ионов в препарате крови «Раствор альбумина 10% для инфузий» методом ионэксклюзионной хроматографии / А.А. Иванов, В.Ю. Решетняк // Химико-фармацевтический журнал. – 2004. - № 5. - С.48-49.
Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - 2-е изд. – Москва, 2005. - 832 c.
Allary, M. Use of sodium caprylate for the separation of plasma proteins /M. Allary, J. Saint-Blancard// Ann Pharm Fr. – 1973. Vol. 7, №31. – Р. 513-520.
Bresee, J.S. Hepatitis C virus infection associated with administration of intravenous immune globulin. A cohort study / J.S. Bresee, E.E. Mast // JAMA. - 1996. Vol.19, № 276. – Р. 1563-1567.
Buckwold, V.E. Bovine viral diarrhea virus as a surrogate model of hepatitis C virus for the evaluation of antiviral agents / V.E. Buckwold, B.E. Beer //Antiviral Res. – 2003. Vol.1, № 60. - P.1-15.
Horowitz, B. Viral safety of solvent-detergent treated blood products / B. Horowitz, A.M. Prince // Dev Biol Stand. - 1993, №81. - P. 147-161.
Korneyeva, M. Enveloped virus inactivation by caprylate: a robust alternative to solvent-detergent treatment in plasma derived intermediates// M. Korneyeva, J. Hotta // Biologicals. – 2002. Vol. 2, №30. – Р.153-162.
Lebing, W. Properties a new intravenous immunoglobulin (IGIV-С, 10%) produced by virus inactivation with caprylate and column chromatography/ W. Lebing, K.M. Remindon //Vox Sang. – 2001. Vol. 84, № 3. - Р.193-201.
Lundblad, J.L. Inactivation of lipid-enviloped viruses in proteins by caprilate/ J.L. Lundblad, R.L. Seng // Vox Sang. – 1991, №60. – Р. - 75-81.
