РЕАКЦИИ 3-ГАЛОГЕННИТРОПИРИДИНОВ С НУКЛЕОФИЛАМИ
РЕАКЦИИ 3-ГАЛОГЕННИТРОПИРИДИНОВ С НУКЛЕОФИЛАМИ
Научная статья
Гильманов Р.З., Фаляхов И.Ф., Хайрутдинов Ф.Г., Никитин В.Г.
Доцент, доктор химических наук, кафедра химии и технологии органических соединений азота, Казанский национальный исследовательский технологический университет
Аннотация
Работа посвящена изучению реакции нуклеофильного замещения в ряду 3-галогеннитропиридинов. Выявлены особенности нуклеофильного замещения 3-галоген-6-нитропиридина, где замещению подвергается или галоген, или нитрогруппа. Направление реакции определяется условиями процесса и характером реагента. Продукты нуклеофильного замещения 3-галогеннитропиридинов представляют практический интерес как потенциальные биологически активные вещества.
Ключевые слова: 3-галогеннитропиридин, нуклеофильное замещение, химическая активность, селективность.
Key words: 3-galogennitropiridin, nucleophilic substitution, the chemical activity, selectivity.
Имеющиеся в литературе сведения по нуклеофильному замещению 3-галогеннитропиридинов весьма ограничены. В основном литературный материал посвящен активированному нуклеофильному замещению в 2- и 4-галогеннитропиридинах.
Химическая активность 3-галогеннитропроизводных пиридина в реакциях нуклеофильного замещения значительно ниже по сравнению с 2- и 4-галогеннитропроизводными. Так, 2-хлор-5-нитропиридин легко взаимодействует с такими нуклеофильными реагентами, как гидразин [1], диалкиламин, аммиак [2], алкоголяты щелочных металлов [3], сероводород, образуя с количественными выходами соответствующие производные пиридина.

R=NHNH2, OH, SH, OC4H9
Проведение реакций нуклеофильного замещения 3-галогеннитро-производных пиридина требует более жестких условий. Так, замена атома брома на аминогруппу в 3-бром-6-нитропиридине проходит только под давлением при температуре 140ºС. Выход составляет 50% [4]:

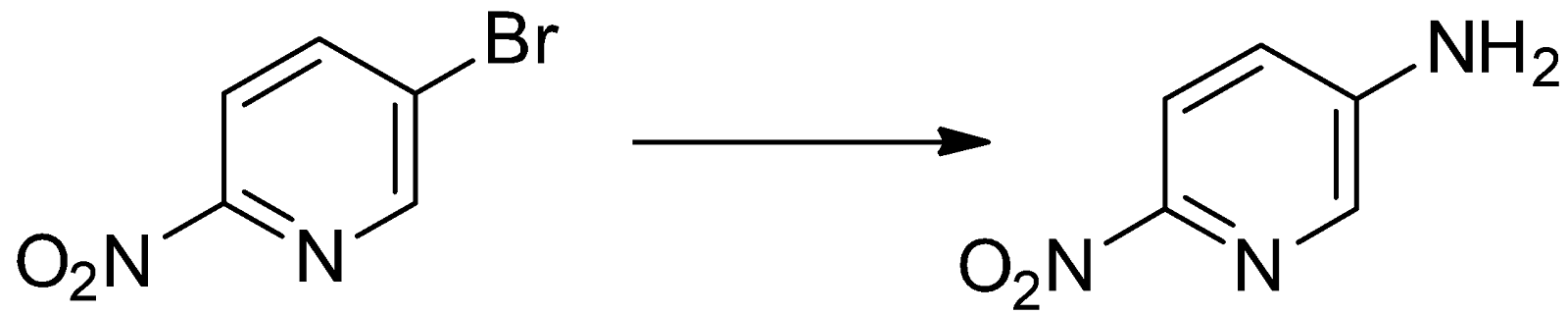
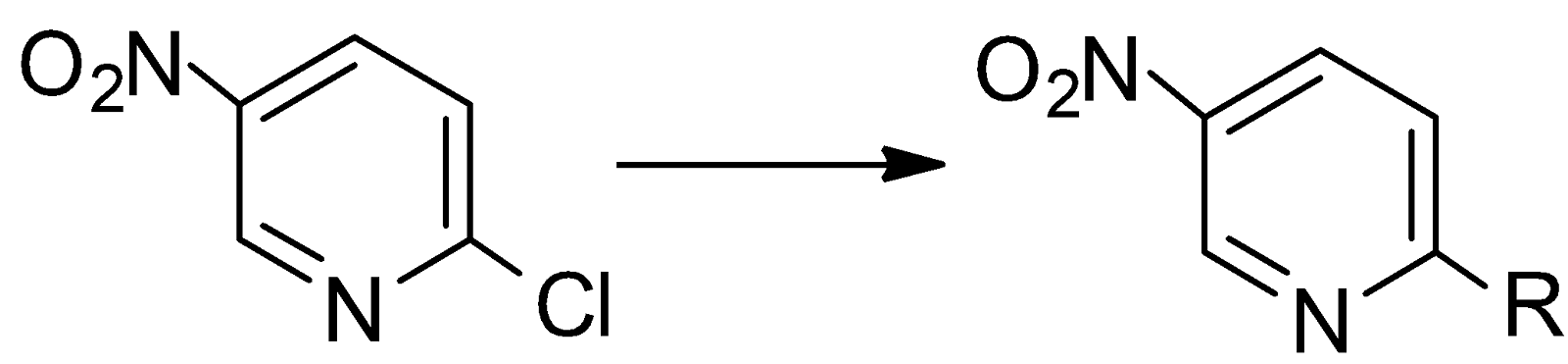
Замещение в 2-нитро-3-галогенпиридинах исследовалось в реакциях с аммиаком, морфолином, гидразином, анилином, галогенводородными кислотами исследовалось Азевым [5].
Установлено, что в реакции 2-нитро-3-галогенпиридинов с аммиаком и морфолином подвижность нитрогруппы и галогена соизмерима. Для каждого нуклеофила получены продукты замещения как нитрогруппы, так и галогена. В реакции с гидразином выделены только продукты замещения нитрогруппы.
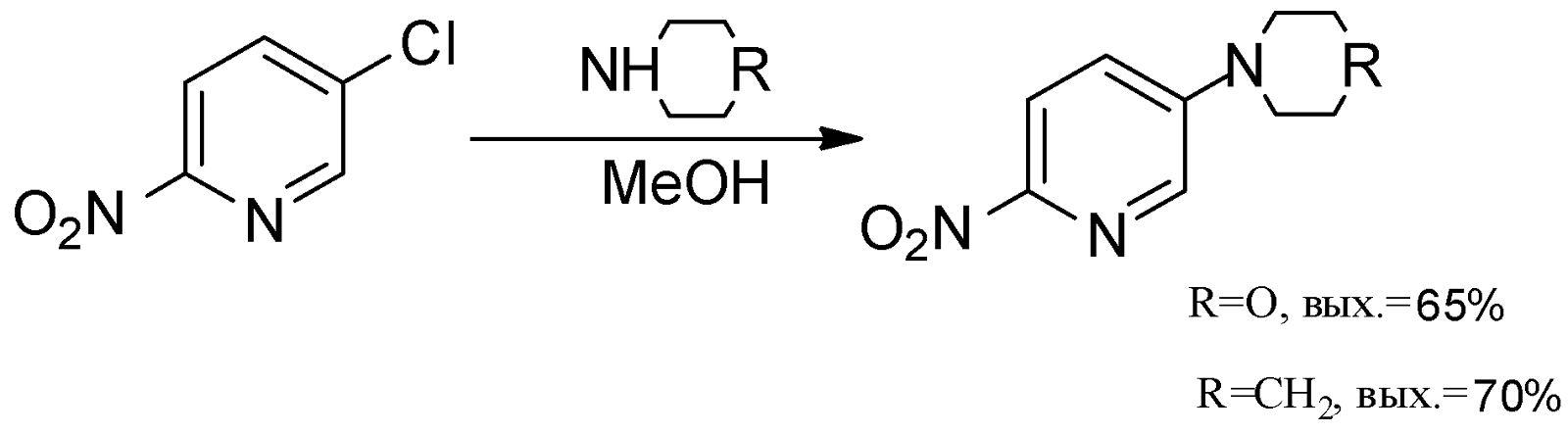
Экспериментальное изучение реакций 3-галоген-6-нитропиридинов (Hal=Br, Cl) с различными нуклеофилами привело к аналогичным результатам. При взаимодействии галогенпроизводных с аммиаком, алкиламинами, азидом натрия, анилином в кипящем этаноле или метаноле реакция не идет. Длительное кипячение 3-хлор-6-нитропиридина в среде метанола с избытком морфолина, пиперидина позволяет получить продукты замещения атомов галогена. Выхода составляют 65-70%:

Заместить атомы галогена на амино- и алкиламиногруппы удается в жестких условиях при повышенных температурах и под давлением.
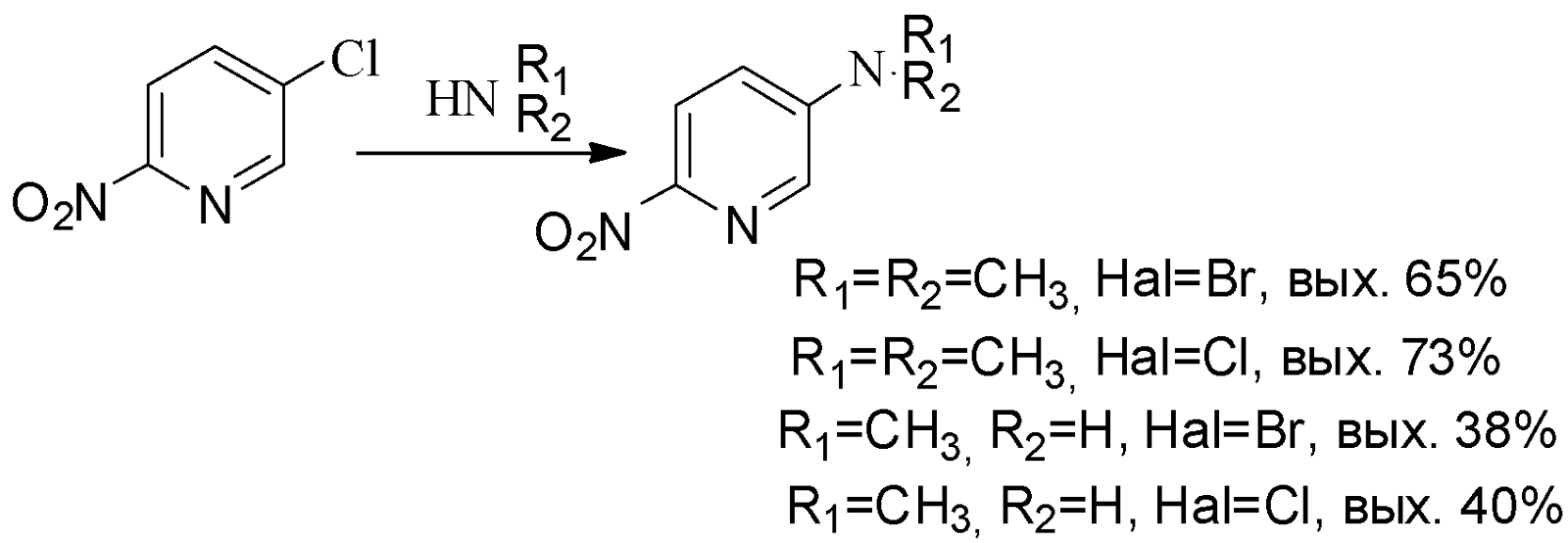
Так, взаимодействие 3-хлор-6-нитропиридина с водным аммиаком при температуре 140-150°С завершается образованием 3-амино-6-нитропиридина с выходом 58-60%. Алкиламинированием при температуре 100°С водными растворами метиламина и диметиламина получены соответствующие 3-алкиламино-6-нитропиридины:

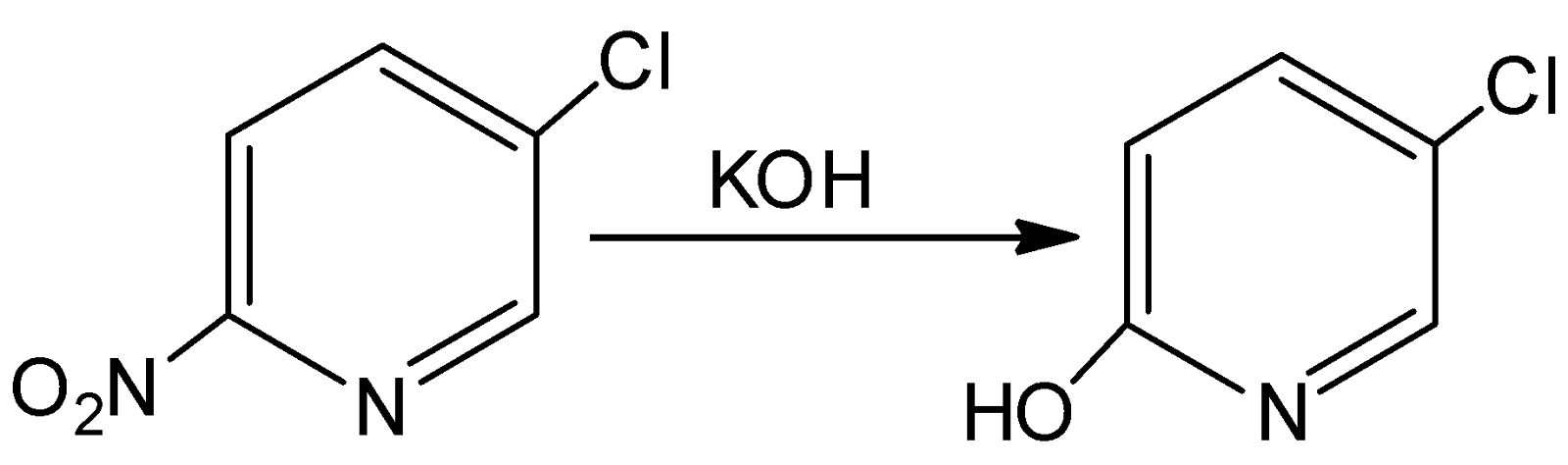
Взаимодействие 3-хлор-6-нитропиридина с гидроокисью калия в этаноле, ДМФА, ДМСО приводит к замещению только нитрогруппы:

Неоднозначно проходит реакция 3-хлор-6-нитропиридина с гидразингидратом. При кипячении реагентов в метаноле в течение часа происходит замещение нитрогруппы и образование 2-гидразино-5-хлорпиридина, если реакцию проводить в ДМФА – замещается галоген:

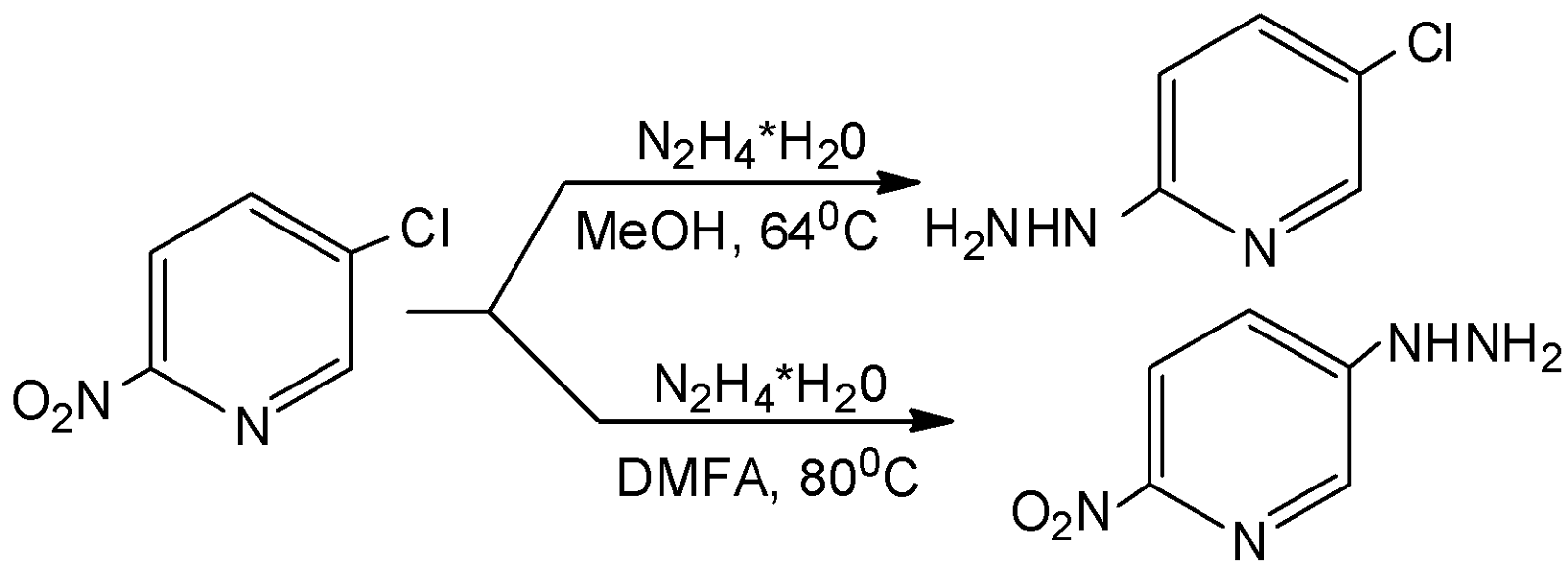
Использование диполярного апротонного растворителя (ДАР) – ДМФА, позволяет изменить селективность реакции, способствуя замещению атома галогена.
Использование ДАР в реакциях 3-галоген-6-нитропиридинов с азидом натрия приводит только к продукту замещения атома хлора.

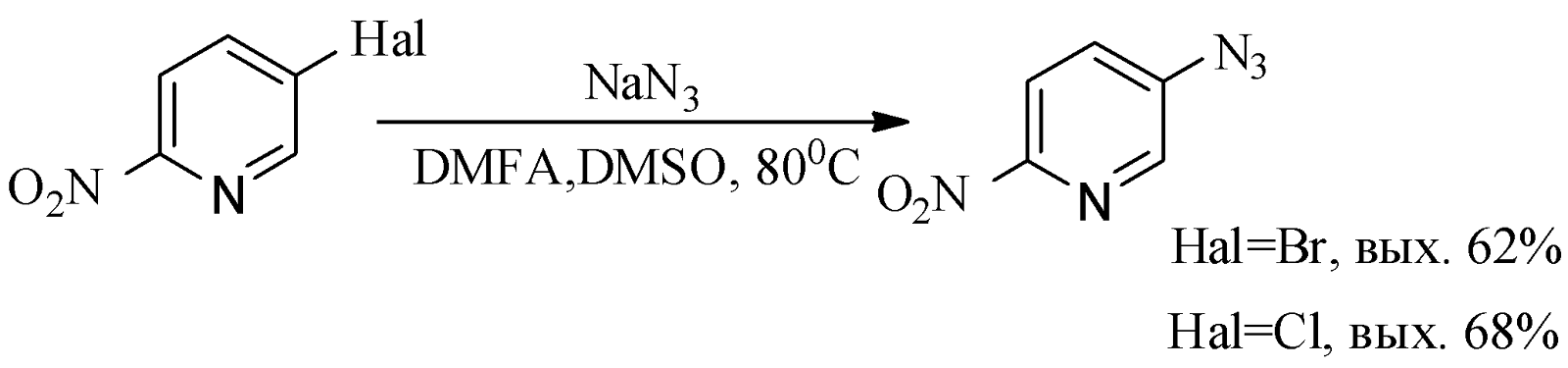
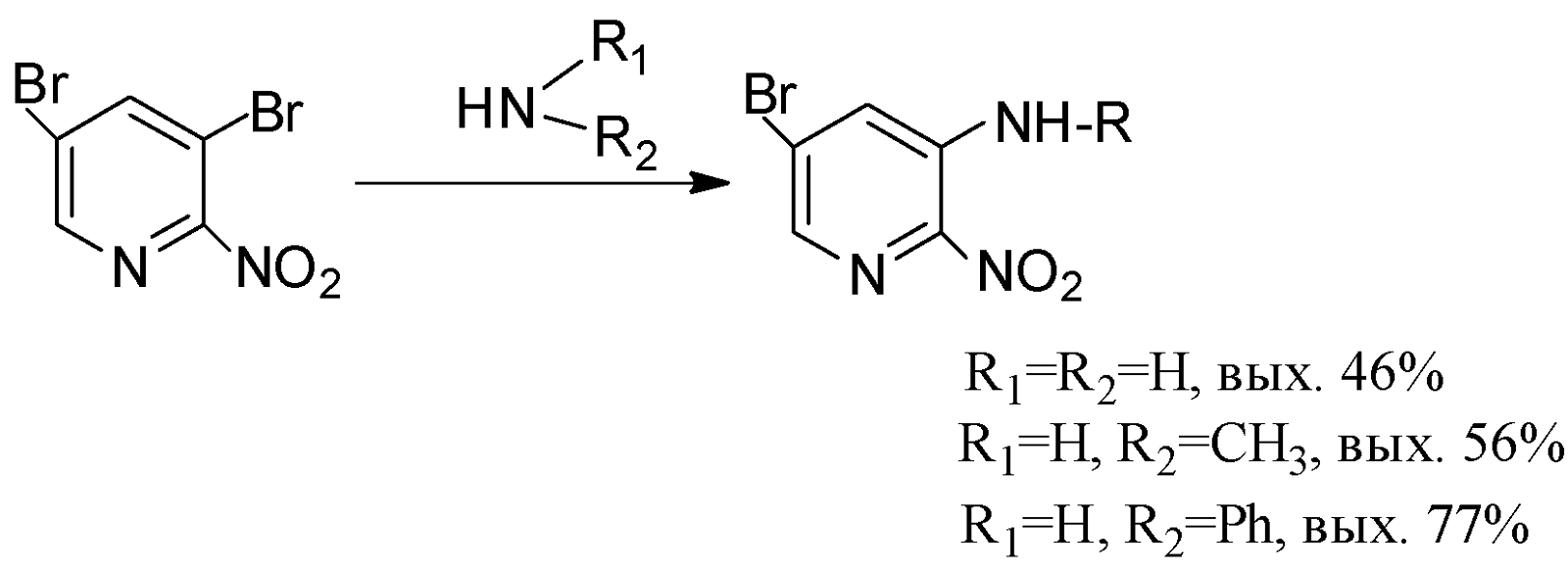
3,5-Дибром-2-нитропиридин в реакциях с нуклеофилами ведет себя более активно. Взаимодействие с аммиаком, метиламином, анилином проходит в кипящих спиртах и приводит к образованию 3-R-2-нитро-5-бромпроиз-водных пиридина.

Реакция 3,5-дибром-2-нитропиридина с азидом натрия проходит при комнатной температуре с образованием 3-азидо-5-бром-2-нитропиридина:

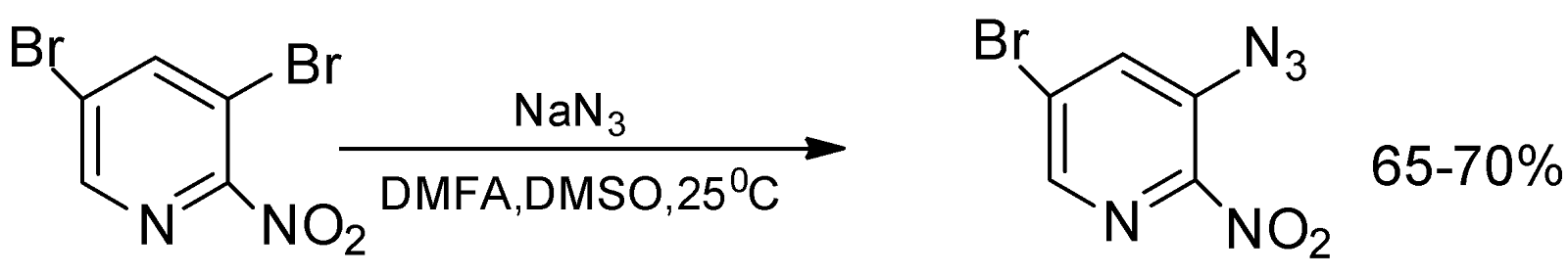
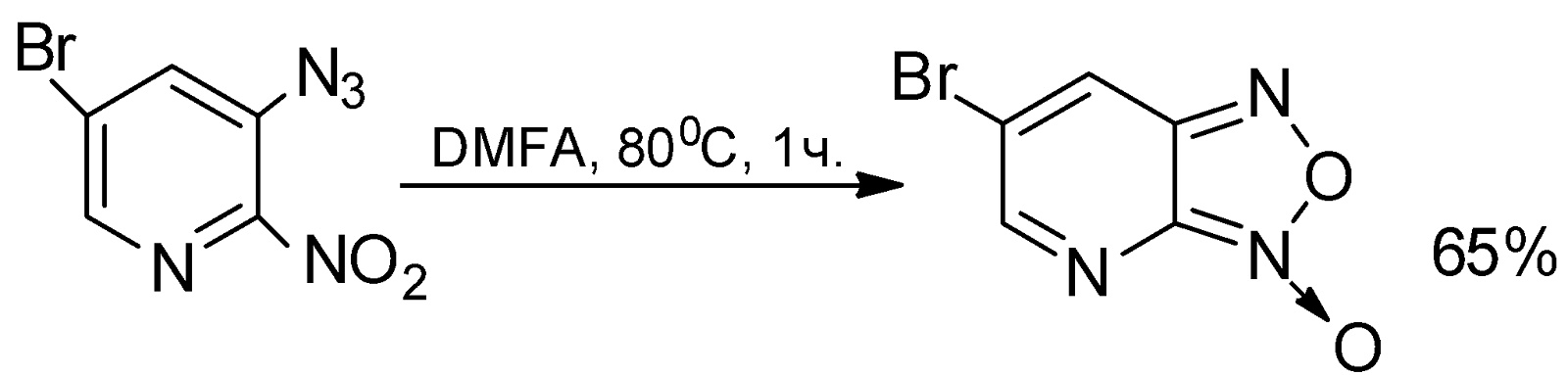
Строение 3-азидо-5-бром-2-нитропиридина доказано элементным анализом, ИК-спектрами, а также циклизацией азида в соответствующий [2,3-с]-5-бромпиридофуроксан.

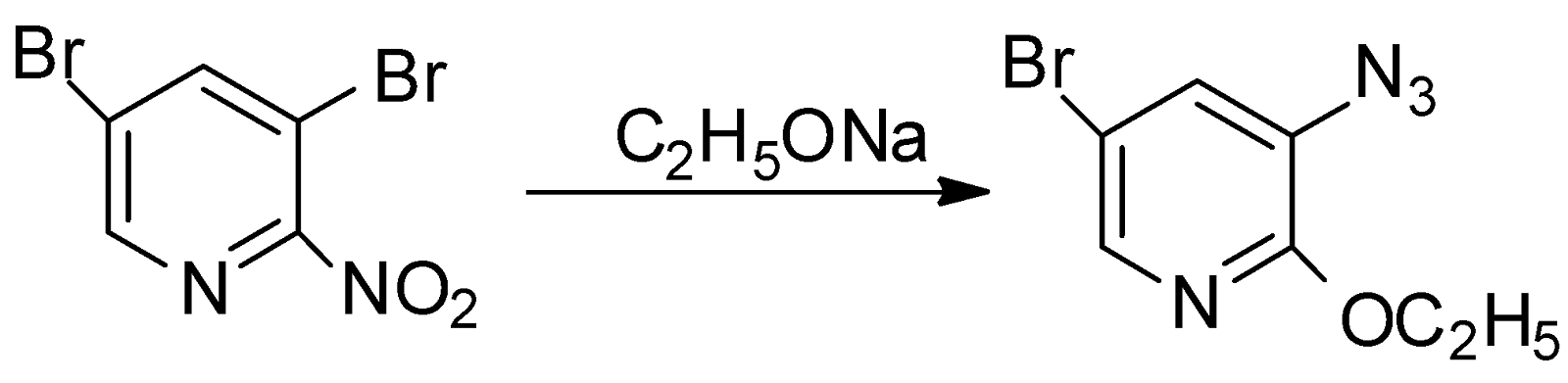
Взаимодействие 2-нитро-3,5-дибромпиридина с этилатом натрия, приводит к замещению нитрогруппы на этоксигруппу:

Анализ полученных результатов, а также имеющихся литературных данных показывает, что в 3-галоген-6-нитропиридинах нуклеофильному замещению подвергается или галоген, или нитрогруппа. Направление реакции определяется условиями процесса и характером реагента. Проследить какую-либо связь направления реакции с нуклеофильной способностью реагентов пока не удалось. Можно только констатировать, что азид натрия, аммиак, амины селективно взаимодействуют с заменой галогена, а гидразингидрат, гидроокись натрия, алкоголяты – с заменой нитрогруппы.
Экспериментальная часть
1. 3-амино-6-ниптропиридин. 10 г 3-хлор-6-нитропиридина нагревают в 190 мл 25%-го водного аммиака в течение 3 часов при 140°С. Реакционную массу охлаждают, осадок 3-амино-6-нитропиридина отфильтровывают, промывают водой, сушат. Выход 4,8 г(55%), Тпл 235°С (из этанола). По данным IV ( Hertog..) Тпл 234°С.
2. 3-метиламино-6-нитропиридин. 3,3 г 3-галоген-6-нитропиридина (Hal=Br, Cl) нагревают с 35 мл 25% водного раствора метиламина в течение 3 часов при температуре 100-110°С (в автоклаве). Реакционную массу охлаждают, отфильтровывают кристаллы 3-метиламино-6-нитропиридина, промывают их водой, эфиром. Если (Hal=Br), выход 0,95 г (38%), (Hal=Cl), выход 1,28г (40%). Тпл.186°С (из 50% -й уксусной кислоты). Найдено, %: С 46,90; N 27,0; H 4,43. C6H7N3O2. Вычислено, %: С 47,09; N 27,4; H 4,56. ИК-спектр
(см-1): υс=с 1600, υ-NH 3300, υSNO2 1325, υ aSNO2 1520.
3. 6-гидразино-3-хлорпиридин. 1,5 г 3-хлор-6-нитропиридина кипятят три часа в 30 мл 50%-го раствора гидразингидрата в метаноле. Выпавшие кристаллы отфильтровывают промывают метанолом, сушат. Выход 0,7 г (52%). Тпл 110°С (из метанола). Найдено, % С 41,60; N 29,01; Н4,10; Сl 24,90 C5H6N3Cl. Вычислено, % С 41,82; N29,30;Н 4,20; Сl 24,85.ИК-спектр (см-1): υ С=С, С=N 1580, 1600; υаsNH2 3550; υsNH2 3400; υNH 3250.
4. 3-азидо-6-нитропиридин. 3 г (0,019м) 3-хлор-6-нитропиридина и 1,5 г (0,023м) азида натрия нагревают в 30 мл ДМФА при температуре 80-85°С в течение 2 часов. Реакционную массу охлаждают до 20°С и прикапывают 60 мл воды. Осадок отфильтровывают, промывают водой, сушат. Выход 2 г (64%). Тпл 82°С (из этанола).
Список литературы / References
1. Эльдерфильд, Р. Гетероциклические соединения / Р. Эльдерфильд. — М: ИЛ, 1953. — т.1.— 406 с.
2. Cragol, E.J. The synthesis of arsenicals containing certain heterocyelic Naclei / E.J. Cragol, C.S. Hamilton // J. amer. Chem. Soc. — 1945. — V. 67. — P. 536.
3. Caldwele, W.T., Korneeld, E.C. Substituted-2 sylfonamido-5-aminopyridines / W.T. Caldwele, E.C. Korneeld // J. Amer. Chem.. Soc. — 1942. — V.64. — P. 1696.
4. Hertog, H.J. Influence of the solvent on the reactivity of halogeno and alkoxy-derivatives of nitropyridines towards ammonia / H.J. Hertog, C. Jouwersma // Rec. trav. Chem. — 1953. — V.72. — P. 125-34.
5. Азев, Ю.А. Нуклеофильное замещение в 2-нитро-5-галогенпиридинах / Ю.А. Азев, Г.А. Мокрушина, И.Я. Постовский // ХГС. — 1974. — № 6. —С. 792-795.
