АМИДЫ РЯДА ГОМОФУРФУРИЛАМИНА В СИНТЕЗЕ НОВЫХ ЦИКЛОПЕНТЕНОНОВ
АМИДЫ РЯДА ГОМОФУРФУРИЛАМИНА В СИНТЕЗЕ НОВЫХ ЦИКЛОПЕНТЕНОНОВ
Научная статья
Редькин В.А.1, Минтюкова М.Д.2, Строганова Т.А.3
1Аспирант, кафедра органической химии, Кубанский государственный технологический университет
2Студентка ИПиПП, Кубанский государственный технологический университет
3Доцент, к.х.н., кафедра органической химии, Кубанский государственный технологический университет
Аннотация
Предложен метод формирования циклопентенонового ядра на основе циклизации 1,4-дикетонов, образующихся в результате раскрытия фуранового кольца в амидах гомофурфуриламина.
Ключевые слова: раскрытие фурана, циклопентеноны, потенциальные БАВ.
Keywords: furan ring opening, cyclopentenons, potential biological active compounds.
1,4-Дикарбонильные соединения представляют собой удобные предшественники для получения различных карбо- и гетероциклических систем. Одним из возможных синтетических путей использования дикетонов является получение циклопентенонов. Интерес к производным циклопентенона обусловлен тем, что среди подобных соединений выявлено большое число веществ, проявляющих различные виды биологической активности [1-3]. Так, известны простагландины, содержащие циклопентеноновый фрагмент, и обладающие анитивирусной [4, 5], противоопухолевой [6, 7] и др. видами активности.
Использование фурановых соединений для формирования каркаса циклопентенона описано в литературе [8-10], однако применение в качестве исходных субстратов амидов гомофурфуриламина позволяет ввести в положение 2 циклопентенонового кольца амидометильную группу - СН2- NH-CO-Ar, гидролиз которой впоследствии даст выход на свободные амины.
В данной работе для получения новых производных циклопентенона мы использовали производные фурана – амиды ряда гомофурфуриламина.
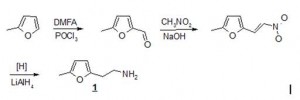
Исходный 2-(5-метилфур-2-ил)этанамин (гомофурфуриламин) 1 получен из сильвана в результате последовательности реакций, приведенной на схеме 1 и включающей стадии формилирования сильвана, получения нитроэтилена и его восстановления алюмогидридом лития.
Схема 1
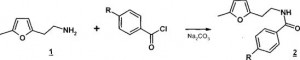
Амиды 2а-в синтезированы ацилированием гомофурфуриламина бен- зоил хлоридом и хлорангидридами пара-замещенных бензойных кислот (Схема 2).
Схема 2
2a R = Н; 2б R = Br; 2в R = NO2
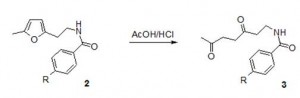
Для синтеза 1,4-дикетонов использовали различные системы, в которых фурановый цикл может подвергаться раскрытию, - газообразный хлороводород/этанол, диоксан/хлорная кислота, фосфорная кислота/уксусная кислота, соляная кислота/уксусная кислота. Однако в большинстве случаев реакция протекала с образованием сложных смесей продуктов, которые невозможно было разделить даже методом колоночной хроматографии.
Мы установили, что наиболее селективно превращение амидов 2 протекает в смеси соляной и уксусной кислот. При этом выходы продуктов раскрытия фуранового кольца - дикетонов За-в составляют 60-63 %. (Схема 3).
Схема 3
2a R = Н; 2б R = Br; 2в R = NO2
Раскрытие фураиового кольца и образование дикетона подтверждается данными 1Н ЯМР спекроскопии: в спектре дикетона исчезают характерные дублеты 3 и 4 фурановых протонов в области 5,86-6,03 м.д.
Рассматривая возможные пути циклизации дикетонов 3 в циклопентеноновый каркас, мы предположили два направления циклизации:
Направление а - в циклизации участвует метальная группа и карбонильная группа (2);
Направление б - образование циклопентенового кольца происходит в результате взаимодействия кетогруппы (1) и метиленового звена.
Возможность образования двух продуктов циклизации уже была отмечена ранее [9].
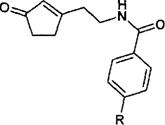
Циклизацию дикетонов 3в, производные циклопентенона проводили при кипячении в 2 %-ном водном растворе гидроксида натрия. При охлаждении из реакционной смеси выпадает продукт реакции.
Попытка циклизации дикетона Зв, содержащего в положении 4 бензольного кольца нитро группу, в этих условиях оказалась неудачной: наблюдалось сильное осмоление реакционной смеси и образование сложной неразделимой смеси продуктов.
Схема 4
 |
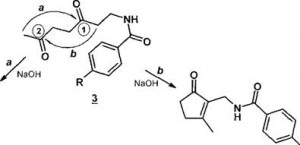 |
4a R = H; б R = Br; в R = NO2
На основании полученных спектров ЯМР 1Н установлено, что единственными продуктами циклизации дикетонов За,б являются циклопенте- ноны 4а,б. Спектры этих соединений характеризуются наличием синглета метальной группы интенсивностью ЗН в области 2,23...2,25 м.д. Сигнал метиленового звена, расположенного рядом с азотом амидной группы, представляет собой дублет интенсивностью 2Н в области 4,26.. .4,28 м.д.
Таким образом, нами на основе простых исходных веществ и с использованием известных реакций получены новые представители ряда циклопентенона - потенциальные биологически активные соединения и полупродукты для синтеза новых гетероциклических систем.
Экспериментальная часть
Спектры ЯМР 'Н записаны на спектрометре Bruker АМ-300 (300,13 МГц) в ДМСО-с16, внутренний стандарт ГМДС. ТСХ выполнена на пластинах Silufol и СОРБФИЛ, проявители пары йода, брома, раствор 2,4-ДНФГ.
Общая методика ацилирования 2-(5-метилфур-2-ил)этанамина 1
К раствору амина 1 (0,01 моль) в 50 мл безводного бензола прикапывают в течение 30 минут при перемешивании раствор хлорангидрида(0,011 моль) в 50 мл абсолютного бензола, после чего перемешивание продолжают ещё 1 час при комнатной температуре. Затем добавляют 100 мл холодного насыщенного водного раствора карбоната натрия, и смесь энергично перемешивают в течение 30 минут. После разделения фаз водную фазу экстрагируют бензолом, объединенные органические фазы промывают водой и высушивают над сульфатом натрия. Растворитель упаривают на роторном испарителе, а полученный маслообразный остаток очищают с помощью колоночной хроматографии (силикагель 50-100 µ, элюент петролейный эфир: ацетон : СН2С12 - 36:6:4,5).
5-Метил-2-(2-фенилкарбоксиамидоэтил)фуран (2а) - кристаллы кремового цвета с т.пл. 90-92 °С (из этилацетата). Выход 58 %.
Спектр ЯМР 1Н (CDC13), δ, м.д. (J, Гц): 2,28 (ЗН, д, СН3); 2,91 (2Н, т, J=6,4, CH2-Fur); 3,69...3,75 (2Н, м, CH2NH); 5,89 (1Н, д, J = 2,6, 4-HFur); 5,98 (1Н, д, J= 2.6, 3-HFur); 6,33 (1H, уш.с, NH); 7,40...7,49 (ЗН, м, 3, 4, 5- HAr); 7,43...7,46 (2H, м, 2, 6-HAr).
Найдено, %: С 73,40; Н 6,52; N 6,02. С14Н15NO2. Вычислено, %: С 73,34; Н 6,59; N 6,11.
2-[2-(4-Бромофенилкарбоксиамидо)этил]-5-метилфуран (2б) - кристаллы кремового цвета с т.пл. 122-124 °С (из этилацетата). Выход 67 %.
Спектр ЯМР 1Н (CDCI3), 5, м.д. (J, Гц): 2,27 (ЗН, д, СН3); 2,90 (2Н, т, J = 6,4, CH2-Fur); 3,67...3,73 (2Н, м, CH2-NH); 5,88 (1Н, д, J = 2,6, 4-HFur); 5,97 (1Н, д, J= 2,6; 3-HFur); 6,28 (1H, уш.с, NH); 7,54...7,62 (4H, м, НAr).
Найдено, %: С 54,64; Н 4,63; Вг 25,87; N 4,62. C14H14BrNO2. Вычислено, %: С 54,56; Н 4,58; Вг 25,93; N 4,55.
5-Метил-2-[2-(4-нитрофенилкарбоксиамидо)этил]фуран (2в) - кристаллы желтого цвета с т.пл. 103-105°С (из этилацетата). Выход 71 %.
Спектр ЯМР 1Н (CDC13), δ, м.д. (J, Гц): 2,27 (ЗН, д, СН3); 2,93 (2Н, т, J = 6,4, CH2 -Fur); 3,70...3,77 (2Н, м, CH2-NH); 5,89 (1Н, д, J = 2,6, 4-HFur); 5,99 (1Н, д, У = 2,6, 3-HFur); 6,46 (1H, уш.с, NH); 7,89 (2Н, д, 2-, 6-НАг); 8,28 (2Н, д, 3, 5-НАг).
Найдено, %: С 61,39; Н 5,21; N 10,13. C14H14N204. Вычислено, %: С 61,31; Н 5,14; N 10,21.
Общая методика синтеза дикетонов 3
К раствору амида 2а-в (0,001 моль) в 5 мл уксусной кислоты приливают 1 мл концентрированной соляной кислоты, и кипятят полученный раствор с обратным холодильником в течение 10-15 мин (контроль расхода исходных веществ по ТСХ). Реакционную смесь выливают в воду и нейтрализуют содой. Выпавшие кристаллы отделяют фильтрацией и перекри- сталлизовывают из смеси хлористый метилен - петролейный эфир.
N1-(3,6-диоксогептил)бензамид (За), выход 78 %, кристаллы белого цвета с т.пл. 86-87 °С.
Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 2,19 (ЗН, д, СН3); 2,65...2,84 (6Н, м, СО-СНгСН2-СО-СН2-); 3,70...3,76 (2Н, м, CH2-NH); 6,83 (1Н, уш.с, NH); 7,38...7,50 (ЗН, м, 3, 4, 5-НАг); 7,75...7,78 (2Н, м, 2, 6-НАг).
Найдено, %: С 68,08; Н 6,82; N 5,68. C14H17N03. Вычислено, %: С 68,00; Н 6,93; N 5,66.
Nl-(3,6-диoкcoгeптил)-4-бpoмoбeнзaмид (3б), выход 82 %, кристаллы белого цвета с т.пл. 128-129 °С.
Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 2,21 (ЗН, д, СН3); 2,45...2,64 (6Н, м, СО-СН2-СН2-СО-СНг); 3,50...3,56 (2Н, м, CH2-NH); 7,13 (1Н, уш.с, NH); 7,64 (2Н, д, J = 8,2, 2,6-НAr); 7,64 (2Н, д, J = 8,2, 3,5-НАг).
Найдено, %: С 51,63; Н 4,88; Вг 24,61; N 4,32. C14H16BrNO3. Вычислено, %: С 51,55; Н 4,94; Вг 24,50; N 4,29.
N-1-(3,6-Диоксогептил)-4-нитробензамид (Зв), выход 83 %, кристаллы светло-желтого цвета с т.пл. 106-108 °С.
Спектр ЯМР 1Н (CDC13), δ, м.д. (J, Гц): 2,20 (ЗН, д, СН3); 2,64...2,85 (6Н, м, СО-СН2-СН2-СО-СН2-); 3,73...3,79 (2Н, м, CH2-NH); 7,09 (1Н, уш.с, NH); 7,94 (2Н, д, J= 8,7; 2, 6-НАг); 8,26 (2Н, д, J = 8,7; 3, 5-НAr).
Найдено, %: С 57,62; Н 5,48; N 9,64. C14HI6N2O5. Вычислено, %: С 57,53; Н 5,52; N 9,58.
Общая методика получения циклопентенонов 3
Дикетон За,б (0,002 моль) кипятят в 40 мл 2 %-ного водного раствора гидроксида натрия до полного растворения (~10-15 мин). При охлаждении из реакционной смеси выпадает продукт реакции, который отделяют фильтрацией и перекристаллизовывают из смеси этилацетат : петролейный эфир (1:3).
N-1-(2-Метил-5-оксо-1-циклопентенилметил)бензамид (4а), бесцветные кристаллы с т.пл. 136-138 °С, выход 49 %.
Спектр ЯМР 1Н (CDC13), δ, м.д. (J, Гц): 2,25 (ЗН, д, СН3); 2,41 (2Н, м, С(СН3)-СН2-СH2); 2,57 (2Н, м, СН7-СН2-С=O); 4,28 (2Н, м, СН2-NН); 7,32 (1Н, уш.с, NH); 7,36...7,49 (ЗН, м, 3, 4, 5-НАг); 7,74...7,78 (2Н, м, 2, 6-НАг).
Найдено, %: С 73,25; Н 6,61; N 6,05. C14H15NO2. Вычислено, %: С 73,34; Н 6,59; N 6,11.
N-1-(2-Метил-5-оксо-1-циклопентенилметил)-4-бромобензамид (4б), порошок белого цвета с т.пл. 150-152 °С, выход 57 %.
Спектр ЯМР 1Н (CDCl), δ, м.д. (J, Гц): 2,23 (ЗН, д, СН3); 2,42 (2Н, м, С(СН3)-СН2-СH2); 2,59 (2Н, м, С1Г-СН2-С=O); 4,26 (2Н, д, J = 5,0; CH2-NH); 7,36 (1Н, уш.с, NH); 7,55 (2Н, д, J= 8,3; 2, 6-НАг); 7,64 (2Н, д, J= 8,3; 3, 5- НАг).
Найдено, %: С 54,48; Н 4,53; Вг 26,00; N 4,66. С14H14BrNO2. Вычислено, %: С 54,56; Н 4,58; Вг 25,93; N 4,55.
Список литературы / References
- R. М. Acheson, R. Robinson, J. Chem. Soc., 1952, 1127.
- А. И. Хубич, M.B. Шолух, Биохимия, 2006, 77, 3, 293.
- S. М. Roberts, М. G. Santoro, Е. S. Sickle, J. Chem. Soc., Perkin Trans. 1, 2002, 75, 1735.
- S. M. Roberts, M. G. Santoro, T. Guyot, J. Chem. Soc., Perkin Trans. 1, 1999, 77,2437.
- F. Pica, F. de Cesare, C. Amici, E. Garaci, M.G. Santoro, Cytotechnology, 1991, 5, 1,28.
- Yu-Chung Huang, Jih-Hwa Guh, Ya-Ching Shen, Che-Ming Teng, J. Biomed. Science, 2005, 12, 335.
- Y. Kikuchi, T. Kita, J. Hirata, M. Fukushima, Cancer and Metastasis Reviews, 1994, 13, 3-4, 309.
- A. G. Csaky, M. Mba, J. Plumet, Tetrahedron: Asymmetry, 2004, 75, 4, 647.
- F. D'Onofrio, G. Piancatelli, M. Nicolai, Tetrahedron, 1995, 51, 14, 4083.
- 10. K. Fukumoto, Heterocycles, 1978, 10, 469