БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ТОКСИЧЕСКОГО ДЕЙСТВИЯ ФТОРА НА ОРГАНИЗМ ЧЕЛОВЕКА
БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ТОКСИЧЕСКОГО ДЕЙСТВИЯ ФТОРА НА ОРГАНИЗМ ЧЕЛОВЕКА
Аннотация
В статье представлен литературный обзор, в котором рассмотрены биохимические механизмы токсического действия фтора на организм человека. В высоких концентрациях фтор действует как кумулятивный токсин, что приводит к повреждению механизмов энергетического обеспечения процессов жизнедеятельности. Ионы фтора способны связываться с функциональными группами аминокислотных остатков в активном центре ферментов, вызывая их ингибирование. Соединения фтора нарушают функции митохондрий, вызывая падение мембранного потенциала, что приводит к торможению работы дыхательной цепи, подавлению синтеза АТФ и усилению образования активных форм кислорода. На экспериментальных моделях показано, что окислительный стресс является одним из механизмов цитотоксичности фтора. Хроническое действие высоких концентраций фтора изменяет параметры углеводного и липидного обмена. При фтористой интоксикации наблюдаются разнонаправленные изменения в содержании в крови ряда важных гормонов — паратгормона, тиреотропного гормона и йодсодержащих гормонов щитовидной железы. Соединения фтора оказывают влияние на уровень фосфолипидов в мембранах разных органов и сыворотке крови. Фториды индуцируют апоптоз в лейкоцитах, фибробластах, альвеолоцитах и эпителиальных клетках лёгкого.
1. Введение
Фтор издавна известен своей мощной окислительной способностью. Этот элемент поступает в организм человека преимущественно с питьевой водой (в количестве 1–1,2 мг), а также в существенно меньших дозах с пищей, концентрируясь в костях и минерализованных зубных тканях . Важно отметить, что около четверти поступившего фтора задерживается в организме, при этом основная его часть (95%) аккумулируется в костном скелете . Незначительные концентрации фтора играют важную роль в процессах роста и развития организма . Его дефицит может привести к проблемам с фиксацией кальция в костной ткани и нарушению всасывания железа. В условиях недостатка фтора бактерии в полости рта более активно синтезируют лактат из глюкозы. Апатиты, имеющие общую формулу Сa10(PO)4X2, где X — анионы ОH⁻, образующие гидроксиапатит (ГАП) Ca10(PO4)6(OH)2 представляют собой «биологические» минеральные соединения . При этом существует возможность замещения ОH⁻ на F⁻, что приводит к образованию фторапатита (ФАП) - Ca10(PO4)6F2. ФАП содержится в небольших количествах в твердой фазе минерализованных тканей (менее 0,7%). Также присутствуют и другие типы апатитов, прочно связанные с органическим матриксом .
2. Основная часть
Фтор проявляет высокое сродство к белкам зубного матрикса и включается в структуру кристаллов ГАП либо на этапе формирования первичных кристаллов эмали, либо путем замены группы ОН¯ в уже сформированном кристалле . Формирование фторапатита обусловлено близкими ионными радиусами и одинаковым зарядом ионов фтора и гидроксила, а также схожей степенью гидратации. Это приводит к изменению кристаллической структуры. В результате реакции изоморфного замещения формируется смешанный тип апатита Са10(РО4)6(ОН)2-ХFХ. Концентрация этого элемента в зрелой зубной эмали обычно составляет 0,05 моль/кг, что отражается в соотношении групп ОН¯ к фтору в молекуле ГАП, примерно равном 40:1(см. рисунок 1).
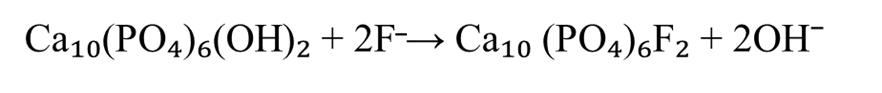
Рисунок 1 - Реакция изоморфного замещения ГАП при небольших концентрациях фтора
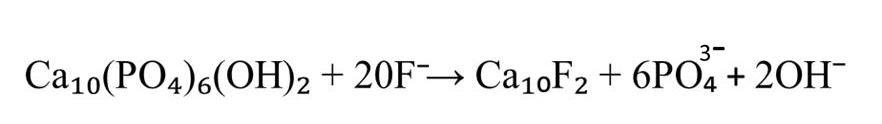
Рисунок 2 - Реакция изоморфного замещения ГАП при избыточном поступлении фторидов
На данный момент научное сообщество выделило пять основных способов, посредством которых неорганические фториды оказывают негативное воздействие на организм человека . В частности, фторсодержащие соединения оказывают влияние на:
1) клеточный метаболизм;
2) проницаемость мембран клеток;
3) окислительно-восстановительный баланс клеток, а также процессы транскрипции и трансляции;
4) различные пути передачи сигналов внутри клеток;
5) механизмы клеточной пролиферации и запрограммированной гибели клеток (апоптоз и некроз) , , .
Многочисленные научные работы демонстрируют, что повышенная концентрация фтора влечёт за собой нарушения в энергетическом обеспечении жизненно важных процессов, что выражается в нарушении работы ферментов . Важно подчеркнуть, что для поддержания стабильного уровня макроэргических соединений, в частности АТФ, необходимо постоянное производство этих молекул в клетках в процессе биологического окисления. Субстратами для этой реакции служат продукты катаболизма, где дегидрирование выступает как экзергонический процесс . Энергия, выделяющаяся при окислении, может рассеиваться в виде тепла или частично использоваться для фосфорилирования АДФ с образованием АТФ .
Экспериментальные данные подтверждают, что фтор является одним из ингибиторов, нарушающих биоэнергетические процессы в тканях . В результате катаболизма глюкозы, являющейся основным источником энергии, образуется пируват, который при участии ферментов пируватдегидрогеназного комплекса преобразуется в ацетил-КоА. В цикле Кребса (ЦТК) в реакцию вступают ацетил-КоА, оксалоацетат и 2-оксоглутарат. В ходе этих превращений формируются изоцитрат, α-кетоглутарат, сукцинат и малат, которые служат субстратами для следующего этапа энергетического обмена — биологического окисления. Снижение концентрации образующихся субстратов и подавление ферментов ЦТК, приводящее к снижению производства АТФ, нарушает энергообеспечение клеток (см. рисунок 3).
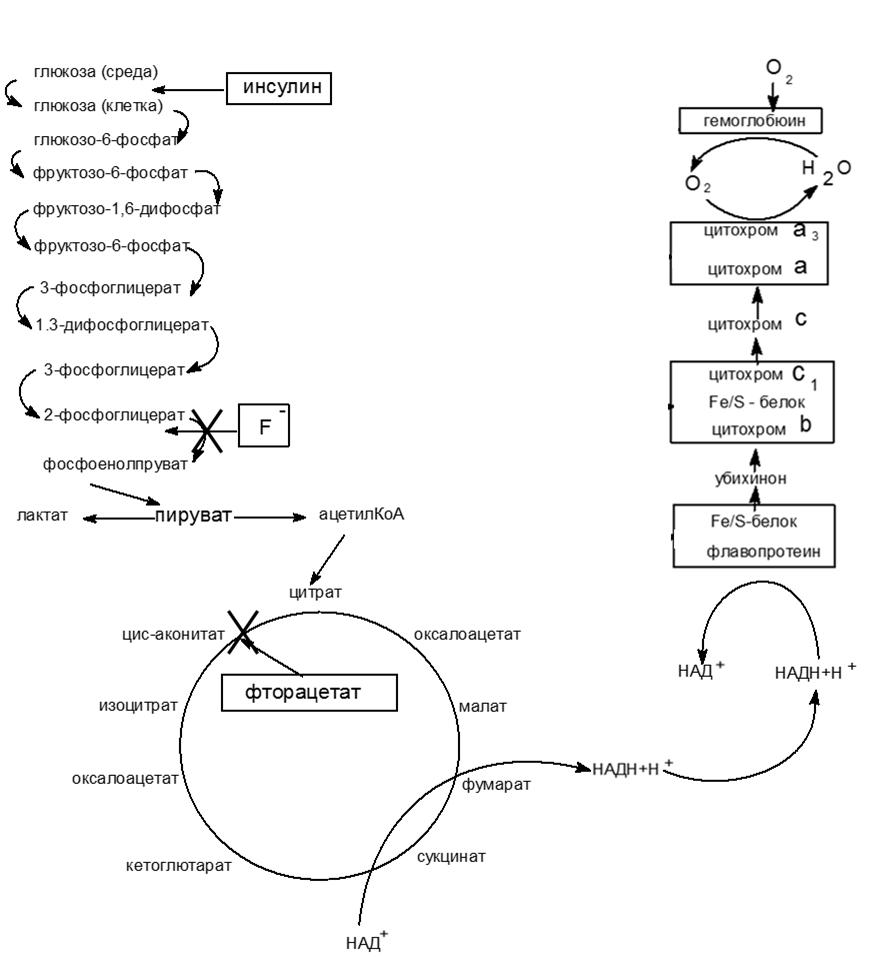
Рисунок 3 - Влияние фтора на основные процессы биоэнергетики
Подводя итог вышесказанному, можно отметить, что, экспериментальные данные убедительно свидетельствуют о негативном влиянии фтора на ключевые процессы клеточной энергетики. Подавляя цикл Кребса, этот элемент нарушает нормальное производство АТФ — главного энергетического «топлива» клеток, что, в свою очередь, приводит к сбоям в их функционировании и может иметь серьезные последствия для здоровья. Понимание механизмов его влияния на биоэнергетические процессы необходимо для разработки эффективных стратегий профилактики и снижения негативных последствий, связанных с воздействием этого элемента. Будущие исследования должны быть направлены на более глубокое изучение метаболизма фтора и его взаимодействия с ферментами цикла Кребса, а также на поиск путей нейтрализации его токсического воздействия на клеточный энергетический обмен.
Современные исследования показывают, что фторсодержащие вещества обладают высокой аффинностью к некоторым ионам металлов, выступающим в роли кофакторов ферментов, участвующих в основных метаболических путях . Механизмы воздействия фтора зависят от его концентрации и типа фермента, вследствие чего фтор может подавлять активность ферментов (например, миллимолярные концентрации ингибируют фосфатазы) или, в некоторых случаях, стимулировать их активность . Установлено, что ионы фтора способны связываться с функциональными группами аминокислотных остатков (треонин, валин, лейцин) в активном центре ферментов, что приводит к их ингибированию, например, активности Na+, K+-АТФазы, что ведет к уменьшению уровня АТФ в клетке и нарушению мембранного потенциала .
На основании вышеизложенного следует подчеркнуть, что влияние фторсодержащих веществ на ферментативные процессы – это сложный и многогранный феномен. От концентрации фтора и специфики фермента зависит, будет ли он стимулировать или подавлять активность фермента. Это обусловлено его способностью взаимодействовать с ионами металлов — кофакторами ферментов и функциональными группами аминокислотных остатков в активном центре.
В результате, воздействие фтора на ключевые ферменты, такие как Na+, K+-АТФаза, приводит к каскаду нарушений в клеточном метаболизме, включая снижение уровня АТФ и изменение мембранного потенциала.
Продолжительное воздействие повышенных концентраций фторидов негативно влияет на метаболизм углеводов и липидов . Исследования на грызунах демонстрируют, что уже к четвертой неделе отравления фтором развивается гипергликемия. В бета-клетках поджелудочной железы этих животных отмечается снижение уровня мРНК, кодирующей инсулин. Фторид-ионы также угнетают пентозофосфатный путь, в частности, фермент глюкозо-6-фосфатдегидрогеназу , .
В заключение следует отметить, что, накопление фторидов в организме оказывает глубокое и многогранное воздействие на ключевые метаболические процессы. Нарушение углеводного и липидного обмена, вызванное фторидной интоксикацией, представляет собой серьезную угрозу для здоровья.
Соединения фтора оказывают деструктивное воздействие на митохондрии, вызывая снижение мембранного потенциала и формирование гигантской поры на внешней мембране . Открытие этой поры приводит к набуханию митохондриального матрикса, разрыву внешней мембраны и высвобождению цитохрома С из межмембранного пространства. Утрата цитохрома С митохондриями нарушает работу дыхательной цепи, подавляет синтез АТФ и стимулирует образование активных форм кислорода (АФК). Более того, нарушение барьерной функции митохондриальных мембран под влиянием ионов фтора способствует развитию апоптоза , .
Окислительный стресс является одним из ключевых механизмов цитотоксичности фтора, что подтверждается результатами различных экспериментальных исследований. Фтор действует как прооксидант, стимулируя генерацию супероксидного аниона, пероксида водорода, гидроксильного радикала и оксида азота (NO) в клетках , . Фтористые соединения подавляют активность антиоксидантных ферментов, таких как супероксиддисмутаза (СОД), каталаза и глутатионпероксидаза . Дисбаланс между прооксидантами и антиоксидантами приводит к активации свободно-радикальных процессов и повреждению мембранных структур клеток различных органов и тканей . Интоксикация высокими дозами фтора подтверждается повышенной активностью глутатионтрансферазы и снижением активности глутатионредуктазы в слюне пациентов с флюорозом. Снижение активности глутатионредуктазы при фтористой интоксикации может указывать на угнетение пентозофосфатного пути и, как следствие, анаболических процессов .
Таким образом, воздействие фторидов на митохондрии и антиоксидантную систему клетки представляет собой сложный и многогранный процесс, приводящий к серьезным нарушениям клеточного метаболизма и развитию цитотоксичности. Фтор, нарушая целостность митохондрий и стимулируя окислительный стресс, запускает каскад патологических реакций, в конечном итоге приводящих к апоптозу и повреждению тканей. Полученные данные подчеркивают важность дальнейшего изучения механизмов токсического действия фтора и разработки эффективных стратегий для защиты клеток от его негативного воздействия. Будущие исследования должны быть направлены на поиск антиоксидантных соединений и митопротекторов, способных смягчить или предотвратить разрушительные эффекты фтора на клеточном уровне.
Известно, что воздействие фторидов уменьшает транспорт ионов кальция (Са2+) через эндоплазматический ретикулум и плазматические мембраны клеток почек, а также в саркоплазматическом ретикулуме кардиомиоцитов, что связано со снижением концентрации белков-переносчиков Са2+ и ингибированием Са2+ насосов . В нервных клетках фтор подавляет активность фосфолипазы С, снижая образование диацилглицерола (ДАГ), вторичного мессенджера, и поступление Са2+ в клетку. Однако в цитозоле других тканей (эритроциты, остеобласты, проксимальные канальцы, фибробласты, эндотелиальные клетки) отравление фтором вызывает увеличение концентрации Са2+ . Доказано, что фтористые соединения ингибируют ферменты, регулирующие фосфорно-кальциевый обмен, в частности, снижают активность 1α-гидроксилазы в проксимальных канальцах, что приводит к уменьшению продукции и концентрации 1,25(ОН)2D3-кальцитриола в сыворотке крови. Следует обратить внимание на то, что в настоящее время науке известно порядка 80 белков, участвующих в ключевых метаболических процессах организма, чья активность подвержена обратимым изменениям под воздействием фторид-ионов.
Нарушение транспорта ионов кальция, ингибирование ключевых ферментов, регулирующих фосфорно-кальциевый обмен, а также изменение концентрации вторичных мессенджеров — все это свидетельствует о потенциальном токсическом воздействии фторидов на клеточные функции. Понимание механизмов, посредством которых фториды вмешиваются в регуляцию кальциевого гомеостаза, имеет решающее значение для разработки эффективных стратегий профилактики и лечения фторидной интоксикации.
Важно подчеркнуть, что при интоксикации фтором наблюдаются разнонаправленные колебания концентрации ряда важных гормонов в крови . Эти фазовые изменения гормонального фона отражают компенсаторные механизмы организма, активизирующиеся в ответ на пролонгированное воздействие фторсодержащих соединений . В частности, высокие концентрации фтора стимулируют секрецию паратгормона (ПТГ), что подтверждается экспериментальными данными, демонстрирующими превышение контрольных значений уровня этого гормона в крови подопытных крыс в 5 раз . Доказано, что повышенный уровень ПТГ, увеличивая приток ионов кальция в клетки, способствует разобщению окислительного фосфорилирования, снижению синтеза АТФ и оказывает негативное влияние на метаболизм липидов и углеводов .
Результаты исследований свидетельствуют о том, что длительное воздействие фтора вызывает изменения в концентрации тиреотропного гормона (ТТГ) и йодсодержащих гормонов щитовидной железы — трийодтиронина (Т3) и тироксина (Т4) в крови , . При этом динамика уровня этих гормонов определяется продолжительностью воздействия повреждающего фактора. На начальной стадии наблюдается увеличение уровня как ТТГ, так и Т4, при одновременном снижении концентрации Т3. Затем уровень ТТГ и гормонов щитовидной железы возвращается к исходным значениям, а при дальнейшем воздействии повреждающего фактора наступает фаза угнетения, характеризующаяся снижением уровня ТТГ, Т4 и Т3. Известно, что гормоны щитовидной железы играют ключевую роль в регуляции окислительно-восстановительных процессов и основного обмена, обеспечивая более интенсивное функционирование организма в условиях стресса , .
При профессиональном воздействии фтора, когда рабочие электролизных цехов вдыхают около 10 мг фтора за смену, его влияние на организм существенно сильнее (примерно в 30 раз), чем при поступлении фтора с питьевой водой. В связи с этим было проведено исследование состояния здоровья работников алюминиевого завода, занятых в электролизном производстве, с учетом их стажа работы. Данные из научной литературы о влиянии производственных условий на функцию щитовидной железы, оцениваемую по способности поглощать йод, указывают на ее пониженную активность. В то же время, клинические исследования демонстрируют, напротив, повышенную функцию железы, которая усиливается с увеличением рабочего стажа.
При этом было замечено снижение уровня трийодтиронина (Т3) на ранних этапах интоксикации фтором, при нормальном уровне тиреотропного гормона (ТТГ). При продолжительном контакте с фтором наблюдается ослабление тиреотропной функции гипофиза. Следовательно, представления о состоянии щитовидной железы при длительном воздействии фторидов на производстве остаются противоречивыми и основаны на ограниченном количестве наблюдений. Исследование тиреоидного статуса у рабочих электролизных цехов, учитывающее продолжительность контакта с фторидами и стадию заболевания, выявило специфические особенности функционирования щитовидной железы, не проявляющиеся в виде явных симптомов гипо- или гипертиреоза. Снижение способности щитовидной железы поглощать йод, прогрессирующее с увеличением рабочего стажа и стадии заболевания, выражено умеренно и не приводит к нарушениям в процессе образования и выделения тиреоидных гормонов, что подтверждается стабильным уровнем Т4. Снижение концентрации Т3, усугубляющееся с увеличением стажа и стадии флюороза, является достаточно значительным и соответствует картине гипотиреоза. Вероятно, синдром низкого уровня Т3 связан с воздействием фтора на преобразование Т4 в Т3 на периферии, в тканях-мишенях, хотя этот эффект может быть опосредован нарушением функции других эндокринных желез. В частности, снижение уровня андрогенов при хронической интоксикации фтором, которое активно изучалось в последние годы, может вызывать сопутствующие изменения в работе щитовидной железы , .
Не исключено, что синдром низкого уровня Т3 связан с поражением печени, которое часто встречается при флюорозе. Наиболее часто (75,6%) синдром низкого уровня Т3 наблюдался у рабочих с начальными проявлениями профессионального заболевания. Это указывает на важную роль печени в процессе дейодирования Т4, который преимущественно происходит в клетках печени. Вероятно, печень играет ключевую роль в развитии синдрома низкого уровня Т3. Синдром низкого уровня Т3, который наблюдается при различных острых и хронических заболеваниях, а также в условиях метаболического стресса, таких как голодание и недостаточное питание, возможно, способствует снижению скорости обмена веществ с целью сохранения энергии.
Как показали проведённые исследования, фтор-индуцированная интоксикация представляет собой сложный процесс, затрагивающий ключевые гормональные системы организма. Разнонаправленные колебания концентраций паратгормона, тиреотропного гормона и йодсодержащих гормонов щитовидной железы отражают многоступенчатый адаптационный ответ на хроническое воздействие фторсодержащих соединений.
Важно отметить, что нарушение гормонального баланса, вызванное фтором, может иметь далеко идущие последствия для метаболизма липидов, углеводов и энергетического обмена в целом. Понимание взаимосвязи между интоксикацией фтором и гормональным дисбалансом открывает новые перспективы для разработки терапевтических подходов, направленных на восстановление гормонального гомеостаза и минимизацию негативных последствий воздействия фтора на организм.
Анализ полученных данных позволил установить влияние соединений фтора на концентрацию фосфолипидов в мембранах различных органов и сыворотке крови . Интоксикация фторидами также сопровождается изменением соотношения насыщенных и полиненасыщенных жирных кислот в липидах эритроцитов и гепатоцитов, с преобладанием повышенным количеством миристиновой, олеиновой, линолевой кислот и достоверным снижением уровня арахидоновой кислоты . Важно отметить, что изменения в составе жирных кислот происходят на фоне повышенной активности фосфолипазы А2, что указывает на потенциальные нарушения в синтезе эйкозаноидов, таких как простагландины, простациклины, тромбоксаны и лейкотриены .
Таким образом, полученные данные убедительно демонстрируют, что соединения фтора оказывают выраженное воздействие на липидный состав биологических мембран и сыворотки крови. Изменения в концентрации фосфолипидов и соотношении жирных кислот, вызванные фторидной интоксикацией, свидетельствуют о серьезных нарушениях в метаболизме липидов.
При этом повышенная активность фосфолипазы А2 на фоне измененного жирнокислотного профиля указывает на потенциальный сбой в синтезе эйкозаноидов – ключевых регуляторов воспаления, иммунитета и гемостаза.
Известно, что высокие концентрации фтора индуцируют некроз гепатоцитов и тимоцитов, в патогенезе которого участвуют активные формы кислорода (АФК) и повышение уровня внутриклеточного кальция . Фториды являются индукторами апоптоза в лейкоцитах, фибробластах, альвеолоцитах и эпителиальных клетках легкого . Механизмы апоптоза, индуцированного фтором, включают:
1) увеличение уровня АФК и активацию свободно-радикального окисления ;
2) повреждение митохондрий и активацию митохондриального пути апоптоза ;
3) повышение уровня внутриклеточного кальция и увеличение числа клеток, экспрессирующих маркер апоптоза – аннексин V ;
4) активацию каспазного каскада — каспаз 3, 8 и 9 ;
5) изменение активности внутриклеточных сигнальных путей — повышение активности протеинкиназы С, MAPK , .
3. Заключение
В заключение, анализ многочисленных исследований показывает, что фтор, являясь высокотоксичным веществом, способен вызывать острые нарушения энергетического обмена посредством взаимодействия с различными биохимическими компонентами организма, начиная с транспорта кислорода и заканчивая синтезом макроэргических соединений. Любые нарушения в энергообеспечении клетки приводят к серьезным последствиям, вплоть до гибели биологической структуры. Фторсодержащие соединения выступают в роли цитотоксического фактора, влияющего на метаболизм, модулирующего пути внутриклеточной сигнализации и активирующего программируемую клеточную гибель.
Подводя итог вышесказанному, можно заключить, что механизмы физиологического или токсического воздействия фторсодержащих соединений на организм определяются их концентрацией и длительностью воздействия. Кроме того, повреждающее действие фтора может быть связано с его генотоксическими свойствами — способностью подавлять синтез внутриклеточных защитных белков и антиоксидантных ферментов.
