МЕТОДИКИ БИОТЕСТИРОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ НА ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ
МЕТОДИКИ БИОТЕСТИРОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ НА ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ
Аннотация
Рассмотрены основные механизмы возникновения онкологических заболеваний радиационной, химической и экологической этиологии, а также некоторые активно применяющиеся методики тестирования потенциальных противоопухолевых соединений на биологических объектах для проверки их терапевтического действия. Показана роль окислительного стресса как состояния нарушенного баланса между эффективностью антиоксидантов и продукцией свободных радикалов, основным источником которых являются митохондриальные электрон-транспортные цепи. Обсуждено значение гликолиза, представляющего собой основной метаболический путь неопластических клеток и способ получения ими энергии. Нацеливание на данные процессы может рассматриваться в качестве перспективных лекарственных мишеней при терапии онкопатологий.
1. Введение
Онкологические заболевания являются одной из ведущих причин смертности людей во всем мире. Несмотря на значительные успехи в лечении злокачественных новообразований, все же данная патология характеризуется достаточно высоким уровнем летальности и представляет собой серьезную экономическую и социальную проблему. По данным ВОЗ от 2020 года, в мире было диагностировано более 19 млн. пациентов с различными онкологическими заболеваниями, и смертность от них составила почти 10 млн. Ожидается, что к 2040 году эти показатели достигнут примерно 28 млн. и 16 млн. соответственно
.В связи с высоким уровнем смертности от онкологии в течение последних десятилетий важной областью научных исследований является изучение метаболизма опухолевых клеток и разработка противоопухолевых препаратов.
2. Основная часть
Онкогенез – это многоступенчатый процесс, который включает мутационные изменения и неконтролируемую пролиферацию клеток. Исследования установили, чтопричинную и способствующую роль в инициации и прогрессировании опухоли играет окислительный стресс
. Он представляет собой состояние нарушенного баланса между эффективностью антиоксидантов и продукцией свободных радикалов, основным источником которых являются локализованные в митохондриях электрон-транспортные цепи (ЭТЦ) . Длительные повышенные уровни активных форм кислорода, азота, липидов, вызванные снижением антиоксидантной защиты организма, могут вызвать нестабильность важных макромолекул, приведя к клеточной дисфункции, что является основой воспалительных процессов, сердечно-сосудистых заболеваний, онкологии и других заболеваний .Патогенез и этиология онкологических заболеваний очень разнообразны. По современным представлениям, независимо от вида канцерогенного воздействия, во всех опухолевых клетках происходят общие процессы, главным из которых является метаболическое перепрограммирование, характеризующееся сдвигом в энергообеспечении от митохондриального окислительного фосфорилирования к аэробному гликолизу. Он дает неопластическим клеткам для выживания определенные преимущества перед неопухолевыми клетками. Во-первых, активный гликолиз позволяет клеткам выживать в условиях рано или поздно развивающейся кислородной недостаточности в злокачественной опухоли. Во-вторых, аэробный гликолиз позволяет перенаправлять метаболические промежуточные продукты на различные пути биосинтеза, способствуя синтезу макромолекул и новых органелл
. В-третьих, клетки опухоли образуют молочную кислоту как конечный продукт аэробного гликолиза, который, экспортируясь во внеклеточное пространство, вызывает его подкисление, что ингибирует функцию иммуносупрессивных клеток, включая макрофаги и лимфоциты типа М2, что еще больше облегчает выживание опухолевых клеток .Учитывая сложность механизмов возникновения и прогрессирования злокачественных новообразований, особенно при их радиационной, химической и экологической этиологии (происхождении), разрабатываемые противоопухолевые препараты должны обладать комплексным многоцелевым действием с минимумом побочных эффектов. Прежде чем отправить вещества, обладающие потенциальной противоопухолевой активностью, на доклинические испытания, необходимо провести ряд экспериментов, нацеленных на получение достоверной информации об их терапевтическом действии. Разработаны разнообразные системы тестирования различных химических соединений для выявления механизмов противоопухолевого эффекта, основанные на использовании биологических материалов.
В частности, для оценивания влияния химических агентов на процесс перекисного окисления липидов мембран очень широко используется реакция с тиобарбитуровой кислотой (ТБК-тест). Мембраны клеток и органелл являются наиболее чувствительными к повреждению свободными радикалами, так как их основным компонентом являются липиды, содержащие полиненасыщенные жирные кислоты (ПНЖК). Активные формы кислорода и азота могут способствовать окислению ПНЖК, что вызывает перекисное окисление липидов (ПОЛ). Оно изменяет липид–липидные взаимодействия, проницаемость мембран, ионные градиенты, что в конечном счете может привести к гибели клеток
.В основе ТБК-теста лежит реакция 2-тиобарбитуровой кислоты с конечным продуктом ПОЛ — малоновым диальдегидом (МДА)
. В результате реакции образуется окрашенный триметиновый комплекс с максимумом поглощения при 540 нм. В дальнейшем проводят измерение оптической плотности супернатанта. Инициатором, ускоряющим реакцию окисления, могут служить ионы двухвалентного железа (FeSO4×10H2O), запускающие реакцию Фентона, в ходе которой образуются свободные радикалы. Эксперимент проводится на гомогенате мозга крысы, так как мозг содержит уникальные мембранные структуры – миелиновые оболочки, которые имеют самое высокое содержание липидов (до 80%) по сравнению с другими тканями или субклеточными структурами .С помощью ТБК-теста можно улавливать наномолярные концентрации чистого МДА-стандарта. Быстрота, простота использования и высокая чувствительность анализа ТБК сделали его наиболее распространенным методом, несмотря на некоторые ограничения. В основном это:
· низкая стабильность МДА в биологических образцах из-за его высокой склонности к взаимодействию с белками, аминокислотами и т.д. и быстрой ферментативной деградации;
· плохая воспроизводимость результатов анализа ;
· неспецифичность, так как даже в идеальных условиях эксперимента использование МДА, как количественного индекса, ограничено, поскольку его источником могут быть продукты разложения ДНК при её окислительном повреждении, и, возможно, других нелипидных молекул.
Также данный метод даёт информацию только о наличии веществ, реагирующих с ТБК, и не информирует об их природе и составе. Поэтому его следует сочетать с другими маркерами липидной пероксидации
.Одним из методов оценки способности потенциальных противоопухолевых соединений влиять на биоэнергетику митохондрий и вызывать гибель патологических клеток является измерение трансмембранного потенциала митохондрий (δψm) с использованием потенциалзависимой флуоресцирующей метки– сафранина
.Суть метода заключается в энергизации изолированных митохондрий печени крысы сукцинатом калия – субстратом второго комплекса ЭТЦ, ингибировании первого комплекса ЭТЦ митохондрий (НАДФ-дегидрогеназы) ротеноном и добавлении на этом фоне исследуемых соединений к митохондриям. После чего наблюдают изменение мембранного потенциала органелл за счёт усиления интенсивности флуоресценции сафранина (рис. 1). Анализ полученных данных проводят с помощью графика зависимости разности изменения светопоглощения при 524 и 554 нм от времени.
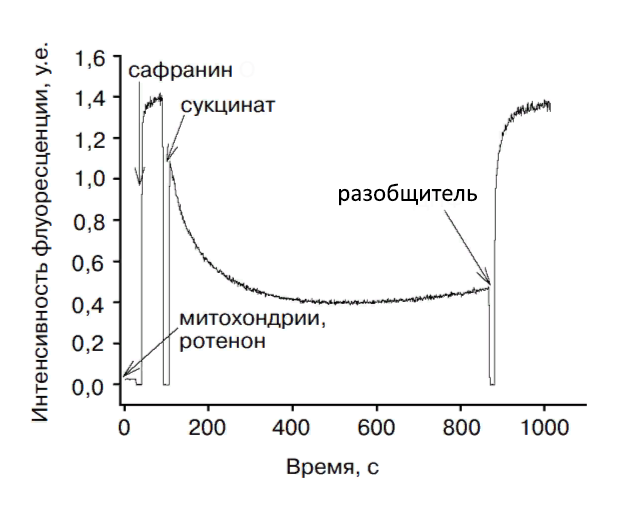
Рисунок 1 - Запись флуоресценции 10 мкМ сафранина в суспензии митохондрий (0,4 мг/мл), зарегистрированная на обычном флуориметре
Примечание: добавки - ротенон 1 мкМ, сукцинат 5 мМ, разобщитель 100 мкМ; по ист. [4]
Рисунок 2 - График Seahorse анализа скорости внеклеточного закисления среды
3. Заключение
Вышеописанные методы активно применяются на начальных этапах биологического тестирования как комплексно, так и по отдельности и продолжают совершенствоваться для получения как можно более надежных и развернутых результатов. Так, большинство технических проблем, связанных с измерением МДА в ТБК-тесте, остаются нерешенными и требуют дальнейшего изучения
. Учитывая неспецифичность реакции ТБК с МДА и перекрестной реакции других альдегидов, образующихся в результате перекисного окисления липидов, некоторые исследователи используют общие показатели веществ, реагирующих с ТБК (TBAR) , , в качестве биомаркера окислительного стресса вместо значений МДА.