Терапевтический плазмообмен в упреждении послеоперационных осложнений при хирургическом лечении рака легкого с воспалительным компонентом (клиническое наблюдение)
Терапевтический плазмообмен в упреждении послеоперационных осложнений при хирургическом лечении рака легкого с воспалительным компонентом (клиническое наблюдение)
Аннотация
Сочетание двух процессов, опухолевого и воспалительного у больных НМРЛ являются триггером развития генерализованного воспалительного ответа организма. При этом, развитие эндогенной интоксикации у данной категории больных, приводит к нарушению химического гомеостаза с накоплением в организме значительного количества токсичных субстанций эндогенного происхождения. Лечебное воздействие терапевтического плазмообмена (ТПО) связано с максимальным удалением токсических веществ, повышением общей реактивности организма, а также оптимизацией обменных и пластических процессов, стимуляцией симпатоадреналовой системы, активацией гемопоэза и т.д. Цель исследования: продемонстрировать эффективность детоксикационного воздействия ТПО у больных НМРЛ с позиций упреждения воспалительных респираторных осложнений после торакопластических операций. Демонстрация представленных в настоящем исследовании клинических случаев свидетельствует о перспективности применения ТПО у больных НМРЛ, осложненным воспалительным процессом. Перед проведением оперативного вмешательства, после ТПО отмечали улучшение показателей гематологических индексов интоксикации, снижение значений исследуемых маркеров воспаления, что отражало снижение степени выраженности эндогенной интоксикации и системного воспаления, обеспечивая оптимизацию функционального состояния собственных защитных систем организма, что создавало более благоприятный фон для проведения оперативного вмешательства.
1. Введение
Рак легкого занимает первое место в мире в структуре заболеваемости и смертности среди онкологических заболеваний. В возрастных категориях у мужчин 50 лет и старше и женщин старше 60 лет фиксируется более 150 000 смертей в год, что соответствует показателям смертности при колоректальном раке, раке молочной железы, простаты и опухолях головного мозга, вместе взятых . Современный подход к лечению немелкоклеточного рака легкого (НМРЛ) включает в себя комплексное применение радикального хирургического лечения в сочетании с радио- и лекарственной противоопухолевой терапией, что обеспечивает максимальную выживаемость больных фактически на всех стадиях заболевания .
Известно, что прогноз течения НМРЛ зависит от потенциального риска опухолевой прогрессии и обусловлен различными факторами, такими, как стадия заболевания, морфологическое строение, степень дифференцировки опухоли, наличие регионального и/или отдаленного метастазирования . Определенный вклад в неблагоприятный исход заболевания вносит и госпитальная летальность, обусловленная развитием в послеоперационном периоде гнойно-септических осложнений, а также острой кардиальной и критической дыхательной недостаточности .
Наиболее частыми и значимыми осложнениями послеоперационного периода у больных РЛ являются пневмония (11-39%) и острый респираторный дистресс-синдром (ОРДС) (6%) . Синдром системного воспалительного ответа диагностируется в 12-40% случаев и зависит от объема и длительности операции, а также исходных функциональных особенностей больного. В условиях применения предоперационного химиолучевого лечения риск послеоперационных воспалительных осложнений увеличивается до 75% с летальным исходом 26,5-33% случаев .
Важным фактором в формировании послеоперационных воспалительных респираторных осложнений является распространенность опухолевого процесса. Известно, что у 70 % больных НМРЛ диагностируется на поздних стадиях заболевания при развитии местно-распространённого процесса, а также метастатического поражения плевры, грудной стенки и контрлатерального лёгкого, в ряде случаев сопровождающихся распадом опухоли и воспалительным поражением легочной ткани . В некоторых случаях осложненное воспалительным процессом течение НМРЛ диагностируется на ранних стадиях онкологического процесса. Так, эндобронхиальный рост опухоли приводит к формированию вторичного воспалительного очага в легочной ткани и у большинства этих больных НМРЛ дебютирует с пневмонитом, плевритом, эмпиемой плевры, пневмонией, абсцессом лёгкого .
По мнению Рубцова М.С. и соавт. (2019) распад опухоли с образованием тканевого некроза и массивной зоны локального воспаления является триггером воспалительных осложнений у больных НМРЛ в послеоперационном периоде. Некротический очаг служит источником эндотоксикоза, развитие которого обусловлено длительным поступлением продуктов клеточного распада в кровь .
Кроме того, следует учитывать, что формирование любого опухолевого процесса протекает на фоне вторичной иммуносупрессии. В условиях патологической реактивности и усиления катаболических процессов при угнетении функциональной активности собственных систем детоксикации и экскреции, в организме онкологического больного различные метаболиты приобретают свойства эндотоксинов, что приводит к дезорганизации систем и развитию синдрома эндогенной интоксикации .
Следует также отметить, что радикализм и агрессивность хирургического лечения НМРЛ существенно повышает риск развития послеоперационных воспалительных осложнений. Уменьшение объема лёгкого с «выключением» его из акта дыхания с краткосрочным отсутствием газообмена во время операции приводит к ряду патологических нарушений гомеостаза. Доказано, что отсутствие циркуляции воздуха в оперируемом лёгком инициирует активацию и выброс в кровоток большого количества медиаторов воспаления, в том числе, и провоспалительных цитокинов, способствуя развитию острого повреждения лёгких. Кроме того, отсутствие нормального функционирования лёгкого и нарушенный газообмен, приводят к уменьшению парциального давления кислорода крови с развитием неадекватного сердечного выброса и ухудшением перфузионно-вентиляционного соотношения. В коллабированном лёгком нарушается равновесие пре- и посткапиллярного сопротивления с изменением капиллярно-гидростатического давления, что в свою очередь провоцирует формирование тканевой гипоксемии и гиперкапнии, нарушение характера течения окислительных реакций и энергетического баланса. В этих условиях развитие неконтролируемого каскада взаимообусловленных воспалительных реакций неизбежно приводит к необратимым и .
Таким образом, очевидно, что течение местнораспространённого опухолевого процесса с воспалительным компонентом определяет высокий риск развития, на фоне операционно-анестезиологической агрессии патологических трансформаций с тяжелыми системными осложнениями. В сложившейся ситуации патогенетически обосновано усиление проводимой стандартной предоперационной подготовки экстракорпоральной детоксикацией, направленной на устранение «пиковых» концентраций патогномоничных для органных повреждений токсических лигандов. При этом методом выбора следует считать терапевтический плазмообмен (ТПО), поскольку данный метод наиболее доступен, при этом обладает наиболее широким потенциалом детоксикации, направленным на удаление всех типов токсических субстанций, в том числе и связанных с белками .
Эффективность применения ТПО в предоперационном периоде у больных НМРЛ, осложненным воспалительным процессом представлена нами в описанных ниже клинических наблюдениях.
Цель исследования: продемонстрировать эффективность детоксикационного воздействия терапевтического плазмообмена у больных НМРЛ с позиций упреждения воспалительных респираторных осложнений после торакопластических операций.
2. Клинический случай 1
Больной Р., 60 лет, госпитализирован в «НМИЦ онкологии» МЗ РФ в марте 2022 года для хирургического лечения НМРЛ. При поступлении жалобы на ежедневный подъем температуры до 38,5°С, одышку при незначительной физической нагрузке, выраженную слабость, снижение аппетита и веса. По данным лабораторного исследования регистрировали наличие лейкоцитоза; значительное повышение лейкоцитарного индекса интоксикации (ЛИИ), характеризующего наличие эндогенной интоксикации средней степени тяжести за счет процессов аутолиза и присоединения бактериальных токсинов, протекающей на фоне неадекватности компенсаторных возможностей физиологических систем детоксикации, характеризуется значительным ростом значения реактивного ответа нейтрофилов (РОН), повышенным показателем нейтрофильно-лимфоцитарного соотношения (НЛС). Одновременно регистрировали существенное повышение маркеров системного воспаления в сыворотке крови: концентрации прокальцитонина (PCT), С-реактивного белка (СRB), интерлейкина-6 (IL-6) (табл.1).
Из анамнеза известно, что в апреле 2021 года, при обследовании по месту в жительства был диагностирован центральный рак правого легкого и выполнена видеоассистированная комбинированная верхняя лобэктомия. Гистологические данные – плоскоклеточная карцинома. При контрольной фибробронхоскопии в 2022 году выявлена опухоль устья правого верхнедолевого бронха, осложненная обструктивным гнойным бронхитом. Объективно: рост 176 см, вес 93 кг, индекс массы тела 30,02 кг/м2, телосложение – нормостеническое. Состояние больного удовлетворительное. Адекватен, в пространстве и времени ориентирован. Температура 37,5°С. Кожные покровы обычной окраски, отеков нет. Показатели гемодинамики на обеих плечевых артериях одинаковые 125/65 мм рт. ст., частота сердечных сокращений (ЧСС) 90 в минуту, пульс удовлетворительного наполнения и напряжения. Обе половины грудной клетки равномерно участвуют в акте дыхания. Частота дыхания (ЧД) 22 в минуту, сатурация крови (Sp O2) 94%. При сравнительной перкуссии – легочный звук, при аускультации – дыхание жесткое, влажные хрипы и ослабление дыхания справа, тоны сердца глухие, аритмичные.
Инструментальные методы исследования: 1. Компьютерная томография (КТ) органов грудной клетки: выраженная инфильтрация правого легкого с наличием множественных участков распада, патологически измененных лимфатических узлов не выявлено, состояние после верхней лобэктомии справа, многоузловой рецидив опухоли 3 х 2,3 см с прорастанием главного бронха, обструкция, гнойный бронхит. 2. Функция внешнего дыхания: жизненная ёмкость легких (ФЖЕЛ) – 44,53%, форсированная жизненная ёмкость легких (ЖЕЛ) – 45,55%, объём форсированного выдоха за 1 секунду (ОФВ1) – 46,69 % (снижение всех показателей относительно нормы). 3. Фибробронхоскопия: эндоскопические признаки рецидива опухоли с вовлечением правого главного бронха и стенозом его просвета. 4. УЗИ сердца: фракция выброса 51%, уплотнение створок аортального клапана, значительное снижение сократительной функции левого желудочка. 5. Холтеровское мониторирование: на фоне синусового ритма, выраженная аритмия (12 одиночных суправентрикулярных и 1067 вентрикулярных экстрасистол, из них 1032 одиночных и 8 по типу тригеминии, по классификации желудочковых экстрасистол – Lown-III-В класс). 6. КТ головы и костей черепа: патологических изменений в веществе головного мозга не выявлено.
Основной клинический диагноз: С34.1 Центральный рак верхней доли правого легкого T2N1M0 st IIa, состояние после видеоассистированной комбинированной расширенной верхней лобэктомии, рецидив. Осложнение – обструктивный гнойный бронхит, эндотоксический синдром. Сопутствующие заболевания: гипертоническая болезнь III стадия, артериальная гипертония 2 степень, риск 4, хроническая сердечная недостаточность (ХСН) 1 ст., функциональный класс (ФК) 2, состояние после стентирования коронарных артерий в 2016 году. По классификации операционного риска ASA (American Society of Anesthesiologists) — IV степень.
Учитывая осложненное течение онкологического заболевания, в целях предупреждения развития воспалительных осложнений в раннем послеоперационном периоде, в комплекс предоперационной подготовки был включен ТПО. Плазмообмен был выполнен на фоне проведения консервативной фармакологической предоперационной подготовки за сутки до оперативного вмешательства на аппарате «Plazauto Sigma» и использованием плазмофильтра Plazmaflo ОР-02W/L. Скорость кровотока 40-60 мл/мин. Объем плазмоэкстракции 1800 мл, Замещение 2410 мл: Альбумин 5% 500 мл, Гемофильтрационный раствор Accusol 4K – 1000 мл, свежезамороженная плазма 910 мл. Антикоагуляция – регионарно гепарин 2 тыс Ед/час. Длительность – 3 часа.
На следующие сутки после ТПО (перед проведением оперативного вмешательства) отмечали улучшение показателей гематологических индексов интоксикации, снижение значений исследуемых маркеров воспаления (Табл. 1), что отражало снижение степени выраженности эндогенной интоксикации и системного воспаления, обеспечивая оптимизацию функционального состояния собственных защитных систем организма, что создавало более благоприятный фон для проведения оперативного вмешательства.
Таблица 1 - Показатели гематологических индексов эндогенной интоксикации и маркеров воспаления у больного Р. до, после предоперационного ТПО, в 1 и 3 сутки послеоперационного периода
Показатели | До ТПО | После ТПО | 1 сутки п/о периода | 3 сутки п/о периода |
ЛИИ у.е. (норма1-1,6±0,2) | 5,1 | 4.0 | 6.4 | 4.2 |
ИРО у.е. (норма 50-100) | 51,3 | 32 | 34 | 51 |
РОН у.е. (норма 10,6±2,1) | 55,7 | 32.5 | 15,6 | 15.0 |
НЛС (норма 1-2,1±0,1) | 8,7 | 4,5 | 9.5 | 6.1 |
Сывороточная концентрация IL-6, пг/мл (норма – до 7) | 90.2 | 46.2 | 52.7 | 45.5 |
Сывороточная концентрация РСТ, нг/мл (норма – до 0,05) | 2.2 | 0.12 | 0.41 | 0.22 |
СRB мг/л (норма 0-5) | 136,2 | 87,6 | 128.1 | 47,4 |
Больному Р. выполнено плановое хирургическое вмешательство в объеме: расширенная пневмонэктомия справа с высокой резекцией блуждающего и диафрагмального нервов. По завершении операции больной экстубирован, респираторно-гемодинамические показатели в пределах допустимых норм. В дальнейшем отмечали благоприятное течение раннего послеоперационного периода (3-е суток). Больному проводили плановую консервативную лекарственную терапию, включающую констриктивную инфузионную программу, антибактериальную, антиаритмическую, симптоматическую терапию. Обезболивание осуществляли путем микроструйного введения эластомерной помпой в эпидуральное пространство 0,25% раствора ропивакаина со скоростью 4 мл/час. В 1-е сутки проводили респираторную поддержку в виде неинвазивной вентиляции легких с концентрацияей О2 40-35% (генератор AIRVO-2) с последующей инсуффляцией кислородо-воздушной смеси через назальные канюли.
Анализ изменений гематологических индексов эндогенной интоксикации и маркеров воспаления показал, что в первые сутки послеоперационного периода регистрировали несколько отрицательную динамику этих показателей, что закономерно в условиях проведения обширного торакопластического оперативного вмешательства с последующей оптимизацией из значений к 3 суткам п/о периода (табл. 1).
На 13-е сутки после операции больной Р. выписан из стационара в удовлетворительном состоянии для продолжения консервативного противоопухолевого лечения по месту жительства.
3. Клинический случай 2
Больной К. 65 лет, госпитализирован в «НМИЦ онкологии» МЗ РФ для хирургического лечения НМРЛ в мае 2022 года. Жалобы при поступлении на влажный кашель, Слабость, одышку при небольшой физической нагрузке. Объективные данные: рост 175 см, вес 80 кг, индекс массы тела 24,05 кг/м2, телосложение нормостеническое, пониженного питания. Состояние удовлетворительное. Сознание ясное. Кожные обычной окраски, отеков нет. Температура 36,5°С. Показатели артериального давления в пределах возрастной нормы 135/68 мм рт. ст., ЧСС 80 в минуту, дефицита пульса нет. Грудная клетка без костной патологии, дыхание равномерное, ЧДД 18 в минуту, Sp O2 95%. Аускультативно: дыхание жесткое, выслушиваются сухие хрипы, ослабление дыхания в нижних отделах лёгких с обеих сторон, тоны сердца приглушенные, ритмичные. При лабораторном обследовании регистрировали наличие лейкоцитоза; значительное повышение значений лейкоцитарного индекса интоксикации (ЛИИ), характеризующего наличие эндогенной интоксикации средней степени тяжести за счет процессов аутолиза и присоединения бактериальных токсинов, протекающей на фоне неадекватности компенсаторных возможностей физиологических систем детоксикации, характеризующейся значительным ростом значения реактивного ответа нейтрофилов (РОН), повышением показателя нейтрофильно-лимфоцитарного соотношения (НЛС.). Одновременно выявили существенное повышение маркеров системного воспаления сыворотке крови: PCT, СRB, IL-6 (табл.2).
Инструментальные исследования:
1. СРКТ органов грудной клетки: многоузловая опухоль нижней доли левого лёгкого 9,2 х 9,6 см с многополостным распадом, поражением нижнедолевого бронха, прорастанием нижней легочной вены с распространением в полость левого предсердия.
2. Фибробронхоскопия: слева главный бронх на уровне 8-го от карины кольца полностью перекрыт экзофитом.
3. Функция внешнего дыхания: ЖЕЛ – 41,73 %, ФЖЕЛ– 42,52%, ОФВ1 – 44,49 % (значительное снижение относительно нормы).
4. Гистологический анализ биопсийного материала: очаги плоскоклеточной карциномы.
5. ЭКГ: ритм синусовый с ЧСС 85 уд. мин., желудочковая экстрасистолия, снижение восстановительных процессов миокарда задне-нижних отделов левого желудочка.
Основной клинический диагноз: С34.1 центральный рак левого лёгкого с поражением долевых и левого главного бронха Т4N1M0, st III В. Осложнение – распад опухоли, эндотоксический синдром. Сопутствующие заболевания: ишемическая болезнь сердца — атеросклеротический кардиосклероз, ХСН 1 ст., ФК 2, варикозная болезнь нижних конечностей, хроническая венозная недостаточность 2 ст. Операционный риск (ASA) — IV ст.
Таблица 2 - Показатели гематологических индексов эндогенной интоксикации и маркеров воспаления у больного Р. до операции, в 1 и 3 сутки послеоперационного периода
Показатели | До операции | 1 сутки п\о периода | 3 сутки п/о периода |
ЛИИ у.е. (норма1-1,6±0,2) | 4.6 | 7.3 | 4.1 |
ИРО у.е. (норма 50-100) | 55 | 56 | 49 |
РОН у.е. (норма 10,6±2,1) | 39.5 | 69.2 | 44.4 |
НЛС (норма 1-2,1±0,1) | 4.2 | 15.7 | 8.7 |
Сывороточная концентрация IL-6 пг/мл (норма до 7) | 60.1 | 485.5 | 141,4 |
Сывороточная концентрация РСТ, нг/мл (норма до 0,05) | 0.45 | 14.38 | 5.25 |
СRB мг/л (норма 0-5) | 86,3 | 453,2 | 104,1 |
ЕАА-тест у.е. | - | 0,62 | 0,37 |
Больному К. проведено оперативное вмешательство — расширенная комбинированная пневмонэктомия слева с резекцией левого предсердия. На этапе мобилизации произошло вскрытие абсцедирующего участка лёгкого с излитием содержимого в плевральную полость. Негативная реакция со стороны систем жизнеобеспечения больного произошла немедленно, что клинически проявилось резким снижением АД с эпизодом синусовой тахисистолии до 128 ударов в минуту. Гемодинамические показатели удалось нормализовать в короткий срок при экстренном подключении вазопрессорной поддержки (добутамин – 6 мкг/кг/мин). Значения показателей газового состояния артериальной крови и кардио-респираторные нарушения компенсированы вовремя и не имели отрицательной динамики. Исследования КЩС артериальной крови: рСО2 – 44 мм рт. ст., рО2 – 112 мм рт. ст., pH – 7,43, BE – 7,8 ммоль/л, HCO3 –34,2 ммоль/л, SаtO2 – 95%. В дальнейшем анестезиологическое обеспечение протекало без особенностей. После завершения операции больной в условиях транспортной ИВЛ, медикаментозной седации и вазопрессорной поддержки был переведен в АРО.
В 1-е сутки послеоперационного периода проводили комплекс интенсивного стандартного лечения, инвазивную ИВЛ аппаратом Hamilton G5, активную вазопрессорную поддержку (норэпинефрин 5 мкг/кг/мин, добутамин 3 кг/кг/мин). Обезболивание обеспечивали микроструйным введением в эпидуральное пространство 0,25% раствора ропивакаина — 3 мл/час. Уровень сознания – медикаментозная седация (дозированное введение дексмедетомидина в дозе 0,5 мкг/кг/мин). По шкале RASS (Richmond Agitation Sedation Scale) — 4 балла. Вероятность летального исхода по шкале SAPS II (шкала острых оценки физиологических расстройств) — 60 %. АД поддерживали в диапазоне 100/56-110/62 мм рт. ст., ЧСС 118 в минуту. Параметры ИВЛ: ДОм 3,5 мл/кг; ЧД 16 в мин., Р +12 см вод.ст., PEEP +4 см вод. ст, FiO2 80 %, при этом SpO2 была 90%. При аускультации грудной клетки справа «жесткое» аппаратное дыхание выслушивалось над всей поверхностью, хрипы не регистрировали. КОС: РaО2 112 мм рт. ст.; РаСО2 38,5 мм рт. ст.; рН 7,44; ВЕ – 0,3 ммоль/л, Р/F 343 мм рт. ст. НСО3 27,7 ммоль/л. В данных лабораторного исследования отмечали резкий рост показателей эндогенной интоксикации – ЛИИ, НЛС, а также маркеров воспаления – СRB, PCT, IL-6, характеризующих развитие генерализованного воспалительного ответа (Табл 2). При этом регистрировали высокую активность эндотоксина грамотрицательных микроорганизмов по показателю ЕАА-теста, значение которого выше 0,6 свидетельствовало о высоком риске развития сепсиса в течение последующих 24 часов.
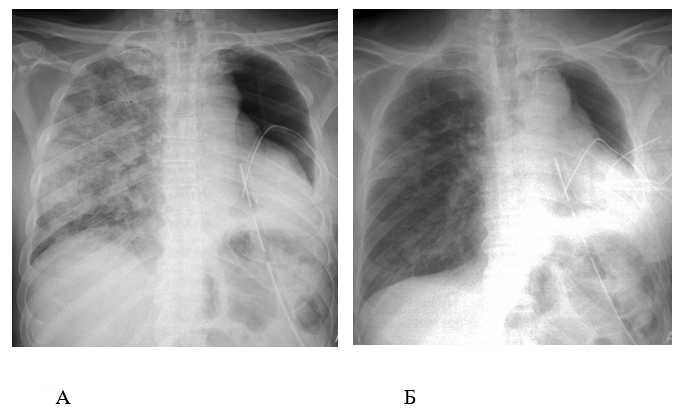
Рисунок 1 - Динамика рентгенологической картины легких
Примечание: А — первые сутки после оперативного вмешательства, Б — через 24 часа после полимиксиновой сорбции
На 4-е сутки после операции течение послеоперационного периода осложнилось развитием острой ишемии правой нижней конечности с эмболией и тромбозом правой бедренной артерии, тромботической окклюзией подвздошно-бедренного сегмента справа, подтвержденной данными УЗИ, в связи с чем, по экстренным показаниям была выполнена эмболтромбэктомия из правой общей бедренной артерии. В последующие сутки по данным клинической картины и МРТ диагностировали тромбэмболический ишемический инсульт в левой теменной и затылочной долях, вторичный геморрагический инсульт и внутримозговое кровоизлияние без дислокации срединных структур. С большой долей вероятности, развитие генерализованного воспаления в послеоперационном периоде, внесло свой вклад в инициацию тромботических осложнений у описываемого больного. В течение последующих шести суток больной получал комплексную терапию в соответствии с клиническими рекомендациями. Продленная ИВЛ в различных адаптированных режимах обеспечивала респираторный баланс больного в течение всего времени пребывания в АРО. На 12-е сутки после контроля газового состава крови и полной нормализации кардио-респираторных функций больной был экстубирован с последующей оксигенотерапией увлажненным кислородом аппаратом AIRVO-2 (поток 25 л/мин, FiO2 45%, t 35°C). На 15-е сутки после хирургического вмешательства больной переведен в профильное отделение. На 27-е сутки в удовлетворительном состоянии выписан из стационара для дальнейшего лечения по месту жительства.
4. Обсуждение
В современной онкологической практике до сих пор нет единого мнения о целесообразности выполнения обширных комбинированных операций с точки зрения развития ранних осложнений и послеоперационной летальности. Безусловно, эффективность лечения больных НМРЛ и развитие осложнений в послеоперационном периоде зависят от различных факторов, обусловленных степенью распространения опухолевого процесса, а также компенсаторными возможностями организма больного.
Сочетание двух процессов, опухолевого и воспалительного у больных НМРЛ являются триггером развития генерализованного воспалительного ответа организма с возможным стремительным и непредсказуемым течением, которое может привести к тяжелым полиорганным нарушениям. Своевременное диагностирование и экстренное реагирование на функциональные нарушения, несомненно, способствуют улучшению результатов лечения больного.
Вместе с тем, некоторые аспекты специализированной медицинской помощи следует рассматривать с точки зрения профилактики, в том числе и меры, направленные на стабилизацию защитных функций организма онкологического больного в предоперационном периоде.
К таким упреждающим методикам следует отнести применение ТПО. Развитие эндогенной интоксикации у онкологических больных, приводит к нарушению химического гомеостаза с накоплением в организме значительного количества токсичных субстанций эндогенного происхождения. В общий кровоток попадает и циркулирует пул веществ в состав которого входят олигосахара, глюкагон, нуклеотиды, полиамиды, производные глюкуроновых кислот и другие вещества . Лечебное воздействие ТПО связано с максимальным удалением токсических веществ, повышением общей реакивности организма, а также оптимизацией обменных и пластических процессов, стимуляцией симпатоадреналовой системы, активацией гемопоэза и т.д. .
В «НМИЦ онкологии» запатентован и внедрен в клиническую практику «Способ предупреждения острого повреждения лёгких при хирургическом лечении немелкоклеточного рака лёгкого, осложненного воспалительным процессом» (патент №2801089). Сущность изобретения состоит в том, что включение в предоперационную подготовку больным НМРЛ с воспалительным компонентом ТПО способствует предупреждению развития воспалительных осложнений и позволяет избежать острого повреждения легких в раннем послеоперационном периоде .
5. Заключение
Таким образом, демонстрация представленных в настоящем исследовании клинических случаев свидетельствует о перспективности применения терапевтического плазмообмена у больных НМРЛ, осложненным воспалительным процессом, с позиций предупреждения развития генерализованного воспаления и острого повреждения легких в ответ на хирургическую агрессию, что, вероятно, позволит улучшить результаты лечения госпитального периода у данной категории больных.
