ОЦЕНКА АНТИПИРЕТИЧЕСКОЙ АКТИВНОСТИ НОВЫХ ПРОИЗВОДНЫХ КОНДЕНСИРОВАННЫХ 3-АМИНОТИЕНО[2,3-B]ПИРИДИНОВ И 1,4-ДИГИДРОПИРИДИНОВ
ОЦЕНКА АНТИПИРЕТИЧЕСКОЙ АКТИВНОСТИ НОВЫХ ПРОИЗВОДНЫХ КОНДЕНСИРОВАННЫХ 3-АМИНОТИЕНО[2,3-B]ПИРИДИНОВ И 1,4-ДИГИДРОПИРИДИНОВ
Аннотация
Поиск эффективных и безопасных лекарственных средств с жаропонижающей активностью и анальгетическими свойствами в настоящее время актуален в связи с увеличением распространенности острых вирусных инфекций и их осложнений. Целью исследования являлось изучение в опытах in vivo антипиретических свойств новых производных цианотиоацетамида, конденсированных 3-аминотиено[2,3-b]пиридинов и 1,4-дигидропиридинов в классическом фармакологическом тесте «дрожжевой лихорадки». Методы. Из 340 новых производных цианотиоацетамида, полученных путем многокомпонентного химического синтеза на базе НИЛ «ХимЭкс» ЛГУ им. Владимира Даля, используя программы виртуального биоскрининга Swiss Target Prediction, отобрано 10 образцов. Соединения вводили внутрижелудочно в дозе 5 мг/кг за 1,5 часа до моделирования «дрожжевой лихорадки» – введения 20% суспензии пекарских дрожжей. Результаты. На основе установленной динамики изменения температуры тела крыс в условиях моделирования лихорадочной реакции выявлено, что наилучший результат в плане антипиретической активности показали производные конденсированных 3-аминотиено[2,3-b]пиридинов и 1,4-дигидропиридинов с шифрами AZ023, AZ420 и AZ383, поскольку превосходят метамизол натрия по способности уменьшать температуру тела (более чем на 1 ºС) и длительности эффекта (свыше 6 часов). Заключение. Обнаружены 3 новых производных цианотиоацетамида с высокой антипиретической активностью, перспективные для дальнейших доклинических исследований.
1. Введение
Cреди наиболее часто встречающихся клинических синдромов, требующих от врача рационального и быстрого реагирования, находится лихорадочный и острый болевой синдромы. Такие состояния пациента способны сопровождать большинство заболеваний, часто являясь причиной обращения за помощью к врачу. Лихорадка, будучи неспецифической защитной реакцией организма и сложным многокомпонентным процессом, формируется вследствие воздействия экзо- и эндопирогенов .
Лихорадка имеет определенные адаптивные эффекты: прямые и опосредованные бактериостатический и бактерицидный эффекты, потенцирование специфических и неспецифических факторов защиты, активацию неспецифической стресс-реакции. В диапазоне 39-40 °С достигаются бактериостатический и бактерицидный эффекты лихорадки подавлением деления и жизнедеятельности многих микроорганизмов. Обнаружение, инактивация/деструкция и элиминация чужеродных агентов инфекционного и неинфекционного происхождения обеспечивается повышением эффективности как неспецифических (лизоцима, факторов комплемента, ИФН, фагоцитоза, катионных белков и др.), так и специфических (синтез Ig, образование Т-лимфоцитов, их активация и др.) механизмов , .
Лихорадка способна приводить к биологически отрицательным эффектам. Микробные эндо- и экзотоксины, чужеродные белки и другие соединения могут вызывать иммунопатологические процессы (аллергические реакции, иммунодефициты, болезни иммунной аутоагрессии), а также биологически нецелесообразные реакции (артериальную гипер- или гипотензию, изменение чувствительности к нейромедиаторам и гормонам, повышение проницаемости стенки сосудов и др.) , .
К развитию патологических состояний может привести функциональная перегрузка органов и физиологических систем, непосредственно включающихся в механизм развития лихорадки. Таким образом, могут развиться коллапс, обморок или сердечная недостаточность при значительном повышении температуры тела, а также при её критическом падении; может нарушиться состояние системы гемостаза с развитием гиперкоагуляции белков крови, микротромбов и даже ДВС-синдрома при инфекционной лихорадке с гипогидратацией (например, при холере) или массированном гемолизе эритроцитов (при малярии). Возможно и опосредованное расстройство функций органов и систем, непосредственно не участвующих в реализации лихорадочной реакции (например, системы пищеварения, что сопровождается ухудшением аппетита, нарушениями пищеварения, всасывания питательных веществ и похуданием пациента; нервной системы, часто сопровождающееся головной болью, иногда судорогами и галлюцинациями, нарушением рефлексов). Таким образом, лихорадке свойственно оказывать как положительные, так и отрицательные реакции в организме , , .
Лекарственные препараты из группы НПВС, наиболее часто применяемые с целью устранения лихорадочного синдрома, имеют ряд неблагоприятных действий, таких как ульцерогенность и гиперчувствительность; почечная недостаточность после длительного применения; нарушение функций ЦНС, печени и крови , , , . Именно поэтому актуальной проблемой современной фармакологии является поиск новых жаропонижающих средств с минимальным количеством побочных действий , .
Особый интерес для современных научных исследований представляют новые гетероциклические соединения из ряда производных цианотиоацетамида, поскольку цианотиоацетамид является легкодоступным и полифункциональным реагентом, широко применяемым в синтетической органической химии. Одним из важнейших направлений использования тиоамида является синтез широкого круга S,N-гетероциклических соединений, к значительным из которых следует отнести 3-цианопиридин-2(1Н)-тионы , , , .
Высокоперспективными в настоящее время для поиска новых высокоэффективных и безопасных лекарственных средств с разнообразными фармакодинамическими эффектами, включая анальгетический, являются производные цианотиоацетамида . Изучая отдельные единичные публикации, установлено, что некоторым из них присуща высокая противовирусная активность, в частности, в отношении вирусов клещевого энцефалита и Повассан, и умеренная анти-ВИЧ-активность. Кроме того, отдельные соединения аналогичной химической структуры проявляют выраженные противовоспалительные и аналептические свойства . Существенной особенностью производных цианотиоацетамида являются результаты проведенных исследования их острой пероральной токсичности in vivo, которые указывают на их низкую токсичность (4-5 класс токсичности).
В связи с этим нами был осуществлен предварительный отбор из 340 синтезированных на базе НИЛ «ХимЭкс» ЛГУ им. Владимира Даля под руководством д.хим.н. проф. Кривоколыско С.Г. новых производных цианотиоацетамида образцов для экспериментов in vivo. Использованы on-line ресурсы: Online SMILES Translatorand Structure File Generator от U.S. National Cancer Institute, OPSIN: Open Parser for Systematic IUPAC nomenclature от University of Cambridge, Centre for Molecular Informatics для определения наиболее перспективных соединений с учетом предполагаемых биомишеней для фармакокоррекции болевого, воспалительного или лихорадочного синдромов , , .
Общая схема синтеза вышеуказанных соединений представлена на рис. 1. Изначально дикетен 1 вводился в реакцию с 2,4-дихлоранилином 2, при этом с количественным выходом получен N-(2,4-дихлорфенил)ацетоацетамид 3. Последовательное взаимодействие цианотиоацетамида 4 с фурфуролом 5 и N-(2,4-дихлорфенил)ацетоацетамидом 3 в присутствии избытка N-метилморфолина (NMM) приводит к 6-метил-4-(2-фурил)-5-[(2,4-дихлорфенил)карбамоил]-3-циано-1,4-дигидропиридин-2-тиолату N-метилморфолиния 6. Реакция протекает как каскад процессов конденсации по Кнёвенагелю, присоединения по Михаэлю с последующей гетероциклизацией. S-Алкилирование полученного 3-циано-1,4-дигидропиридин-2-тиолата N-метилморфолиния 6 продуктами хлорацетилирования первичных ароматических аминов, N-замещенными α-хлорацетамидами 7, протекает в водном этаноле в присутствии эквимольного количества КОН по обычному механизму нуклеофильного замещения SN2 и дает целевые продукты, 2-метил-6-[(2-оксо-2-{ариламино}этил)тио]-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамиды , , .
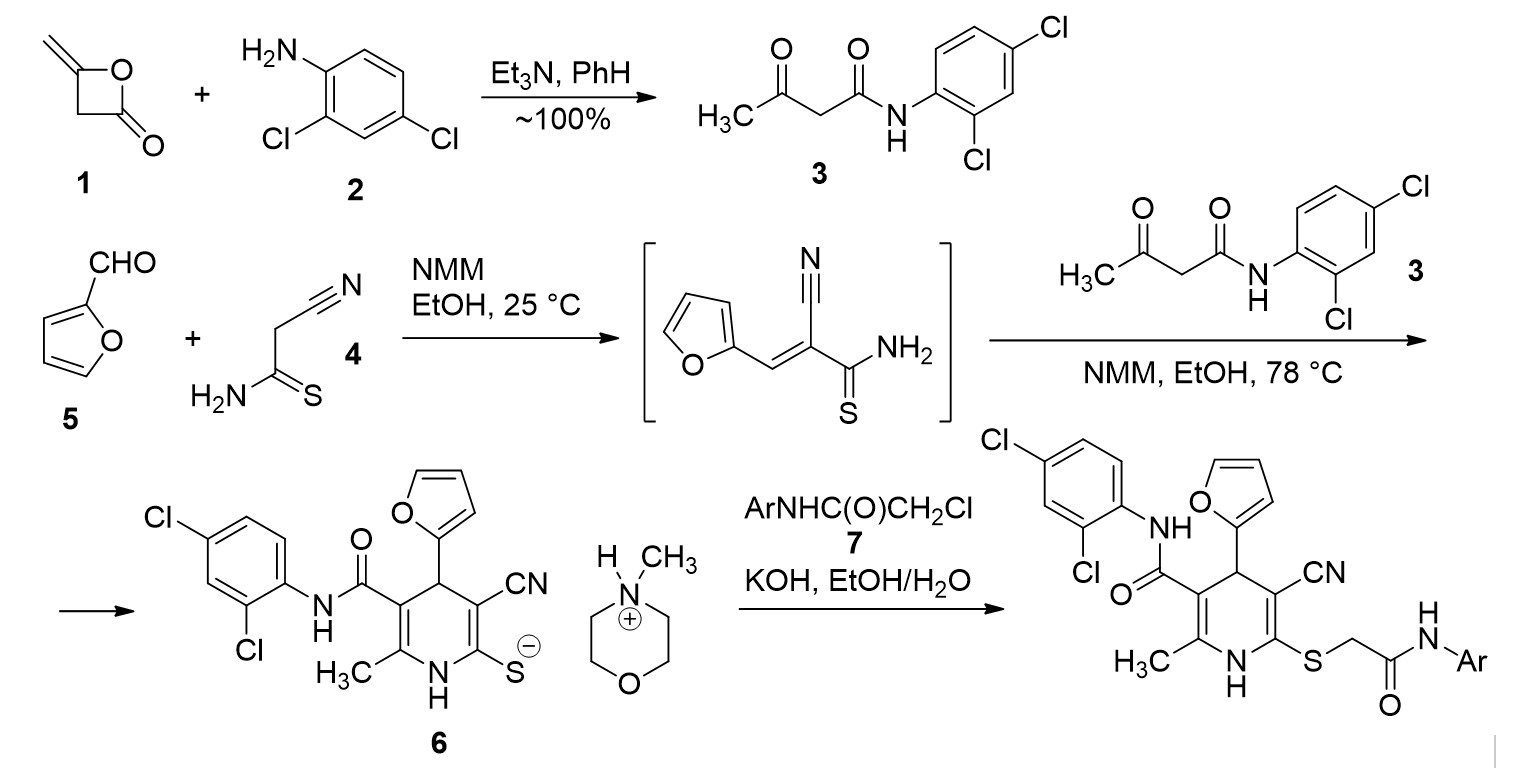
Рисунок 1 - Общая схема получения исследуемых производных цианотиоацетамида
Химические формулы новых гетероциклических соединений, отобранных таким образом, приведены ниже на рис. 2.
![Химические формулы исследуемых производных конденсированных 3-аминотиено[2,3-b]пиридинов и1,4-дигидропиридинов](/media/images/2023-06-15/34539917-ebfc-4a1d-9f71-9dd61a72db31.jpg)
Рисунок 2 - Химические формулы исследуемых производных конденсированных 3-аминотиено[2,3-b]пиридинов и1,4-дигидропиридинов
2. Методы и принципы исследования
Эксперимент проведен на 130 белых беспородных крысах-самцах массой 250-280 грамм, полученных из вивария ГУ ЛНР «Луганский государственный медицинский университет имени Святителя Луки» в осенне-зимний период в лаборатории кафедры фундаментальной и клинической фармакологии. Рандомизацию было решено проводить методом «конвертов». В данном эксперименте применялись группы, состоящие из 10 животных, которые были разделены на интактную, контрольную (крысы, которым вводили 2 мл 0,9% раствора натрия хлорида внутрижелудочно до моделирования теста), сравнения (референтную) (получавшие метамизол натрия) и 10 опытных групп, по количеству исследуемых новых производных конденсированных 3-аминотиено[2,3-b]пиридинов и 1,4-дигидропиридина .
Настоящее экспериментальное исследование проводились в полном соответствии с приказом №199н (Об утверждении Правил надлежащей лабораторной практики) Минздрава РФ от 1.04.2016г. На протяжении времени исследования животные были под наблюдением в условиях свободного доступа к пище и воде, согласно ГОСТ 33044–2014 «Принципы надлежащей лабораторной практики» (утвержден приказом Федерального агентства по техрегулированию и метрологии №1700-ст, от 20 ноября 2014 г.).
Проведенное исследование получило одобрение комиссии по биоэтике ГУ ЛНР «Луганский государственный медицинский университет имени Святителя Луки» (Луганск, кв.50-летия Обороны Луганска, 1Г), протокол №6 от 01.11.2021г.
Антипиретическая активность выявлялась в процессе проведения исследования на модели «дрожжевой» лихорадки, которую удалось воспроизвести в экспериментальных условиях путем подкожного введения 20% суспензии пекарских дрожжей, руководствуясь рекомендациям по проведению доклинических исследований новых биологически активных веществ , . Ректальная температура измерялась электронным термометром до введения пиррогена, а также спустя 18 часов после его введения. Зафиксировав индукцию лихорадки, приступили к внутрижелудочному введению исследуемых веществ в дозировке 5 мг/кг. Оценка антипиретического эффекта проводилось спустя 2, 4, 6 и 8 часов, путем измерения ректальной температуры электронным термометром. Животным контрольной группы в эквивалентном количестве вводился 0,9% раствор натрия хлорида , . В роли «препарат сравнения» для крыс референтной группы применялся метамизол натрия – Анальгин (ОАО «Фармстандарт») в дозировке 7 мг/кг. Десять образцов оригинальных вновь синтезированных соединений вводили через желудочный зонд в дозе 5 мг/кг за 1,5 часа до моделирования в экспериментальных условиях лихорадочной реакции .
Достоверность отличий между группами рассчитывали, используя непараметрический критерий Краскела-Уоллиса в сравнении с контрольной группой животных. Доля ложных отклонений гипотез (fdr) полученных доверительных вероятностей была определена с помощью метода Бенджамини-Хохберга. Для построения графиков и установления степени достоверности различий мы использовали язык R (версия 4.2.2), программы R-studio и R библиотеки ggstatsplot (версия 0.11.0) и ggpubr (версия 0.6.0).
3. Основные результаты и обсуждения
Результаты измерений температуры тела животных всех экспериментальных групп в начале опыта приведены на рис. 3. Как показали полученные данные, введение 20% взвеси пекарских дрожжей привело к стойкой лихорадке у крыс. Воссоздание в эксперименте «дрожжевой» лихорадки способствовало резкому росту температуры тела подопытных животных до значений 38,5-39,2°С.
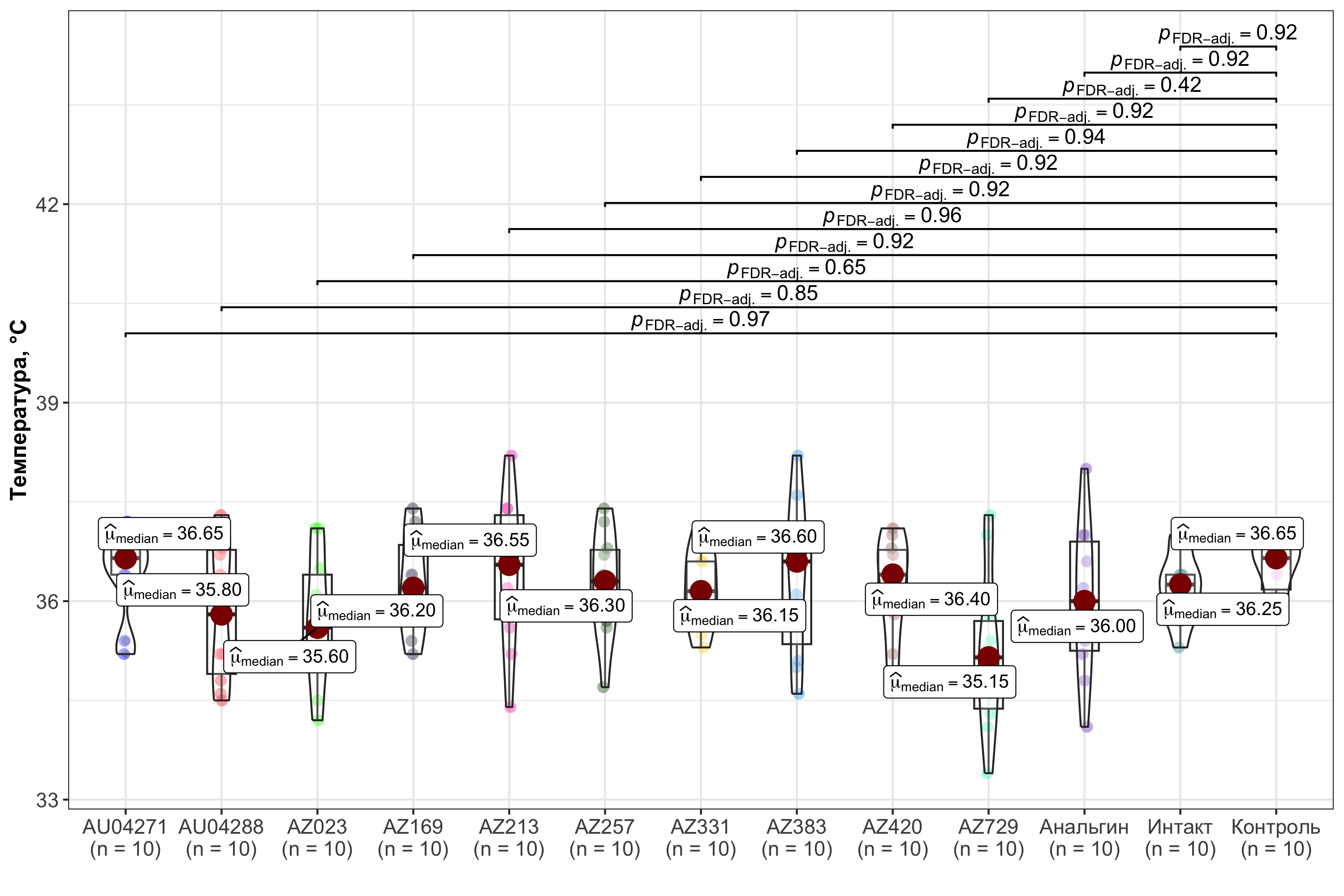
Рисунок 3 - Температура тела крыс всех экспериментальных групп до введения пирогена
Примечание: уровень статистической значимости указан в верхней части рисунка по сравнению с показателями контрольной группы
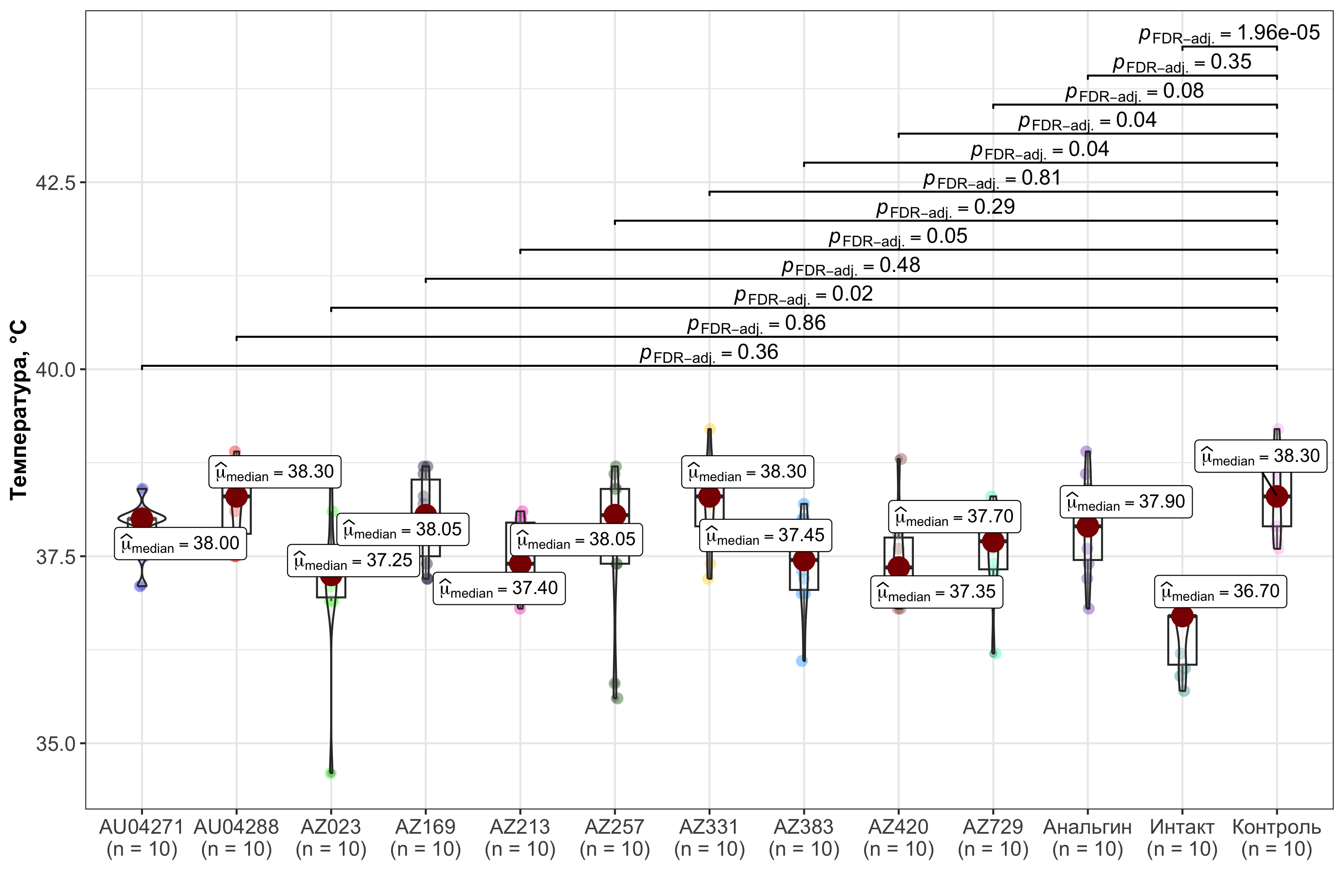
Рисунок 4 - Температура тела крыс всех экспериментальных групп через 2 часа после введения пирогена
Примечание: уровень статистической значимости указан в верхней части рисунка по сравнению с показателями контрольной группы
Сравнивая на диаграмме (рис. 5) значения температуры тела подопытных животных всех экспериментальных групп с контрольными значениями через 4 часа после индукции лихорадки, можно констатировать, что на этом сроке у восьми из десяти исследуемых новых гетероциклических соединений нами выявлены жаропонижающие свойства. Наиболее выраженная способность к уменьшению проявлений лихорадки обнаружена у производных дигидропиридина с шифрами AZ383 и AZ420, а также у деривата тиенопиридина с шифром AZ023, поскольку к этому сроку наблюдения температура тела животных снизилась до 37,15°С, 36,75°С и 36,8°С, соответственно.
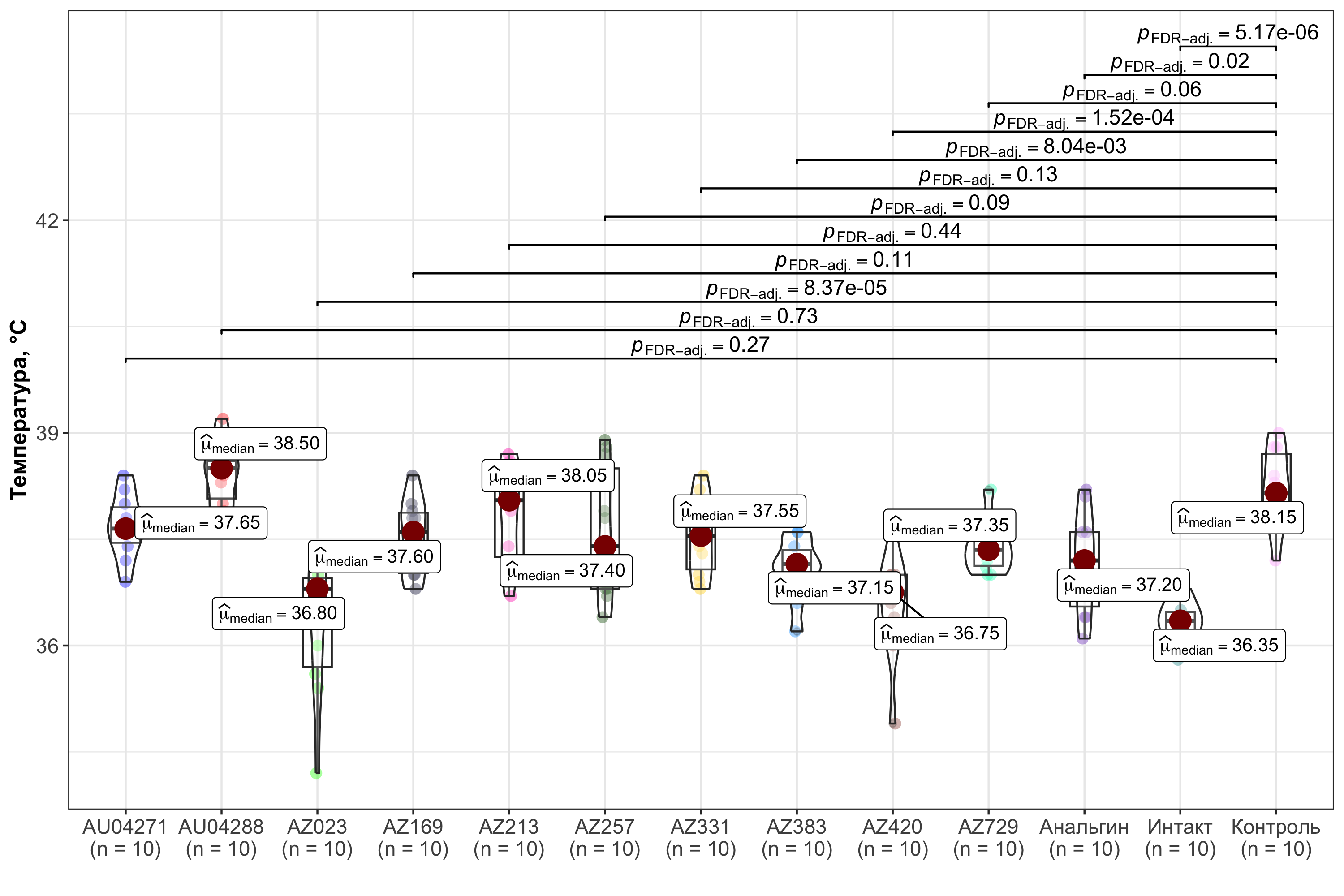
Рисунок 5 - Температура тела крыс всех экспериментальных групп через 4 часа после введения пирогена
Примечание: уровень статистической значимости указан в верхней части рисунка по сравнению с показателями контрольной группы
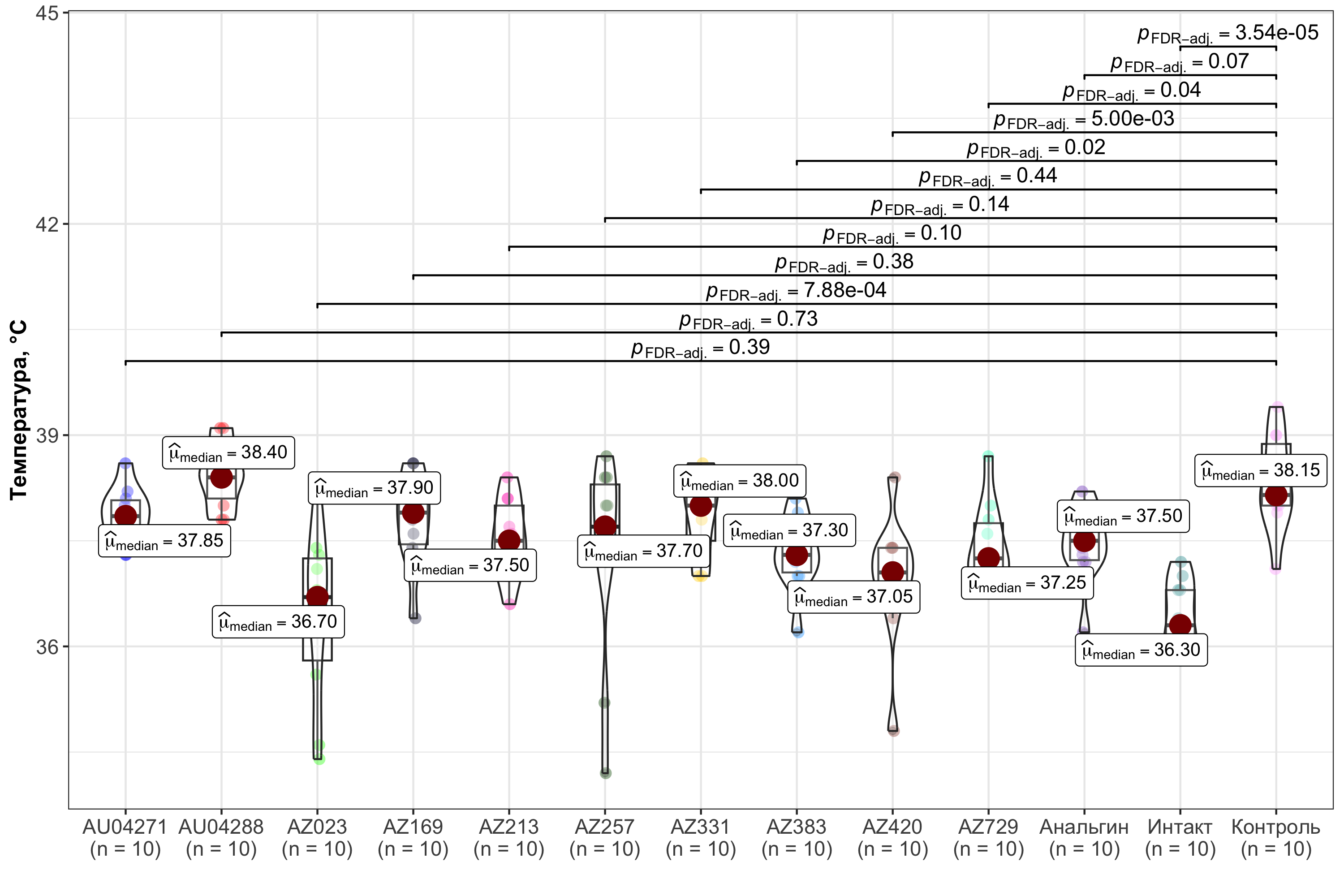
Рисунок 6 - Температура тела крыс всех экспериментальных групп через 6 часов после введения пирогена
Примечание: уровень статистической значимости указан в верхней части рисунка по сравнению с показателями контрольной группы
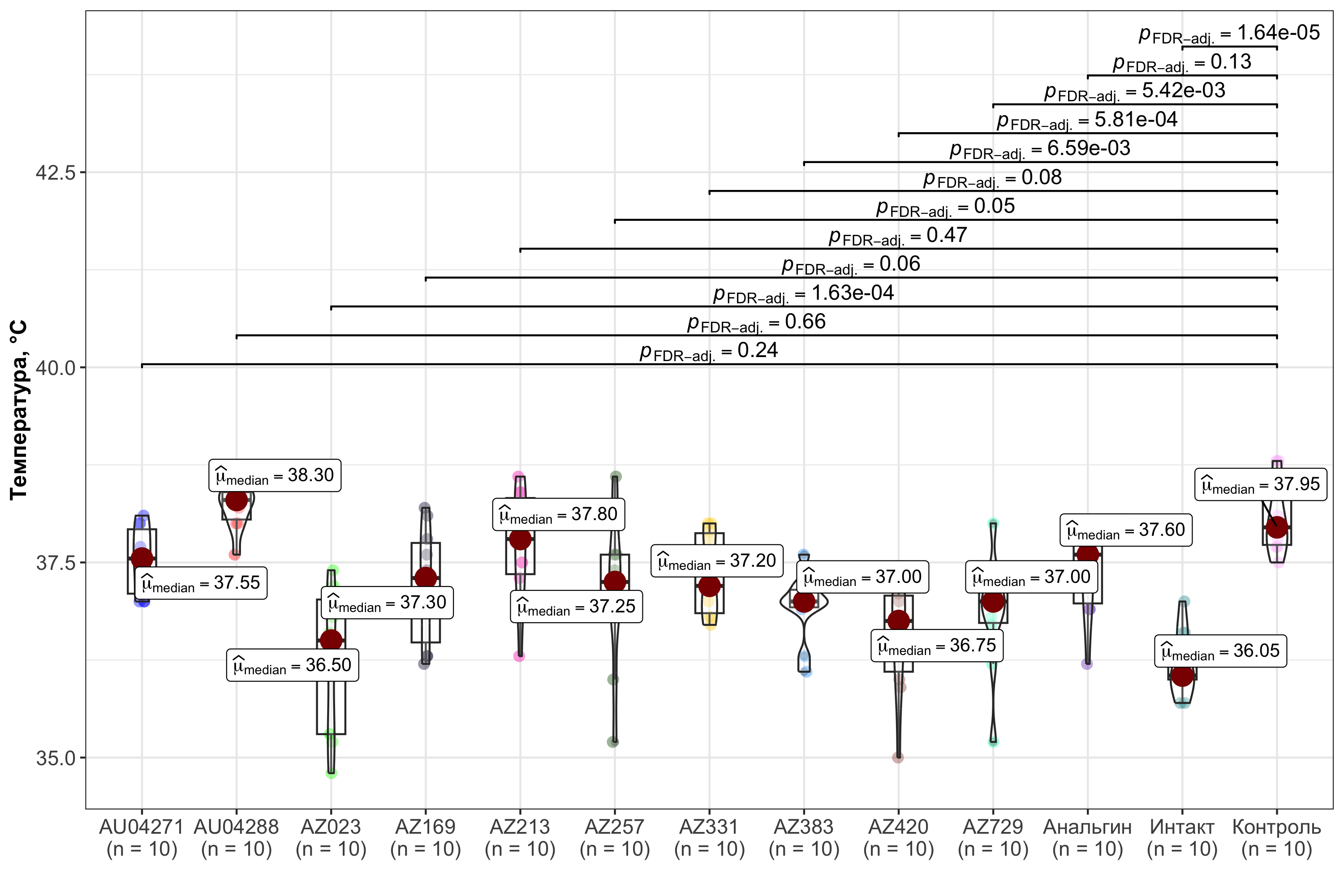
Рисунок 7 - Температура тела крыс всех экспериментальных групп через 8 часов после введения пирогена
Примечание: уровень статистической значимости указан в верхней части рисунка по сравнению с показателями контрольной группы
Таблица 1 - Показатели средних значений и доверительных вероятностей полученных в ходе эксперимента данных
| До введения пирогена | Через 2 часа после введения пирогена | Через 4 часа после введения пирогена | Через 6 часов после введения пирогена | Через 8 часов после введения пирогена | |||||
Исследуемая группа животных | Среднее значение | Доверительные вероятности | Среднее значение | Доверительные вероятности | Среднее значение | Доверительные вероятности | Среднее значение | Доверительные вероятности | Среднее значение | Доверительные вероятности |
Интактная | 36,4 | 3,70E-04 | 36,42 | 1,47E-04 | 36,39 | 2,04E-04 | 36,31 | 1,51E-04 | 36,19 | 1,50E-04 |
Контроль | 38,36 | 1 | 38,34 | 1 | 38,32 | 1 | 38,22 | 1 | 38,07 | 1 |
Анальгин | 37,64 | 0,025083193 | 37,91 | 0,15928133 | 37,46 | 0,008926793 | 37,18 | 0,00497612 | 37,41 | 0,02777271 |
AZ383 | 37,66 | 0,025028058 | 37,42 | 0,008031598 | 37,32 | 0,003117462 | 37,09 | 4,80E-04 | 36,93 | 1,97E-04 |
AZ023 | 37,55 | 0,020603236 | 37,18 | 0,00357271 | 36,43 | 0,001132354 | 36,32 | 2,33E-04 | 36,21 | 1,54E-04 |
AZ420 | 37,54 | 0,016881711 | 37,47 | 0,004495125 | 36,96 | 0,002143451 | 36,56 | 2,02E-04 | 36,55 | 1,55E-04 |
AZ257 | 37,51 | 0,020747459 | 37,64 | 0,184716936 | 37,28 | 0,094801249 | 37,58 | 0,095177 | 37,14 | 0,01251135 |
AZ213 | 37,55 | 0,013696589 | 37,51 | 0,006441481 | 37,54 | 0,02303103 | 37,85 | 0,24008055 | 37,72 | 0,32319135 |
AZ331 | 37,83 | 0,093548113 | 38,18 | 0,647666357 | 37,9 | 0,196052754 | 37,55 | 0,01875025 | 37,34 | 0,01866076 |
AZ729 | 37,25 | 0,016964913 | 37,57 | 0,013911343 | 37,46 | 0,007984101 | 37,38 | 0,0027348 | 36,85 | 7,44E-04 |
AZ169 | 38 | 0,323191355 | 38 | 0,255404919 | 37,8 | 0,14969654 | 37,52 | 0,01214856 | 37,21 | 0,01537038 |
AU04271 | 37,82 | 0,08729117 | 37,89 | 0,158486442 | 37,84 | 0,074562013 | 37,68 | 0,03328417 | 37,53 | 0,02747786 |
AU04288 | 37,87 | 0,160391585 | 38,18 | 0,495154535 | 38,42 | 0,732566827 | 38,43 | 0,46982333 | 38,23 | 0,30437842 |
4. Заключение
Таким образом, на основе установленной динамики изменения температуры тела крыс в условиях моделирования лихорадочной реакции выявлено, что наилучший результат в плане антипиретической активности показали производные конденсированных 3-аминотиено[2,3-b]пиридинов и 1,4-дигидропиридинов с шифрами AZ023, AZ420 и AZ383, поскольку превосходят метамизол натрия по степени выраженности (более чем на 1 ºС) и длительности (свыше 6 часов).
