БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ БИКОМПОНЕНТНЫХ НАНОЧАСТИЦ ОКСИДА МЕДИ И СЕРЕБРА
DOI: https://doi.org/10.23670/IRJ.2022.120.6.058
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ БИКОМПОНЕНТНЫХ НАНОЧАСТИЦ ОКСИДА МЕДИ И СЕРЕБРА
Научная статья
Фомина М.В.1, *, Сизова Е.А.2, Нечитайло К.С.3
1 ORCID: 0000-0002-7193-0243;
2 ORCID: 0000-0002-6518-3632;
3 ORCID: 0000-0002-8755-414X;
1 Оренбургский государственный медицинский университет, Оренбург, Россия;
2, 3Федеральный научный центр биологических систем и агротехнологий Российской академии наук, Оренбург, Россия
* Корреспондирующий автор (fomina_m.v[at]mail.ru)
Аннотация
Изучено токсическое действие наноразмерной окиси Cu, допированной наночастицами Ag размером 70 нм и 7,4 нм, полученных, соответственно, методом электрического взрыва проводника в атмосфере аргона и химическим методом. Установлена наибольшая активность в отношении данного lux-биосенсора, нанообъекта СuО в сочетании с нанокристаллами серебра размером 70 нм (ЕС50=0,062±0,001 мг/мл), в то время как на порядок менее выраженный ингибирующий эффект был зафиксирован у НЧ СuО, дополненных металлическим серебром с размерностью 7,2 нм (ЕС50=0,012±0,002 мг/мл). На этом фоне номинальные значения токсичности СuО и Ag, как монокомпонентных НЧ, в 2-32 раза были ниже по сравнению с бикомпонентными НЧ, что допускает возможность будущего использования их в качестве современных покрытий изделий биомедицинского назначения.
Ключевые слова: бикомпонентные наночастицы оксида меди, серебра, тест ингибирования бактериальной люминисценции.
BIOLOGICAL ACTIVITY OF BICOMPONENT NANOPARTICLES OF COPPER AND SILVER OXIDE
Research article
Фомина M.V.1, *, Sizova Y.A.2, Nechitailo K.S.3
1 ORCID: 0000-0002-7193-0243;
2 ORCID: 0000-0002-6518-3632;
3 ORCID: 0000-0002-8755-414X;
1 Orenburg State Medical University, Orenburg, Russia;
2, 3Federal Research Centre of Biological Systems and Agrotechnologies of the Russian Academy of Sciences, Orenburg, Russia
* Corresponding author (fomina_m.v[at]mail.ru)
Abstract
The toxic effect of the nanosized Cu oxide, doped with Ag nanoparticles measuring 70 nm and 7.4 nm was studied, obtained, respectively, by a conductor electrical explosion in the argon atmosphere and chemical method. The biggest activity was found in the lux-biosensor, the SuO nanoobject in combination with silver nanocrystals measuring 70 nm (EC50=0.062± 0.001 mg/ml), while the inhibition effect was measured at a lower magnitude in NP SuO, supplemented with metallic silver with a span of 7.2 nm (EC50=0.012± 0.002 mg/ml). At this rate, the nominal toxicity values of CuO and Ag as monocomponent NPs were 2-32 times lower than those of bicomponent NPs, allowing for their future use as modern biomedical coatings.
Keywords: biocomponent nanoparticles of copper and silver oxide, bacterial luminescence inhibition test.
Введение
Не вызывает сомнения тот факт, что антибактериальные препараты являются одними из самых часто назначаемых и применяемых средств [1, С.305], [4], как следствие – увеличение числа болезнетворных бактерий, обладающих множественной лекарственной устойчивостью [6], [7], что представляет серьёзную опасность для населения и требует разработки высокоэффективных антимикробных агентов, преимуществом которых бы являлся принципиально иной механизм антимикробного действия [2, C.639], [9], [10].
Особый интерес у научного сообщества вызывают наночастицы металлов (НЧ) и их оксидов (цинка, серебра, железа, меди, алюминия, титана, кремния) [3], [5], [10], а так же гибриды металлических НЧ, о чем свидетельствует более чем 10000 публикаций за последние 15 лет [8],[11], [12]. В свою очередь, многокомпонентные НЧ переходных металлов (Cu, Ag, Zn), формируя гальванические пары и обладая сложной структурой химического и фазового состава, приобретают иной механизм физико-химического взаимодействия с бактериальными клетками [3], [5]. Недостаточность, и в ряде случаев, противоречивость результатов исследования токсического влияния поликомпонентных НЧ в отношении микроорганизмов делают особо актуальными исследования биологических эффектов НЧ invitro, а использование сенсорного грамотрицательного микроорганизма с конституитивной экспрессией lux-генов позволяет провести быстрый скрининг антибактериальной активности бикомпонентных НЧ.
Цель исследования. провести оценку токсического действиянаноразмерной окиси Cu, допированной наночастицами Ag, в тесте ингибированиябактериальной люминисценции рекомбинантного штамма Escherichiacoli.
Методы и принципы исследования
В качестве объекта исследования были использованы наночастицы оксида двухвалентной меди (CuO) c размером от производителя 90 нм, 99,6% масс., удельной поверхностью (CuO)=14м2/г, изготовленные методом плазмохимическогосинтезаООО «Платина» (г.Москва). В качестве сравниваемыхсоединенийвыбранынаночастицы серебра, в первом случае, с заявленными от производителя характеристиками – размером 70 нм, удельной поверхностью Ag=6,5 м2/г, изготовленные методом электрического взрыва проводника в атмосфере аргона, состоящего на 99,99% из металлического серебра и до 0,01% адсорбированных газов СН4, СO2, Ar, N2, предоставленные «Передовые порошковые технологии», г. Томск. Во втором случае ˗ НЧ Ag размером 7,4 нм, удельной поверхностью нанопорошка Ag=79,4 м2/г, изготовленные методом химического синтеза, 99,99% масс. были предоставленны ФГБОУ ВПО «КНИТУ» ЦКП (г. Казань). Бикомпонентные механические смеси НЧ были представлены в соотношении CuO 80 масс.%, Аg 20 масс.%.
Предварительно был исследованы дзета-потенциал и размер формируемых в водной среде агрегатов наночастиц методом динамического светорассеяния с помощью анализатора «PhotocorCompact» (Россия). Величина ζ-потенциала СuО составила 47±0,1мВ, гидродинамический радиус – 139±16,2нм, для НЧ Ag, изготовленных методом электрического взрыва проводника в атмосфере аргона и методом химического синтеза, соответственно, -37±0,1мВ и 139±16,0 нм и 50±1,0 мВ и 87±20нм.
Токсическое действие нанокомпозитов изучено экспресс-методом ингибирования бактериальной люминисценции рекомбинантного штамма E. coli К12TG1 с клонированными luxCDABE-генами морской бактерииPhotobacteriumleiognathid54D10, выпускаемого под коммерческим названием «Эколюм» (ИБО«Иммунотех»,Россия) [1]. Предварительно штаммы E. coli К12TG1 выращивали при 37°C на LB-агаре с 100 мкг/мл антибиотика ампициллина, полученную бактериальную массу стандартизировали до ОП 450=0,4 ед.
Тестируемые образцы НЧ подвергали ультразвуковому диспергированию в режиме f-35 кГц, N-300 Вт, А-10 мкА в течение 30 минут, затем готовили серии двукратных разведений в дистиллированной воде начиная с 0,0125 М до 6×10-6M. После чего вносили НЧ в объеме 100 мкл в ячейки 96-луночных планшетов «Microlite 2+» (Thermo, США) и по 100 мкл бактериальной суспензии, и помещали в измерительный блок многофункционального микропланшетного ридера «InfiniteF200 PRO» (TecanAustriaGmbH, Австрия), где в течении последующих 180 мин регистрировали интенсивность биолюминесценции, оценивая ее в относительных единицах свечения (RLU). Где Iк-интенсивность свечения в контрольной кювете, Iо – интенсивность свечения в опытной кювете.
Индекс токсичности (Т) рассчитывали по формуле:
| |
(1) |
Учитывали пороговые уровни токсичности: от 0 % до 20% – образец не токсичен; от 20 до 50% – слабо токсичен, 50-100% – токсичен.
Статистическая оценка выполнена с использованием программных средств MicrosoftExcel и Statistica 6. Достоверность полученных результатов оценивали по t-критерию Стьюдента. Различия считались достоверными при р<0,05.
Основные результаты
Согласно полученным данным, наибольшую биоактивность в отношении данного lux-биосенсора проявляли нанообъекты СuО, допированные нанокристаллами серебра размером 70 нм (ЕС50=0,062±0,001 мг/мл), в то время как на порядок менее выраженный ингибирующий эффект был зафиксирован у НЧ СuО, дополненных металлическим серебром размером 7,2 нм (ЕС50=0,012±0,002 мг/мл).
На этом фоне номинальные значения токсичности СuО и Ag как монокомпонентных НЧ, в 2-32 раза были ниже по сравнению с данными, полученными в эксперименте с бикомпонентными НЧ.
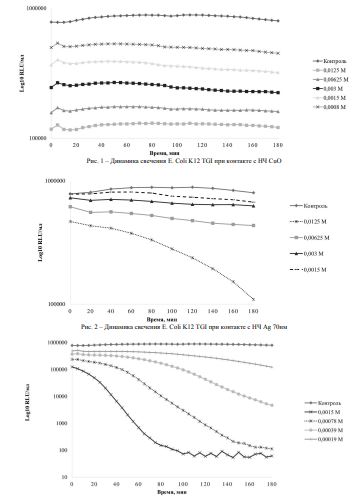
Наряду с этим, было отмечено развивающееся во времени дозозависимое ингибирование бактериального свечения. Так, в результате контакта Е. соli с убывающими концентрациями нанокристаллического оксида меди, допированного наноразмерным серебром 7,4нм, имело место 100% подавление бактериального свечения с первых минут контакта, начиная с концентрации 4 мг/мл и в течении последующих 180 минут пролонгирование эффекта биоактивности в конечных концентрациях нанопорошка (ЕС100=0,125±0,01 мг/мл) (рисунок 1 )
Рис. 3 – Динамика свечения E. ColiK12 TGI при контакте с НЧ Ag 7,2нм
Что касается наноструктурированного Аg размером 70 нм, как монопрепарата, данный нанообъект показал замедленный токсический эффект, по сравнению с Ag 7,4нм, развивающийся только к 120 минуте контакта с биосенсором (EC50=4,0±0,01 мг/мл) (рисунки 2 и 3).
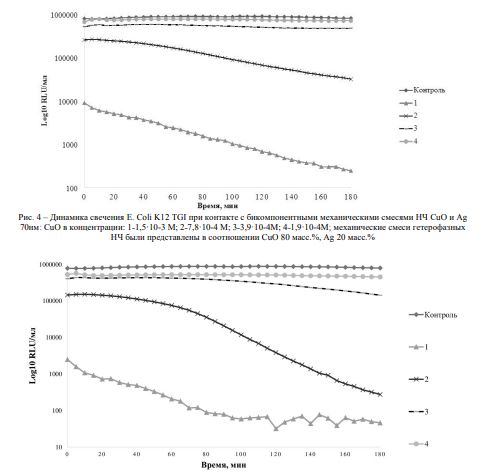
Рис. 5 – Динамика свечения E. ColiK12 TGI при контакте с бикомпонентными механическими смесями НЧ СuO и Ag 7,2нм: СuO в концентрации: 1 – 0,003 М; 2 – 1,5 ·10–3 М; 3 – 7,8 ·10–4 М; 4 – 3,9 ·10–4 М; механические смеси гетерофазных НЧ были представлены в соотношении CuO 80 масс.%, Аg 20 масс.%
Однако в сочетании с НЧ окиси меди показал себя в 2 раза более токсичным (рисунок 4), чем НЧ серебра меньшей размерности (рисунок 5).
Таким образом, наибольшую биоактивность в отношении lux-биосенсора Escherichiacoli К12TG1, в тесте ингибированиябактериальной люминисценции, проявляли наноформы СuО, допированные нанокристаллами серебра размером 70 нм, полученные методом электрического взрыва проводника в атмосфере аргона, по отношению к НЧ, полученным химическим методом, с размером 7,4 нм, что допускает возможность будущего использования их в качестве современных покрытий изделий биомедицинского назначения.
Заключение
Результаты настоящей работы свидетельствуют о том, что бикомпонентные наночастицы металлов/оксидов металлов, формирующие гальванические пары, обладают наряду с высокой антимикробной активностью, основанной на физико-химическом взаимодействии наночастиц с бактериальной клеткой, пролонгированным биологическим эффектом.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Peterson E. Antibiotic resistance mechanisms in bacteria: relationships between resistance determinants of antibiotic producers, environmental bacteria, and clinical pathogens. / E. Peterson, P. Kaur // Front Microbiol. – 2018. – № 9. – Pp. 2928. DOI: 10.3389/fmicb.2018.02928
- Ruiz-Garbajosa P. Epidemiology of antibiotic resistance in Pseudomonas aeruginosa. Implications for empiric and definitive therapy. / P. Ruiz-Garbajosa, R. Cantón // Update in Bacteriology. – 2017. – № 1. – Pp. 8-12. DOI: 10.1371/journal.pone.0193431.
- Ma C. Fabrication of Ag-Cu2O/PANI nanocomposites for visiblelight photocatalysis triggering super antibacterial activity. / C. Ma, Z. Yang, W. Wang et al. // J. Mater. Chem. C Mater. – 2020. – № – Pp. 2888–2898. DOI: 10.1039/ C9TC05891E
- Rice L.B. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: ESKAPE. / L.B. Rice // Infect. Dis. – 2008. – № 197(8). – Pp. 1079–1081. DOI: 10.1086/533452.
- Santini A. Metal-based nanoparticles as antimicrobial agents: An overview. / A. Santini, M.L. Garcia, E.B. Souto // Nanomaterials. – 2020. – № 10. – P. 292. DOI: 10.3390/nano10020292.
- Sánchez-López E. Metal-based nanoparticles as antimicrobial agents: an overview. / E. Sánchez-López, D. Gomes, G. Esteruelas et al. // Nanomaterials. – 2020. – № 10 (2). – Pp. 292–331. DOI: 10.3390/nano10020292
- Pop C.S. Metallic-based micro and nanostructures with antimicrobial activity. / C.S. Pop, M.D. Hussien, M. Popa et al. // Top Med Chem. – 2015. – № 15(16). – Pp. 1577–1582. DOI: 10.214/1568026615666150414125015
- Rubina M.S. Preparation and characterization of biomedical collagen-chitosan scaffolds with entrapped ibuprofen and silver nanoparticles. / M.S. Rubina, E.E. Said-Galiev, A.V. Naumkin et al. // Polymer Engineering Science. – 2019. – № 59. – Pp. 2479–2487. DOI: 10.1002/pen.25122
- Lv Y. Synthesis and evaluation of the structural and antibacterial properties of doped copper oxide. / Y. Lv, L. Li, P. Yin et al. // Dalton Trans. – 2020. – № 15 (49). – Pp. 4699–4709. DOI: 10.1039/D0DT00201A
- Abdal Dayem A. The Role of Reactive Oxygen Species (ROS) in the Biological Activities of Metallic Nanoparticles. / A. Abdal Dayem // Int J Mol Sci. – 2017. – № 18(1). – P. 120. DOI: 10.3390/ijms18010120.
- Мелешко А.А. Антибактериальные неорганические агенты: эффективность использования многокомпонентных систем. / А.А. Мелешко // Инфекция и иммунитет. – 2020. – № 10 (4). – С. 639–654. DOI: 10.15789/2220-7619-AIA-1512
- Леонтьев В.К. Антибактериальные эффекты наночастиц металлов. / В.К. Леонтьев // Российский стоматологический журнал. – 2017. – Т. 21.– № 6. – С. 304–307. DOI: 10.18821/1728-2802-2017- 21-6-304-307.
Список литературы на английском языке / References in English
- Peterson E. Antibiotic resistance mechanisms in bacteria: relationships between resistance determinants of antibiotic producers, environmental bacteria, and clinical pathogens. / E. Peterson, P. Kaur // Front Microbiol. – 2018. – № 9. – Pp. 2928. DOI: 10.3389/fmicb.2018.02928.
- Ruiz-Garbajosa P. Epidemiology of antibiotic resistance in Pseudomonas aeruginosa. Implications for empiric and definitive therapy. / P. Ruiz-Garbajosa, R. Cantón // Update in Bacteriology. – 2017. – № 1. – Pp. 8-12. DOI: 10.1371/journal.pone.0193431.
- Ma C. Fabrication of Ag-Cu2O/PANI nanocomposites for visiblelight photocatalysis triggering super antibacterial activity. / C. Ma, Z. Yang, W. Wang et al. // J. Mater. Chem. C Mater. – 2020. – № – Pp. 2888–2898. DOI: 10.1039/ C9TC05891E
- Rice L.B. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: ESKAPE. / L.B. Rice // Infect. Dis. – 2008. – № 197(8). – Pp. 1079–1081. DOI: 10.1086/533452.
- Santini A. Metal-based nanoparticles as antimicrobial agents: An overview. / A. Santini, M.L. Garcia, E.B. Souto // Nanomaterials. – 2020. – № 10. – P. 292. DOI: 10.3390/nano10020292.
- Sánchez-López E. Metal-based nanoparticles as antimicrobial agents: an overview. / E. Sánchez-López, D. Gomes, G. Esteruelas et al. // Nanomaterials. – 2020. – № 10 (2). – Pp. 292–331. DOI: 10.3390/nano10020292
- Pop C.S. Metallic-based micro and nanostructures with antimicrobial activity. / C.S. Pop, M.D. Hussien, M. Popa et al. // Top Med Chem. – 2015. – № 15(16). – Pp. 1577–1582. DOI: 10.214/1568026615666150414125015
- Rubina M.S. Preparation and characterization of biomedical collagen-chitosan scaffolds with entrapped ibuprofen and silver nanoparticles. / M.S. Rubina, E.E. Said-Galiev, A.V. Naumkin et al. // Polymer Engineering Science. – 2019. – № 59. – Pp. 2479–2487. DOI: 10.1002/pen.25122
- Lv Y. Synthesis and evaluation of the structural and antibacterial properties of doped copper oxide. / Y. Lv, L. Li, P. Yin et al. // Dalton Trans. – 2020. – № 15 (49). – Pp. 4699–4709. DOI: 10.1039/D0DT00201A
- Abdal Dayem A. The Role of Reactive Oxygen Species (ROS) in the Biological Activities of Metallic Nanoparticles. / A. Abdal Dayem // Int J Mol Sci. – 2017. – № 18(1). – P. 120. DOI: 10.3390/ijms1801012.
- Meleshko A.A. Antibakterial'ny'e neorganicheskie agenty': e'ffektivnost' ispol'zovaniya mnogokomponentny'x sistem [Antibakterial'nyye neorganicheskiye agenty: effektivnost' ispol'zovaniya mnogokomponentnykh sistem [Antibacterial inorganic agents: the effectiveness of using multicomponent systems]]. / A.A. Meleshko // Infekciya i immunitet [Infektsiya i immunitet [Infection and immunity]]. – 2020. – № 10 (4). – Pp. 639–654. DOI: 10.15789/2220-7619-AIA-1512 [in Russian]
- Leont'ev V.K. Antibakterial'ny'e e'ffekty' nanochasticz metallov [Antibacterial effects of metal nanoparticles]. / V.K. Leont'ev // Rossijskij stomatologicheskij zhurnal [Rossiyskii stomatologicheskii zhurnal [Russian Dental Journal]]. – 2017. – Vol. 21.– № 6. – Pp. 304–307. DOI: 10.18821/1728-2802-2017- 21-6-304-307. [in Russian]