АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ ЛЕКТИНОВ ИЗ АСЦИДИИ DIDEMNUN TERNATANUM
Овчаренко Ю.С.1, Чикаловец И.В.2, Молчанова В.И.3, Черников О.В.4
1 ORCID: 0000-0003-0327-7761, Магистрант,
2 ORCID: 0000-0001-5102-9311, Кандидат химических наук, доцент,
1,2 Дальневосточный федеральный университет, Владивосток, Россия,
2 Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН, Владивосток, Россия;
3ORCID: 0000-0002-5289-7388, Кандидат химических наук,
4ORCID: 0000-0002-3076-3637, Кандидат биологических наук,
3,4 Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН, Владивосток, Россия
АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ ЛЕКТИНОВ ИЗ АСЦИДИИ DIDEMNUN TERNATANUM
Аннотация
Лектины, углевод-связывающие белки, тесно связаны с исследованием структуры и функций клеточных мембран, что находит широкое применение в рамках изучения защитных реакций различных представителей беспозвоночных. В работе представлены результаты исследований антибактериальной активности двух лектинов, выделенных из асцидии Didemnun ternatanum. Установлено, что и DTL проявляет бактериостатические и бактерицидные свойства, а DTL-A с высокой аффинностью связываются со специфическими лигандами, известными как ассоциированные с патогенами молекулярные паттерны или ПАМП.
Ключевые слова: лектины, морские беспозвоночные, асцидии, антибактериальная активность.
Ovcharenko Yu.S.1, Chikalovets I.V.2, Molchanova V.I.3, Chernikov O.V.4
1 ORCID: 0000-0003-0327-7761, Master’s degree student,
2 ORCID: 0000-0001-5102-9311, PhD in Chemistry, Associate Professor,
1,2 Far Eastern Federal University, Vladivostok, Russia,
2 G.B. Elyakov Pacific Institute of Bioorganic Chemistry FEB RAS, Vladivostok, Russia;
3 ORCID: 0000-0002-5289-7388, PhD in Chemistry,
4 ORCID: 0000-0002-3076-3637, PhD in Chemistry,
3,4 G.B. Elyakov Pacific Institute of Bioorganic Chemistry FEB RAS, Vladivostok, Russia
ANTIBACTERIAL ACTIVITY OF LECTINS FROM THE ASSISTANCE DIDEMNUN TERNATANUM
Abstract
Lectins, carbohydrate-binding proteins, are closely related to the study of the structure and functions of cell membranes, which is widely used in the study of the protective responses of various representatives of invertebrates. The paper presents the results of studies of the antibacterial activity of two lectins isolated from Aspidia Didemnun ternatanum. It has been established that both DTL shows bacteriostatic and bactericidal properties, and DTL-A binds with high affinity to specific ligands known as pathogen-associated molecular patterns or PAMP.
Keywords: lectins, marine invertebrates, ascidians, antibacterial activity.
Лектины — белки или гликопротеины не иммунной природы, специфически и обратимо связывающие моно-, олигосахариды и гликоконъюгаты, не вызывая их химического превращения. Интерес исследователей к лектинам обусловлен их уникальными свойствами: высокой избирательностью связывания с углеводными структурами, а также сочетанием углевод-рецепторной активности с токсичностью, митогенной и иммуностимулирующей активностью [1, С. 1]. Лектины были открыты более 100 лет тому назад. Однако только в последние годы они оказались в центре биологических исследований, поскольку научные открытия последних лет показали, что углевод-белковое взаимодействие является важным механизмом передачи биологической информации на уровне клетки, то есть передачи информации при взаимодействии клеток друг с другом и межклеточным матриксом. Через гликоконьюгат-зависимые взаимодействия осуществляются такие важные биологические процессы как оплодотворение, проникновение инфекции в клетки хозяина, миграция лейкоцитов к месту воспаления, а также процессы малигнизации и метастазирования. Лектины широко распространены в биологическом мире, начиная с вирусов и кончая млекопитающими.
В последние годы морские организмы привлекают внимание исследователей в качестве потенциальных источников новых веществ, обладающих широким спектром биологического действия: антивирусной, антибактериальной и фунгицидной активностями [2, С. 60]. Взаимодействуя с углеводами, экспонированными на клетках – мишенях, лектины могут распознавать углеводные детерминанты на поверхности различных патогенов. Этот процесс играет важную роль в системе защитных реакций врожденного иммунитета различных групп животных, прежде всего у беспозвоночных, не имеющих системы приобретенного иммунитета. В настоящее время углевод-распознающие рецепторы, равно как и скавенджер- и толл-подобные рецепторы, относятся к группе паттерн-распознающих молекул, которые связываются со специфическими молекулярными паттернами (известными как ассоциированные с патогенами молекулярные паттерны или ПАМП) определенных микроорганизмов. Результатом подобного рода взаимодействий является активация клеточных и гуморальных эффекторных систем, направленных на элиминацию патогена из внутренней среды организма. У беспозвоночных основная функциональная нагрузка по распознаванию и уничтожению патогена приходится на лектины, которые могут находиться на поверхности циркулирующих клеток гемолимфы – гемоцитов или иметь сывороточную локализацию. Они играют ведущую роль в распознавании микроорганизмов и многоклеточных паразитов [3, С. 443]. Лектины взаимодействуют со специфическими лигандами, что приводит к активации циркулирующих клеток, их направленной миграции в место проникновения патогена и запуску процесса фагоцитоза. Если лектины имеют сывороточную локализацию, то они могут повышать эффективность фагоцитоза, выполняя функции опсонинов.
Ранее нами из колониальной асцидии Didemnun ternatanum были выделены два лектина: GlcNAc-специфичный (DTL) [4, С. 250] и мультиспецифичный (DTL-A) [5, С. 83], который наряду с GlcNAc/GalNAc-специфичным сайтом связывания содержит и гепарин-связывающий домен. В экспериментах in vitro была показана активность этих лектинов в отношении ВИЧ [6, С. 165]. Поэтому представляло интерес дальнейшее исследование свойств этих лектинов, а именно их антибактериальной активности.
Поскольку схема выделения DTL и DTL-A представляла многостадийный процесс, включающий две аффинных хроматографии и три гель-фильтрации, мы разработали новую схему, позволяющую значительно сократить количество стадий. На основе бромциан-активированной сефарозы был получен новый аффинный сорбент гепарин-сефароза. Для этого гепарин был предварительно модифицирован путем присоединения дополнительного спэйсера с аминогруппой на конце цепи, как описано [7, С. 4824]. DTL получали как описано ранее. Экстракт асцидии наносили на перекрестносшитый овальбумин, связанную фракцию, содержащую DTL, элюировали глициновым буфером. Для получения DTL-A, фракцию, не связавшуюся с овальбумином, наносили на гепарин-сефарозу, элюцию проводили фосфатным буфером с рН 8,0, содержащим 1 М NaCl, т.к. было показано, что при таких условиях лектин не взаимодействует с гепарином. Таким образом, удалось получить оба лектина в гомогенном состоянии и с хорошей углевод-связывающей активностью, которую мы оценивали методом гемагглютинации. Для того, чтобы ответить на вопрос, относятся ли DTL и DTL-A к группе паттерн-распознающих молекул, был разработан метод твердофазного лектин-ферментного анализа (ТЛФА) с использованием конъюгатов лектинов с ферментной меткой (пероксидазой хрена – ПХ). Конъюгаты были получены по методу Наканэ [8, P. 1085] с небольшими модификациями. В частности, пероксидазу окисляли периодатом натрия, затем добавляли к ней DTL или DTL-A в присутствии специфичного моносахарида, чтобы защитить углевод-связывающий сайт лектина в момент его связывания с ферментом. В качестве ПАМП были использованы ЛПС, пептидогликан, маннан и бета-1,3-глюкан, основные гликоконъгаты, входящие в состав клеточной стенки бактерий. На полистирольный планшет с адсорбированными ПАМП добавляли конъюгаты DTL-ПХ и DTL-A-ПХ в различных концентрациях. В качестве положительного контроля на планшет адсорбировали гликопротеины, высокоспецифичные для лектинов: для DTL – овальбумин (OVA), для DTL-A – муцин из желудка свиньи (PSM – porcine stomach mucin). В качестве отрицательного контроля - бычий сывороточный альбумин (БСА). К получившемуся комплексу добавляли ферментный субстрат и после развития окраски измеряли оптическую плотность на планшетном спектрофотометре. На рисунке 1 представлены диаграммы связывания лектинов с различными ПАМП.
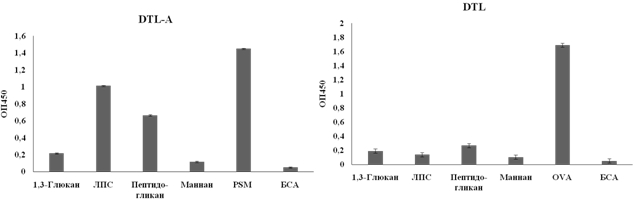
Рис. 1 – Связывание DTL и DTL-A c ПАМП
DTL-А взаимодействовал с ЛПС из грамотрицательных бактерий и с пептидогликаном из грамположительных бактерий, что свидетельствует о широком спектре углеводного узнавания. DTL не реагировал ни с одним из лигандов, но оказался более активным при исследовании агглютинации и ингибирования роста различных тест-культур. Было изучено взаимодействие выделенных нами лектинов с некоторыми представителями грамположительных (Bacillus subtilis, Staphylococcus aureus) и грамотрицательных бактерий (Escherichia coli), а так же гриба (Candida albicans). Суспензию микрооганизмов в постоянной концентрации смешивали с растворами лектинов и после инкубации визуально оценивали степень агрегации. DTL агглютинировал все микроорганизмы, а DTL-A только B. subtilis. Также было исследовано влияние лектинов на рост тест-культур методом турбидиметрии. Микроорганизмы выращивали в культуральном планшете в присутствии лектинов, а результат регистрировали измерением мутности клеточной суспензии. DTL на 49% ингибировал рост S. аureus и на 21% рост E. coli, но на 17% стимулировал роcт B. subtilis и на 30% - C. albicans. DTL-А также незначительно стимулировал рост S. аureus, E. coli и C. аlbicans на 13, 19 и 16% соответственно. Различия в связывающей активности DTL и DTL-A с ПАМП и в их способности агглютинировать микроорганизмы и влиять на их рост свидетельствуют о том, что более тонкие механизмы могут быть вовлечены в процессы узнавания патогенов, т. к. строение микробиальной клеточной поверхности может быть очень сложным. Аналогичные результаты были получены при исследовании антибактериальной активности лектина из устрицы Crassostrea gigas [9, С. 574]. Кроме того, при исследовании антибактериальной активности лектинов морских гидробионтов в экспериментах in vitro было показано, что они могут оказывать как ингибирующий, так и стимулирующий эффект на рост грамположительных и грамотрицательных бактерий. Это зависит от специфичности каждого лектина, его способности связываться с углеводными цепями поверхности бактериальной клетки [10, С. 6].
Вероятно, несмотря на то, что и DTL и DTL-A с полной уверенностью нельзя отнести к паттерн-распознающим молекулам, они обладают антибактериальной активностью. Так, в отношении S. аureus и E. сoli DTL проявляет бактериостатические (подавляющие размножение бактерий) и бактерицидные (вызывающие гибель бактерий) свойства, т.к. полагают, что агглютинация в большинстве случаев может приводить к деструкции клеточной поверхности и, как следствие, ингибированию клеточного роста. DTL-A не проявил себя в экспериментах по прямому взаимодействию с микроорганизмами, но показал хорошее связывание с некоторыми ПАМП. Вероятно, этот лектин будет активен в отношении каких-то других микроорганизмов, на поверхности которых будут экспонированы гликоконъюгаты, аналогичные используемым в нашем эксперименте. Либо лектину не хватило времени для активного воздействия на микробиальные патогенны. Так, лектин из устрицы C. gigas начал проявлять ингибирующую активность на рост тест-культур только после 4 часов инкубации.
Постоянное воздействие на патогенные микроорганизмы антибиотиков естественно приводит к появлению устойчивых штаммов, а интенсивное и неразборчивое использование этих лекарств может ускорить этот процесс. Устойчивые штаммы бактерий нечувствительны к большей части стандартного лечения, что увеличивает риск распространения некоторых болезней [11, С. 2]. В этом связи поиск новых антибактериальных препаратов постоянно увеличивается, и природные объекты являются потенциальными источниками новых соединений, активных в отношении различных микроорганизмов. [12, С. 1242].
Список литературы / References
- Sharon N. Lectins / N. Sharon, H. Lis. - Netherlands: Springer, 2007. –XVIII, 454 p. doi:10.1007/978-1-4020-6953-6
- Marine proteins and peptides: Biological activities and applications / Edited by Se‐Kwon Kim. – UK: John Wiley & Son, Ltd, 2013. - 816 p. doi:10.1002/978111837508.
- 3. Chaosomboon A. Lipopolysaccharide- and b-1,3-glucan-binding protein from Fenneropenaeus merguiensis functions as a pattern recognition receptor with a broad specificity for diverse pathogens in the defense against microorganisms / Chaosomboon, B. Phupet, O. Rattanaporn and othrers // Developmental and Comparative Immunology. – 2017. – Vol. 67. – P. 434-444. doi:10.1016/j.dci.2016.07.006.
- Belogortseva N. N-Acetyl-D-glucosamine-specific lectin from the ascidian Didemnum ternatanum / N. Belogortseva, V. Molchanova, V. Glazunov and others // Biochimica et Biophysica Acta. – 1998. – Vol. 1380. – P. 249-256. doi:10.1016/S0304-4165(97)00150-5
- Molchanova V. New GlcNAc/GalNAc-specific lectin from the ascidian Didemnum ternatanum / V. Molchanova, I. Chikalovets, W. Li and others // Biochimica et Biophysica Acta. – 2005. – Vol. 1723. – P. 82-90. doi:10.1016/j.bbagen.2004.12.022.
- Luk’yanov P. A. Carbohydrate-binding proteins of marine invertebrates / P. A. Luk’yanov, O. V. Chernikov, S. S. Kobelev and others // Russian Journal of Bioorganic Chemistry. – 2007. – Vol. 33 (1). – P. 161-169. doi:10.1134/S1068162007010190
- Pankhurst G. J. Characterization of the heparin-binding properties of human clusterin / G. J. Pankhurst, C. A. Bennett, S. B. Easterbrook-Smith // Biochemistry. – 1998. – Vol. 37. – P. 4823-4830. doi:10.1021/bi972367v
- Nakane P. К. Peroxidase-labeled antibody. A new method of conjugation / P. К. Nakane, A. Kawaoi // The Journal of Histochemistry and Cytochemistry. – 1974. – Vol. 22(12). – P. 1084-1091. doi:10.1177/22.12.1084
- Li H. A single-CRD C-type lectin from oyster Crassostrea gigas mediates immune recognition and pathogen elimination with a potential role in the activation of complement system / H. Li, H. Zhang, S. Jiang and others // Fish & Shellfish Immunology. – 2015. – Vol. 44. – P. 566-575. doi:10.1016/j.fsi.2015.03.011
- Adhya M. Purification and characterization of an N-acetylglucosamine specific lectin from marine bivalve Macoma birmanica / M. Adhya, B. Singha, B. Chatterjee // Fish & Shellfish Immunology. – 2009. – Vol. 27. – P. 1-8. doi:10.1016/j.fsi.2008.11.001
- Critically important antimicrobials for human medicine – 5th rev. Geneva: World Health Organization; 2017. Licence: CC BY-NC-SA 3.0 IGO.
- Smith V. J. Conventional and unconventional antimicrobials from fish, marine invertebrates and micro-algae / V. J. Smith, A. P. Desbois, E. A. Dyrynda // Marine Drugs. – 2010. – Vol. 8. – P. 1213-1262. doi:10.3390/md8041213
