ИССЛЕДОВАНИЕ ФИЗИКО-ХИМИЧЕСКИХ ПРОЦЕССОВ, ПРОИСХОДЯЩИХ ПРИ ГОРЕНИИ ПЫЛЕУГОЛЬНОГО ТОПЛИВА
ИССЛЕДОВАНИЕ ФИЗИКО-ХИМИЧЕСКИХ ПРОЦЕССОВ, ПРОИСХОДЯЩИХ ПРИ ГОРЕНИИ ПЫЛЕУГОЛЬНОГО ТОПЛИВА
Научная статья
Аскарова А.С.1, Болегенова С.А.2, Максимов В.Ю.3, Бекмухамет А.4, Бекетаева М.Т.5
1, 2,3,4,5 Казахский национальный университет им. аль-Фараби, Алматы, Казахстан
Аннотация
Исследовано процессов тепломассопереноса в высокотемпературных и термохимически активированных реагирующих потоках в реальной физико-химической системе (турбулентные течения с физико-химическими превращениями в камерах сгорания) в трехмерной геометрии с применением численных методов.
Ключевые слова: горения, тепломассопереноса, топлива.
Keywords: combustion, heat and mass transfer, fuel.
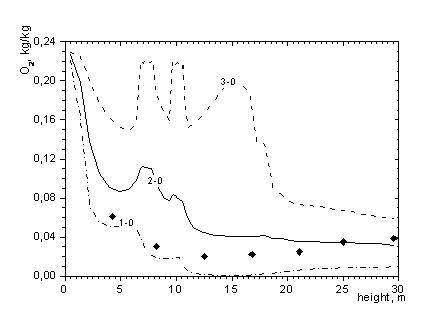
Источником кислорода для камеры сгорания является атмосферный воздух. Для осуществления реакции горючих компонентов топлива с кислородом необходима достаточно высокая температура для воспламенения, тщательное перемешивание топлива или турбулентность, обеспечивающая такое перемешивание, а также время, достаточное для полного сгорания. Анализ скоростных и температурных полей показал, что в центре топочной камеры создаются благоприятные условия для интенсивного протекания реакций горения. Изменение концентрации окислителя по высоте топочной камеры представлено на рисунке 1 в виде кривых изменения концентрации кислорода. Максимальные изменения концентрации кислорода имеют место в области горелок, через которые подается топливо и окислитель. В этой области химические реакции идут наиболее интенсивно и неоднородно. По мере приближения к выходу отклонения максимальных и минимальных значений от среднего сокращается.
Рисунок 1. Распределение концентрации О2 по высоте топочной камеры
1-0 – минимальные; 2-0 – средние; 3-0 – максимальные в сечении значения
Линии 1-0, 2-0, 3-0 – расчет; ♦ - эксперимент
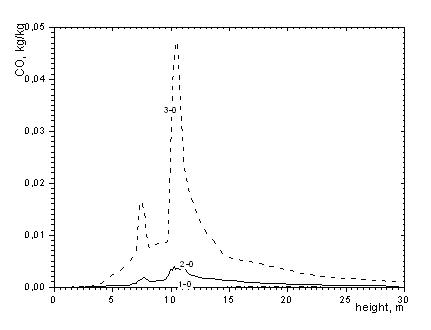
Картина образования оксидов углерода (СО, СО2) представлена на рисунках 1 - 3. Процесс этот неоднозначен. В процессе горения углерода вторичные реакции догорания СО в газовом объеме и восстановления СО2 на поверхности углерода, переплетающиеся с первичными реакциями, позволяют судить о нелинейности истинного химического механизма горения углерода. Кроме того, гетерогенный процесс горения углерода, связанный с наложением диффузионных явлений на химические процессы, вместе с внутренним реагированием еще более искажает основной химический процесс. Механизм реагирования углерода с кислородом представляется следующим образом. Из газового объема кислород адсорбируется на поверхности углерода, где атомы кислорода вступают в химическое соединение с углеродом, образуя сложные углеродно-кислородные комплексы СxОy. Последние распадаются с образованием СО2 и СО. Скорость распада сильно увеличивается с увеличением температуры. Углерод при определенных температурных условиях реагирует с кислородом и углекислотой. В результате реагирования углерода с кислородом одновременно образуется оба окисла углерода - СО2 и СО, а в результате реагирование с углекислотой – окись углерода. Совместное нахождение окиси углерода и кислорода, способных реагировать друг с другом, дает третью реакцию – горение окиси углерода. В местах расположения горелок происходит как подача пылеугольной пыли с определенной концентрацией углерода, так и воздуха с определенным значением концентрации углерода. В этой области происходят основные реакции реагирования углерода, о чем свидетельствуют максимумы на кривых распределения СО (рисунок 2).
Таким образом, можно выделить три основных процесса, преобладающих при реагировании углерода топлива:
- реагирование углерода с кислородом, связанное с одновременным образованием СО2 и СО: С + О2 = СО2 + 409,1 МДж/моль
2С + О2 = 2СО + 2*123,3 МДж/ 2 моля
- взаимодействие углекислоты с углеродом
С + СО2 = 2СО – 162,5 МДж/моль
- соединение кислорода с окисью углерода
2СО + О2 = 2СО2 + 2*285,8 МДж/2 моля.
Рисунок 2. Распределение концентрации СО по высоте топочной камеры
1-0 – минимальные; 2-0 – средние; 3-0 – максимальные в сечении значения
.
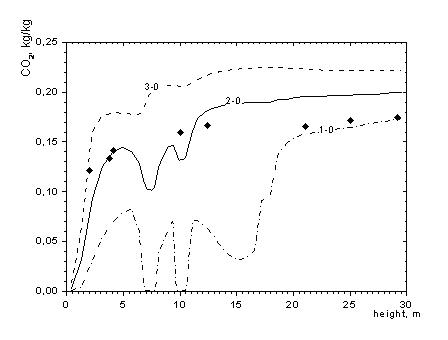
Рисунок 3. Распределение концентрации СО2 по высоте топочной камеры
1-0 – минимальные; 2-0 – средние; 3-0 – максимальные в сечении значения
Линии 1-0, 2-0, 3-0 – расчет; ♦ - эксперимент
Как видно из рисунков 2 и 3 картина распределения СО не соответствует полю СO2, что говорит об отличиях в процессе образования СО2 и СО. Видно, что основное образование диоксида углерода СО2 происходит по мере удаления от центра топки, т.е. области столкновения струй топлива и окислителя из противогорелок. Таким образом, можно сделать вывод о том что, процесс образования оксидов углерода зависит не только от явлений переноса, но и от кинетики процесса. Тот факт, что углерод может реагировать с кислородом разными способами, чрезвычайно важен при проектировании топочных камер. Любые технологии сжигания должны обеспечивать полное смешивание топлива с кислородом до полного сгорания с образованием CO2, а не CO. В противном случае тепловыделение резко снизится, поскольку при образовании CO выделяется лишь 28% той энергии, которая выделяется при образовании CO2.
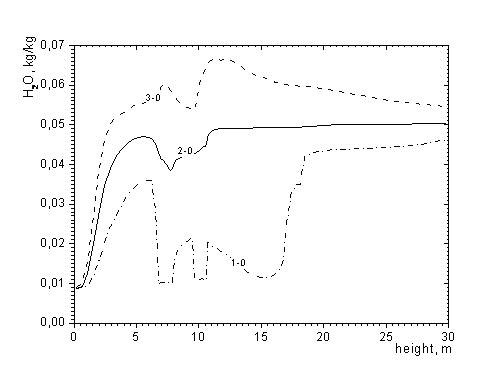
Рисунок 4. Распределение концентрации Н2О по высоте топочной камеры
1-0 – минимальные; 2-0 – средние; 3-0 – максимальные в сечении значения
Кроме углерода, в топливе содержится определенное количество водорода, что тоже вносит свой вклад в процесс горения 2H2 +O2 = 2H2O. В процессе реакции горения вода, содержащаяся в топливе, испаряется. Поскольку экибастузский уголь имеет высокую влажность при высоких температурах процесс испарения идет интенсивно, с чем связано наличие минимумов на кривых распределения концентрации H2O (рисунок 4). Образование воды в газообразном состоянии наиболее интенсивно происходит на некотором расстоянии от зоны горелок и имеет равномерный характер по мере приближения к выходу из топочного пространства.
Список литературы / References
2. Аскарова А.С., Болегенова С.А., Бекмухамет А., Максимов В.Ю. Бекетаева М.Т., Габитова З.Численное исследование турбулентных течений в канале с дополнительным источником массы //Материалы международной научно-практической конференции «Проблемы модернизации и посткризисное развитие современного общества», март 2012г., г. Саратов, Россия, с.60-62.