ДВУЯДЕРНЫЕ НЕЙРОНЫ В КУЛЬТУРЕ ТКАНИ
Лактионова А.А.1, Сотников О.С.2
1Кандидат биологических наук; 2доктор биологических наук, профессор, ФГБУ науки Института физиологии им. И.П. Павлова РАН
ДВУЯДЕРНЫЕ НЕЙРОНЫ В КУЛЬТУРЕ ТКАНИ
Аннотация
В ганглиях автономной нервной системы все многочисленные исследователи отмечают большое количество (от 13% до 56%) двуядерных нейронов. Причиной двуядерности считается амитоз, неполный митоз нейронов взрослых животных. Однако процесс амитоза на живых нервных клетках никто не изучал. В проведенном исследовании предпринята попытка воспроизвести массовую двуядерность в эксперименте, изучить структурную кинетику и механизм этого неврологического феномена.
Ключевые слова: культура ткани, нейроны, слияние.
Laktionova A.A. 1, Sotnikov O.S. 2
1РhD; 2Doctor of Biological Sciences, professor in Pavlov Institute of Physiology, Russian Academy of Sciences
BINUCLEATE NEURONS IN TISSUE CULTURE
Abstract
In the ganglia of the autonomic nervous system all the numerous researchers have noted a large number (13% to 56%) of binucleate neurons. The reason of binucleate neuron cells is considered the amitosis, incomplete mitosis neurons of adult animals. However, the process amitosis on living nerve cells nobody studied. In this research, an attempt to reproduce mass dicarions of the neurons in an experiment to study the structural kinetics and mechanism of this neurological phenomenon.
Keywords: tissue culture, neurons, fusion.
Двуядерные нейроны (дикарионы) встречаются в центральной нервной системе достаточно редко. Однако в ганглиях автономной нервной системы их количество может достигать несколько десятков процентов от общего количества нейронов [1-5]. Число дикарионов увеличивается и в раннем онтогенезе [14], и при патологии нервной системы. Значимым следует считать не только массовость явления в некоторых случаях, но и отсутствие, в принципе, в современной нейрофизиологии четких представлений о механизме этого оригинального процесса в нервной системе. Поэтому мы считали необходимым попытаться выявить механизм формирования двуядерных нейронов с помощью культуры живых нейронов.
Исследования проведены на изолированных нейронах окологлоточного ганглия Lymnaea stagnalis. Изоляция клеток осуществляли с помощью обработки ганглиев 0,4% проназой в течение 40 мин, повторного пипетирования (повторного всасывания через пипетки разного диаметра) и отмывания клеточной суспензии от остатков глиальных оболочек. Культивирование проводилось до 5 суток в среде RPMI-1640. Нормальные культуры исследовались в инвертированном фазовоконтрастном микроскопе (БИОМЕД-3И, Россия) с использованием видеокамеры (ДСМ 300, КНР), связанной с компьютером. Для получения большого количества слившихся нейронов изолированные клетки центрифугировали в течение 15 мин при 3000 g оборотов в минуту и по общепринятой методике фиксировали с помощью 2,5% глутарового альдегида и в 2% OsO4 в течение 90 мин на холоде (детальнее см. [8]).
Среди только что отпрепарированных нейронов обнаружено 0,165 % дву- и трехядерных нейронов (рис. 1, а, в). Такое явление у моллюсков обнаружено впервые. Процент дикарионов в контроле оказался небольшим. Тем убедительнее будет утверждение о том, что двуядерность нейронов можно воспроизвести в эксперименте и показательнее – механизм процесса удвоения ядер в одном нейроне. Ядра у таких двуядерных клеток оказались неодинакового размера (рис. 1, б), что противоречит представлениям об одинаковых размерах ядер при их делении в клетке.
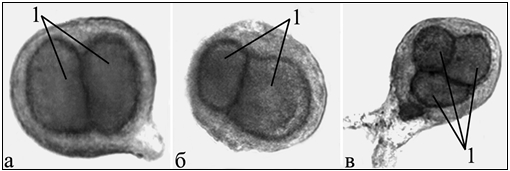
Рис. 1 - Живые необычные нейроны из диссоциированных окологлоточных ганглиев нормальных моллюсков Lymnaea stagnalis
а – двуядерный нейрон; б – дикарион с ядрами разных диаметров; в – трехядерный нейрон; 1 – ядро. Прижизненная микроскопия. Фазовый контраст. Об. 40Ph, ок. 10
Наблюдения за поведением живых нейронов в культуре выявляют несколько этапов их взаимодействия. Вначале, расположенные поодиночке клетки образуют отростки, которые целенаправленно растут к соседним, но не обязательно к ближайшим нейронам. После их контактов с телами или отростками соседей, нейриты начинают сокращаться, притягивая клетки, друг к другу (рис. 2, а-в).
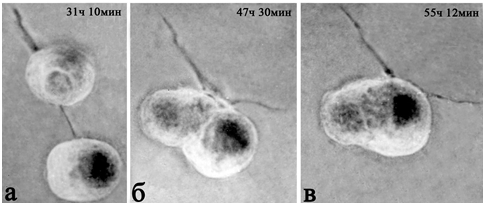
Рис. 2 - Сближение и слияние двух одноядерных нейронов в культуре ткани
а-в – динамика процесса. Время – от начала съемки. Культура ткани. Прижизненная микроскопия. Фазовый контраст. Об. 40Ph, ок. 10
На вторые сутки культивирования граница в области контакта тел нейронов выравнивается и вдоль нее при фазовом контрасте просматривается ряд вытянутых, прозрачных, вакуолеподобных структур которые представляют собой расширившиеся фрагменты межклеточной щели. Картины этих расширенных щелей наглядно проявляются после фиксации на полутонких срезах (рис. 3). Между ними видны мостики слияния спаренных клеток.
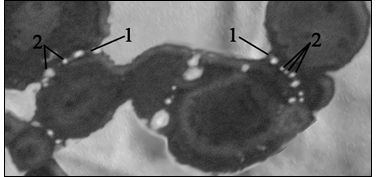
Рис. 3 - Синцитиально сливающиеся многоядерные нейроны (симпласты), сближенные в результате их центрифугирования.
1 – мостики синцитиального слияния; 2 – фрагменты межклеточных щелей резко расширенных. Фиксация глутаральдегидом. Фазовый контраст. Об. 40Ph, ок. 10
Сливаются нейроны и в более поздние сроки, при развитии нервного сплетения (рис. 4 а, б). Контуры спаренных клеток 8-образной формы, постепенно увеличивая угол контакта между ними, превращаются в единую сферическую структуру – двуядерный нейрон. Синцитиальное слияние двух, трех и более тел живых клеток разного диаметра в культуре наблюдается нередко (рис. 4 в-д). При сближении тел живых нейронов путем их центрифугирования можно получить многоядерные синцитиально связанные нейроны (симпласты) (рис. 3).
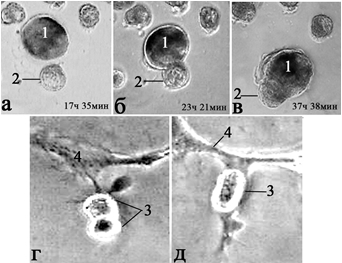
Рис. 4 - Слияние массы живых нейронов разного диаметра до (а-в) и после (г-д) формирования нервного сплетения.
а-д – стадии процессов; 1 – крупный изолированный нейрон; 2 – мелкий сливающийся нейрон; 3 – фрагмент нервного сплетения; 4 – те же синцитиально слившиеся нейроны (дикарион). Время – от начала съемки. Прижизненная микроскопия. Фазовый контраст. Об. 40Ph, ок. 10
Таким образом, с помощью культуры изолированных нейронов удается доказать, что механизмом образования двуядерных нейронов является их синцитиальное слияние. Полный или частичный амитоз на живых нейронах никогда не наблюдается. Кроме того, в эксперименте показана возможность искусственного получения массовой двуядерности. Прижизненные исследования в культуре изолированных нейронов убеждают нас в том, что образование дикарионов – это сложный естественный многоступенчатый процесс слияния нейронов, воспроизводимый в культуре ткани в массовом порядке. В природе, in vivo, массовый бинуклеарный процесс так же встречается при условии высокой естественной концентрации нейронов. Например, нами подробно описан массовый процесс формирования обширных синцитиальных пор слияния у тесно расположенных нейронов гиппокампа при механической травме [9, 10]. При гипоксии слияние нейронов часто отмечается в коре полушарий большого мозга [11, 12]. С помощью микроэлектродной техники доказана возможность массового образования дикарионов путем естественной перфорации gap. junction при действии вирусов псевдоводобоязни на вегетативные нейроны в культуре ткани [13]. Для образования межнейронального синцития и слияния нейронов имеет значение и степень покрытия нейронов глиальной оболочкой, например, в онтогенезе [14]. Пока неясно, почему бинуклеарность принимает массовый характер у вегетативных нейронов в периферических ганглиях. Видимо близкий контакт этих нейронов – не единственное объяснение их удвоения. Вообще, по-видимому, речь идет о распространенной общей закономерности – способности любых спаренных биологических мембран к сближению, локальному контактированию с образованием синцитиальных перфораций и молекулярному слиянию [15]. Об этом убедительно свидетельствуют многочисленные уже работы о слиянии различных нейронов с клетками других тканевых типов [16-18]. Доказательство формирования массовой двуядерности свидетельствует также о необходимости дополнить представления о нейронной теории С. Рамон и Кахаля [19] данными о принципиальной возможности формирования синцитиальной межнейронной связи в нервной системе.
Литература
- Ehlers P. Über Altersveränderungen an Grenzstrang-Ganglien vom Meerschweinchen // Anat. Anz. – – Bd. 98, H. ½. – S. 24-34.
- Pawlikowski M.Z. // Folia Morph. – – № 3. – p. 211-218.
- Guzek J.W. // Folia Morph. – 1958. – № 4. – p. 315-327.
- Шабадаш А.Л., Зеликина Т.И. Цитохимия экспериментальной кариотомии в невроцитах вегетативных ганглиев млекопитающих // ДАН СССР. – – т. 183. № 4. – с. 944-947.
- Ярыгин Н.Е., Ярыгин В.Н. Патологические приспособительные изменения нейрона. М.: Медицина, 1973. – 175 c.
- Anastas S.B., Mueller D., Semple-Rowland S.L. et al. // Cereb. Cortex. – – v. 21, № 2. – p. 338-344.
- Kawataki T., Sato E., Sato T. et al. // Neurol. Med. Chir. – 2010. – v. 50, № 3. – p. 228-231.
- Sotnikov O.S. Biomedical Tissue Culture. – Ch. 6. – Intech., 2012. – p. 83-114.
- Sotnikov O.S., Paramonova N.M., Archakova L.I. // Cell Biol. Int. – 2010. – v. 34, № 4. – p. 361-364.
- Парамонова Н.М., Сотников О.С., Краснова Т.В. // Бюлл. экспер. биол. мед. – 2010. – т. 150, № 7. – с. 113-116.
- Пальцын A.A., Колокольчикова Е.Г., Константинова Н.Б. и др. // Бюлл. экспер. биол. мед. – 2008. – т. 146, № 10. – с. 467-470.
- Пальцын А.А., Константинова Н.Б., Романова Г.А. и др. // Бюлл. экспер. биол. мед. – – т. 148, № 11. – с. 580–583.
- McCarthy K.M., Tank D.W., Enquist L.W. // PLoS Pathog. – 2009. – v. 5, № 10. – p. 1-20.
- Сотников О.С., Малашко В.В., Рыбакова Г.И. // Морфология. – 2007. – в. 131, № 2. – с. 7-15.
- Сотников О.С., Парамонова Н.М., Арчакова Л.И. // Биол. мембр. – 2010. – т. 27, № 5. – с. 1-9.
- Alvarez-Dolado M., Pardal R., Garcia-Verdugo J.M. et al. // Nature. – 2003. – v. 425, № 6961. – p. 968-973.
- Ackman J.B., Siddiqi F., Walikonis R.S. et al. // J. Neurosci. – 2006. – v. 26, № 44. – p. 11413-11422.
- Bae J.S., Han H.S., Youn D.H. et al. // Stem. – 2007. – v. 25, № 5. – p. 1307-1316.
- Ramon y Cajal S. Neuron or reticular theory? Objective evidence of the anatomical unity of nerve cells. – Madrid: Institute "Ramon y Cajal", 1954. – XIII – 144 p.
