ВЛИЯНИЕ ВИДА ТОПЛИВА ПРИ СИНТЕЗЕ ЭЛЕКТРОДНОГО МАТЕРИАЛА Pr1.6Cа0.4Ni0.6Cu0.4O4 НА ЕГО ЭЛЕКТРОХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ
ВЛИЯНИЕ ВИДА ТОПЛИВА ПРИ СИНТЕЗЕ ЭЛЕКТРОДНОГО МАТЕРИАЛА Pr1.6Cа0.4Ni0.6Cu0.4O4 НА ЕГО ЭЛЕКТРОХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Аннотация
В данной работе сложный оксид состава Pr1.6Cа0.4Ni0.6Cu0.4O4 со структурой Раддлесдена-Поппера был синтезирован методом горения нитрат-органических прекурсоров при варьировании органического компонента (глицин, глицерин, лимонная кислота и поливиниловый спирт), используемого для их приготовления. Показано влияние условий проведения синтеза на процессы фазообразования, конечную температуру термообработки, удельную поверхность и электрохимические характеристики электродов на основе полученного сложного оксида на Ce0.8Sm0.2O1.9 электролите. По результатам измерений поляризационных характеристик были определены оптимальные параметры синтеза материала Pr1.6Cа0.4Ni0.6Cu0.4O4 для дальнейшего его использования в качестве перспективного катодного материала для среднетемпературных твердооксидных топливных элементов.
1. Введение
Интерес исследователей-материаловедов к сложным оксидам, обладающим структурой фаз Раддлесдена-Поппера Ln2NiO4+δ (A2BO4+δ) вызван наличием у данных материалов ряда функциональных свойств, таких как высокая каталитическая активность в реакциях восстановления кислорода и термомеханическая совместимость с твердыми электролитами, а также приемлемая смешанная проводимость. Благодаря высокой функциональности, данные материалы могут быть успешно использованы как для создания электродов для среднетемпературных твердооксидных топливных элементов (ТОТЭ) , , , электролизеров , так и каталитических мембран.
Исследование электрохимической активности электродов ряда Ln2NiO4+δ (Ln=La, Pr, Nd) в контакте с электролитами YSZ , и Ce0.8Sm0.2O1.9 (SDC) показало, что наилучшими характеристиками обладают электроды на основе Pr2NiO4+δ. При долговременных испытаниях ячейки с электродом Pr2NiO4+δ в интервале температур 600–800℃ было установлено, что значение поляризационного сопротивления претерпевает незначительное изменение несмотря на то, что электрод разлагается на фазы Pr4Ni3O10+δ, PrNiO3-δ и Pr6O11 в течение месяца использования .
Для устранения твердофазной деструкции материала электрода Pr2NiO4+δ и повышения его стабильности при эксплуатации ячейки была применена стратегия замещения ионов, находящихся в А- и В- позициях. Авторы работ , , попытались стабилизировать основную фазу никелита частичным замещением ионов празеодима на ионы неодима. После проведения испытаний гомогенные материалы в ряду Pr2–xNdxNiO4+δ были зафиксированы для степени замещения 1.0≤x≤2.0 согласно и для 0,75≤x≤1,0 согласно . В работе состав PrNdNiO4+δ деградировал после отжига в течение 500 часов при 870 ℃, поэтому дополнительная стабилизация никелитной фазы была осуществлена при помощи со-допирования по В-позиции ионами меди. Изучение замещения ионов лантана на ионы празеодима в La2NiO4+δ, проведённое в работе , показало, что сложный оксид La1.5Pr0.5NiO4+δ не являлся однофазным после старения, но показал лучшие результаты в плане электрохимической активности и был признан авторами оптимальным составом для перспективного использования в ТОТЭ.
Согласно выводам работ , , ,
, для сохранения гомогенности после длительной термической обработки сложнооксидных фаз в случае замещения А-позиции в Ln2NiO4+δ ионами щелочноземельных металлов (Ca, Sr, Ba) требуется меньшая концентрация иона-допанта по сравнению с ионами редкоземельных элементов. Авторы работы минимальное значение поляризационного сопротивления Rp получили для состава Pr1.8Ba0.2NiO4+δ. В работе установлено, что Pr1.7Ca0.3NiO4+δ в сравнении с Pr2NiO4+δ характеризуется повышением электропроводности, однако при этом электрохимические характеристики электродов в контакте с электролитом SDC ухудшаются.Улучшение электрохимических характеристик электродов на основе Ln2NiO4+δ за счет снижения температуры припекания электрода к электролиту может быть достигнуто при частичном замещении ионов никеля на ионы меди , , ,
. В работе отмечено, что оптимальным составом при замещении ионов никеля на медь является состав Nd1.6Ca0.4Ni0.8Cu0.2O4+δ, так как именно для этого содержания меди наблюдается минимальное значение Rp на подложке SDC. Тогда как в для составов PrNdNi1-yCuyO4+δ (x=0.0–0.2) показано, что при использовании в качестве электролита YSZ с увеличением концентрации меди Rp увеличивается.В настоящей работе разработаны методы получения дисперсного сложнооксидного материала со структурой Раддлесдена-Поппера состава Pr1.6Ca0.4Ni0.6Cu0.4O4+δ с различным органическим топливом. Установлена взаимосвязь морфологии порошковых материалов и электрохимических свойства электродов на их основе. Выделен наиболее перспективный способ синтеза для получения широкого круга материалов на основе слоистых никелато-купратов.
2. Образцы и методика эксперимента
Для приготовления образцов Pr1.6Cа0.4Ni0.6Cu0.4O4 в качестве исходных реагентов использовали следующие: карбонат кальция CaCO3 (квалификация ос. ч.), оксид празеодима Pr6O11 (квалификация ч. д. а.), ацетат никеля Ni(CH3COO)2·4H2O (квалификация х. ч.) и оксид меди CuO (квалификация ч. д. а.). Для удаления адсорбированных газов и воды, карбонат кальция CaCO3, оксид празеодима Pr6O11 и оксид меди CuO предварительно прокаливали при 500, 600 и 400 °C, соответственно. Для растворения исходных оксидов и карбоната использовали азотную кислоту HNO3 (квалификация ос. ч.). В качестве комплексообразующего агента и органического топлива при удалении растворителя и горении реагирующей смеси применяли глицин, лимонную кислоту, глицерин и поливиниловый спирт (все квалификации ч. д. а.). Необходимые количества исходных неорганических веществ рассчитывали по уравнению реакции (1) с образованием сложного оксида, углекислого газа CO2 и воды H2O:
Стехиометрические количества CaCO3, Pr6O11 и CuO растворяли в разбавленной азотной кислоте, а Ni(CH3COO)2·4H2O – в дистиллированной воде. Полученные растворы смешивали и перемещали в фарфоровую чашку, куда затем добавляли органический компонент в соотношении 1:1 к количеству взятой для растворения исходных веществ азотной кислоты по стехиметрии реакции горения с образованием в качестве газообразных продуктов диоксида углерода, воды и азота
.Количество органического компонента (топлива) необходимое для горения, рассчитывали из формальной реакции взаимодействия органического компонента с нитрат-ионами с образованием, например:
Полученные нитрат-органические прекурсоры нагревали в фарфоровой чашке до полного испарения воды и образования аморфизированного сухого остатка после горения. Полученные в реакциях последующего горения порошки подвергали последовательному отжигу при температурах от 650 до 1100°C (шаг 100°C) в течение 12 часов с промежуточным перетиранием в среде этилового спирта. Скорость нагрева/охлаждения составляла 100 градусов в час. Окончательную температуру термообработки определяли рентгенографически (получение однофазного образца).
Материал электролита Ce0.8Sm0.2O2 был получен методом горения глицерин-нитратных композиций с использованием нитрата церия Ce(NO3)3·6H2O и оксида самария Sm2O3 (обе квалификации ч. д. а.) в качестве исходных реагентов. Оксид самария растворяли в азотной кислоте HNO3 (квалификация ос. ч.). В полученную смесь добавили нагретый для снижения вязкости глицерин, после чего полученную смесь нагревали на плитке при температуре ~300 °C до полного испарения воды и самовоспламенения. Окончательную термообработку проводили при температурах 950 и 1050 °C в течение 12 часов с промежуточным перетиранием в среде этилового спирта. Скорость нагрева/охлаждения составляла 100 градусов в час.
Рентгеновские данные необходимые для определения фазового состава образцов получали на воздухе при Т = 25 °C на дифрактометре Inel Equinox 3000 в Cu-Kα излучении. Идентификацию фаз осуществляли при помощи программных пакетов fpeak и MainMenu.
Для оценки величины удельной поверхности порошков Pr1.6Cа0.4Ni0.6Cu0.4O4 использовали метод низкотемпературной сорбции и тепловой десорбции азота на автоматическом анализаторе поверхности и пористости SoftSorbi-II ver.1.0.
Для исследования электрохимических характеристик электродов изготавливали ячейки с электролитом Ce0.8Sm0.2O2 толщиной около 1 мм с нанесенными симметрично с обеих сторон электродами методом окрашивания. Функциональный слой составов Pr1.6Cа0.4Ni0.6Cu0.4O4 наносили толщиной 30 мкм. Припекание слоев проводили при температуре 1000 °C с выдержкой 2 часа.
Поляризационное сопротивление электродов измеряли методом импедансной спектроскопии с помощью потенциостата SI 1260 и электрохимического интерфейса SI 1287 (Solartron Industries Inc.) в частотном диапазоне 0,01 Гц – 300 кГц при амплитуде возмущающего переменного напряжения 50 мВ. Регистрация каждого импедансного спектра завершалась измерением полного сопротивления электрохимической ячейки постоянному току. Исследования проводились в температурном диапазоне 500 – 850 ºС в воздушной среде.
Поляризационное сопротивление рассчитывали по следующей формуле (3):
где Rdc – сопротивление ячейки, измеренное на постоянном токе; Rhf – высокочастотное сопротивление; S – площадь электрода.
Погрешность определения удельного поляризационного сопротивления зависит, в основном, от точности определения сопротивления электролита из импедансных спектров и составляет примерно ± 3%.
3. Результаты и обсуждение
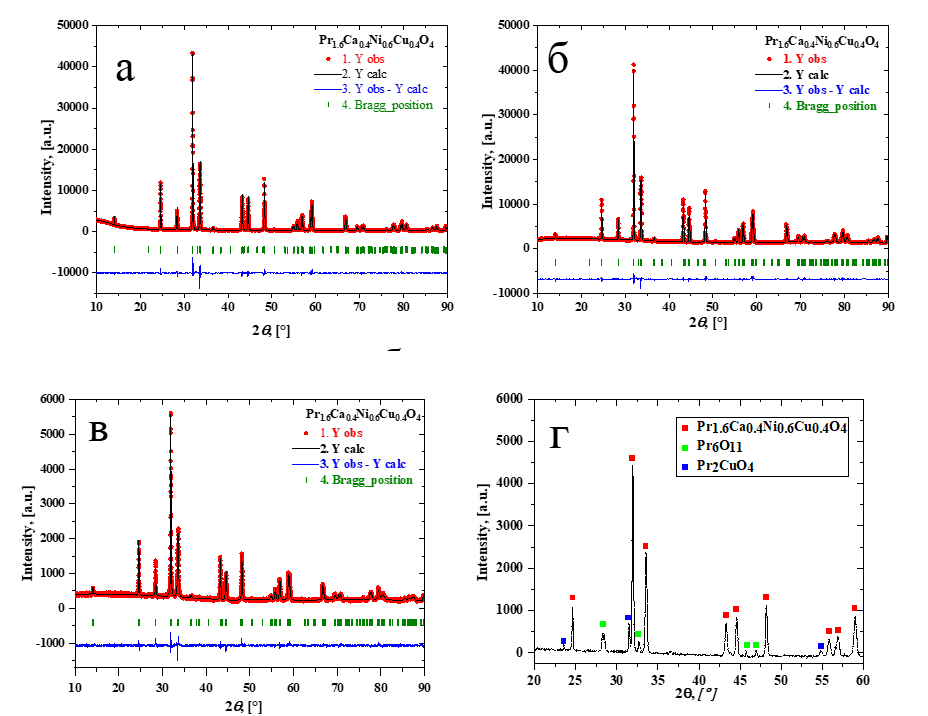
Рисунок 1 - Экспериментальные и расчетные профили рентгенограмм Pr1.6Cа0.4Ni0.6Cu0.4O4
Примечание: органический компонент: а – поливиниловый спирт; б – лимонная кислота; в – глицин; г – глицерин
Таким образом, при варьировании состава нитрат-органических прекурсоров при синтезе снижается требуемая температура отжига порошковых материалов Pr1.6Cа0.4Ni0.6Cu0.4O4, что, в свою очередь, влияет на гранулометрический состав и удельную поверхность
, , и, следовательно, может оказывать влияние на микроструктуру и электрохимическую активность электродов на их основе.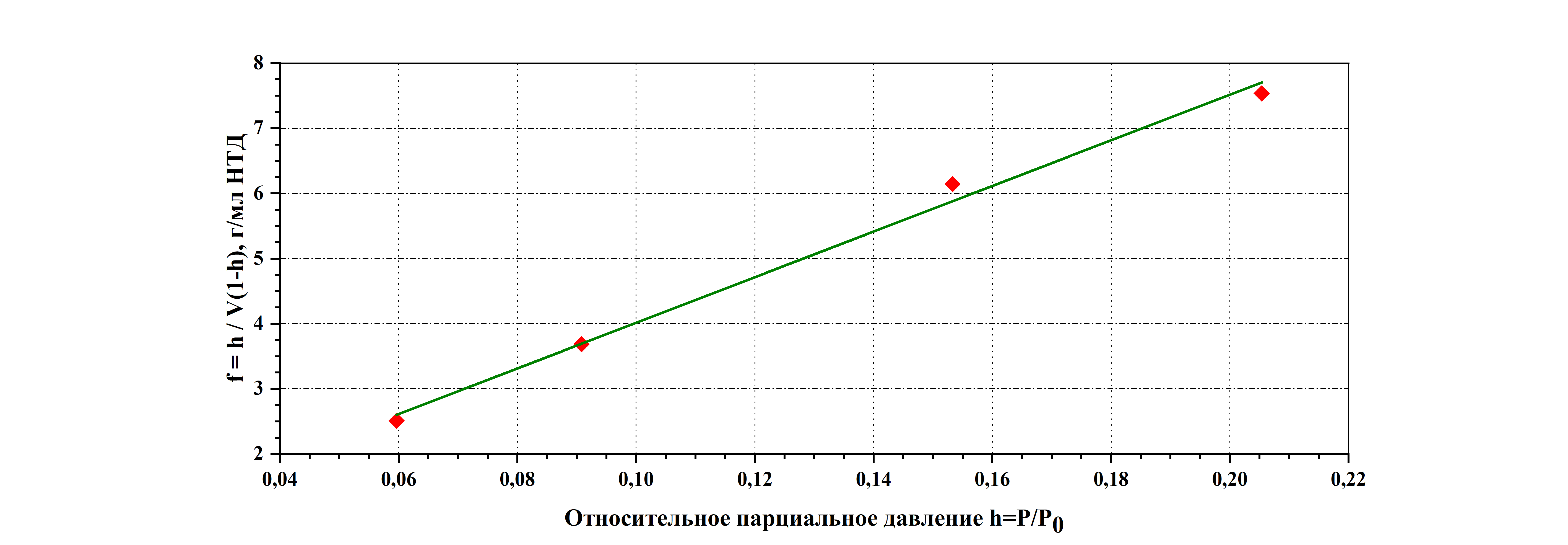
Рисунок 2 - Линейное уравнение БЭТ для образца Pr1.6Cа0.4Ni0.6Cu0.4O4
Для дальнейших исследований были выбраны образцы с наиболее высокими значениями удельной поверхности, так как являются наиболее перспективными для использования в качестве катодного материала.
На рисунке 3 и 4 представлены аррениусовские зависимости поляризационной проводимости (1/Rp, Oм·cм2) и контактной проводимости, рассчитанной из электрохимических спектров катодов Pr1.6Cа0.4Ni0.6Cu0.4O4, контактирующих с электролитом SDC, по формуле:
где L – толщина подложки SDC, S – площадь электрода. Значение Rhf получено из пересечения высокочастотной части спектра и включает в себя омическое сопротивление электролитной подложки, контакта электрод-электролит и электродов .
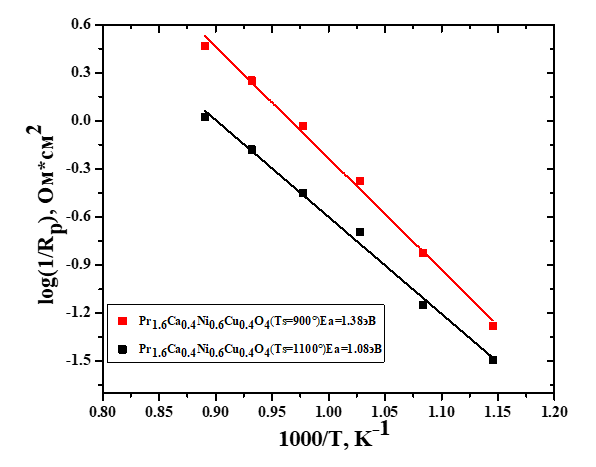
Рисунок 3 - Температурные зависимости поляризационной проводимости электродов Pr1.6Cа0.4Ni0.6Cu0.4O4, синтезированных из нитрат-органических прекурсоров, содержащих глицин (черные квадраты) или лимонную кислоту (красные квадраты)
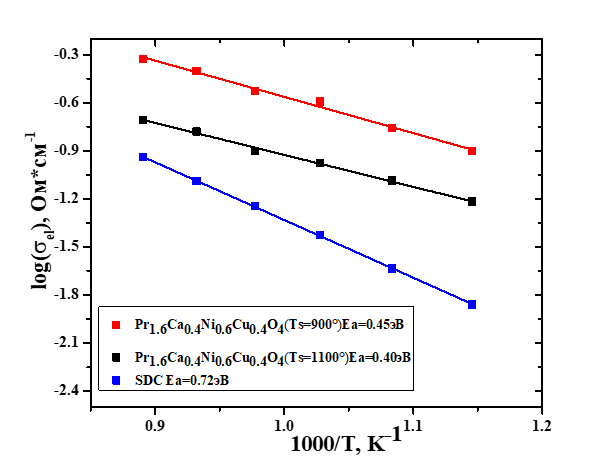
Рисунок 4 - Температурные зависимости электропроводности электролитной подложки SDC для электродов Pr1.6Cа0.4Ni0.6Cu0.4O4
Значения Rp и Еа для катодных материалов Pr1.6Cа0.4Ni0.6Cu0.4O4, синтезированных из композиций, содержащих лимонную кислоту или глицин, приведены в таблице 1. Также в таблице 1 приведены литературные данные, полученные для родственных материалов со структурой Раддлесдена-Поппера, таких как Nd1.6Cа0.4Ni0.6Cu0.4O4
и La1.7Cа0.3Ni0.6Cu0.4O4 . Сопротивление поляризации для катода, полученного из порошка, синтезированного в настоящей работе с лимонной кислотой в качестве органического компонента, принимает самые низкие значения среди подобных электродов. Следовательно, однослойные электроды Pr1.6Cа0.4Ni0.6Cu0.4O4, полученные из прекурсоров, содержащих лимонную кислоту, могут быть рекомендованы для применения в качестве перспективных катодов ТОТЭ.Таблица 1 - Параметры электродных слоев сложнооксидных материалов
Электрод | Температурный диапазон, ºС | Rp, Ом*см2 | Ea, эВ | Источник |
La1.7Cа0.3Ni0.6Cu0.4O4 | 700-850 | 8,10–1,95 | 1,38 | |
Nd1.6Cа0.4Ni0.6Cu0.4O4 | 700-850 | 5,70–1,28 | 1,17 | |
Pr1.6Cа0.4Ni0.6Cu0.4O4 (Ts=900ºС) | 700-850 | 2,37–0,34 | 1,38 | Настоящая работа |
Pr1.6Cа0.4Ni0.6Cu0.4O4 (Ts=1100ºС) | 700-850 | 4,93–0,95 | 1,08 |
4. Заключение
Было показано, что тип используемого при синтезе органического компонента, влияет как на конечную температуру синтеза, фазовый состав, удельную поверхность, так и на электрохимические характеристики сложного оксида Pr1.6Cа0.4Ni0.6Cu0.4O4. Увеличение удельной поверхности порошка приводит к снижению поляризационного сопротивления в ячейке. Наименьшее значение было получено для электрода, изготовленного из порошка Pr1.6Cа0.4Ni0.6Cu0.4O4, синтезированного путем сжигания цитрат-нитратного раствора (Rp = 0,34 Ом·см2 при 850 °C), что является оптимальным значением с точки зрения практического использования катодного материала в электрохимических устройствах, таких как ТОТЭ и электролизеры.
