ПРИМЕНЕНИЕ 3D-МОДЕЛИРОВАНИЯ И ВИЗУАЛИЗАЦИИ ПРИ АНАЛИЗЕ ЭЛЕКТРИЧЕСКОЙ АКТИВНОСТИ СЕРДЦА С УЧЕТОМ ИНДИВИДУАЛЬНЫХ ПАРАМЕТРОВ ОТВЕДЕНИЙ ЭКГ
ПРИМЕНЕНИЕ 3D-МОДЕЛИРОВАНИЯ И ВИЗУАЛИЗАЦИИ ПРИ АНАЛИЗЕ ЭЛЕКТРИЧЕСКОЙ АКТИВНОСТИ СЕРДЦА С УЧЕТОМ ИНДИВИДУАЛЬНЫХ ПАРАМЕТРОВ ОТВЕДЕНИЙ ЭКГ
Аннотация
При кратковременных сменах географических регионов и в условиях климатических изменений человек проходит климатическую адаптацию. Ее важным фактором является нормализация сердечной деятельности. Для мониторинга этого процесса необходим периодический объективный контроль работы сердца. Испытанным инструментом такого контроля является электрокардиография. Ее результаты используются для получения представления об электрической активности сердца. Одна из моделей электрической активности позволяет по известному потенциалу в точке на поверхности тела (отведении) и геометрическим характеристикам модели грудной клетки пациента найти значения дипольных моментов – электрических характеристик участков поверхности сердца. Электрическое поле диполя распространяется через различные ткани внутренних органов, которые имеют разное электрическое сопротивление. Для более точного определения электрических характеристик сердца необходимо сопротивление тела между диполем и отведением представлять суммой сопротивлений тканей. Для этого нужно знать геометрические размеры участков тканей реального пациента. Предлагается настраиваемая на пациента трехмерная компьютерная модель грудной клетки и ее органов, в том числе, сердца. Путь между отведением и диполем моделируется пространственным вектором отведения, координаты точек пересечения которого с органами грудной клетки фиксируются. По полученным координатам рассчитываются размеры участков различных тканей. Для моделирования и вычислений использованы среда разработки, рендеринга и анимации Blender, среда разработки программного обеспечения Microsoft Visual Studio 2022, визуализатор Unity 2021.3.11f1. Тестирование показало удовлетворительное совпадение результатов моделирования с данными тестовых параметров. Полученные результаты могут служить основой для создания современных методов и средств персонализированной диагностики состояния сердца, как в условиях климатической адаптации, так и в других условиях.
1. Введение
Регионы нашей планеты значительно различаются по климатическим условиям. Можно наблюдать большие перепады температуры, влажности, длины светового дня в полярных и экваториальных областях, перепады давления в горных и низменных областях. В результате приезжающие в тот или иной регион на короткое время вынуждены проходить климатическую адаптацию. Это касается бизнесменов в деловых поездках, спортсменов на соревнованиях, артистов на гастролях, участников туристических туров, отдыхающих в учреждениях здравоохранения, рабочих, привлекаемых к работе вахтово-экспедиционным методом. Успешная адаптация особенно важна, если человек после переезда должен быстро перейти к большим физическим нагрузкам (спортсмены, военнослужащие, рабочие). Существуют и группы риска, например, пожилые и нездоровые люди, для которых просто переезд в другой регион создает проблемы акклиматизации. Климатическая адаптация важна не только при кратковременных сменах географических регионов, но и в условиях наблюдаемого изменения климата Земли.
Важнейшим фактором климатической адаптации является нормализация сердечной деятельности. Для организации этого процесса необходим периодический объективный контроль работы сердца. Проблемы и методики контроля сердечной деятельности в экстремальных ситуациях, в том числе, при акклиматизации, давно находятся в сфере внимания ученых всего мира. Так, в работе описано влияние на сердечно-сосудистые заболевания загрязнения воздуха, экстремальных температур и различных суровых погодных явлений. В статье опубликованы материалы 53 авторов по сердечно-сосудистым причинам смерти в 567 городах 27 стран на 5 континентах в перекрывающиеся периоды с 1979 по 2019 год. Избыточная смертность рассчитана для дней с экстремальными температурами. Влиянию температуры окружающей среды на здоровье сердечно-сосудистой системы уделяется особенно много внимания. Об этом говорят публикации ученых из Китая (на материале из 272 двух городов) , Канады , Испании , Финляндии (по результатам обследования с 2000 по 2018 год 363 754 участников, проживающих в шести городах Финляндии) , США и многих других стран.
Испытанным инструментом контроля сердечной деятельности, в том числе, в период климатической адаптации, является электрокардиография (ЭКГ). Она, как известно, заключается в снятии с поверхности грудной клетки электрических потенциалов, отражающих работу сердца. Практикой электрокардиографии на поверхности грудной клетки человека определены точки съема потенциала (точки отведений). Последовательный съем потенциала в отведениях позволяет получить информацию об электрической активности областей сердца. Статья посвящена повышению точности этой информации.
2. Методы и принципы исследования
Для получения более точного представления об электрической активности сердца специалисты применяют математические модели, которые описывают электрические процессы, происходящие непосредственно на поверхности сердца. Исходными данными для этого являются значения потенциалов в отведениях. Одной из таких моделей является многодипольная модель, предложенная Л.И. Титомиром и описанная в монографии . В качестве эквивалентной модели электрического генератора сердца здесь используется набор областей электрической активности поверхности сердца – диполей. Электрическая активность диполей формирует наблюдаемые на поверхности тела потенциалы в соответствии с формулой:
где φj(t) – электрический потенциал в j-й точке измерения на поверхности тела (j=1...N), В;
ρ – усредненное удельное сопротивление тела, Ом⸳м;
αji – угол, образованный вектором i-го дипольного момента и линией между j-й точкой отведения и i-м диполем модели;
rji – расстояние между i-м диполем и j-й точкой отведений, м;
Di(t) – дипольный момент i-го диполя модели в момент времени t (i = 1...I), А⸳м;
I – число диполей модели;
N – число отведений.
Используя указанное соотношение, нужно решить обратную задачу – по известному потенциалу в отведении и геометрическим характеристикам модели найти значение дипольного момента.
Приведенное математическое соотношение использует усредненное по телу человека значение удельного сопротивления r, хотя реальный «путь», соединяющий диполь с отведением, проходит через различные ткани (внутренние органы, кости и т.д.), каждая из которых имеет свое удельное сопротивление. Это означает, что сопротивление тела между диполем и отведением ЭКГ на поверхности тела нужно представлять суммой сопротивлений тканей. Провести измерения участков различных тканей для реального пациента весьма затруднительно, что во многом и ограничивает потенциал применения подобных математически моделей на практике.
Для определения геометрических параметров модели и нахождения электрических характеристик тканей грудной клетки предлагается использовать настраиваемую на пациента трехмерную модель грудной клетки и ее органов. Средствами компьютерного 3D-моделирования создается обобщенная модель грудной клетки с внутренними органами, в том числе, создается полигональная модель сердца. Построение моделей возможно с помощью интерполяционных методов, например, как это описано в , можно также использовать готовые модели из сети Интернет. На модели сердца по результатам кардиологических исследований определяются области, электрическая активность которых представляется соответствующими диполями, привязанными к координатам на поверхности сердца. Геометрия грудной клетки и сердца на модели настраивается на параметры конкретного человека с помощью антропометрии и результатов объективного исследования (УЗИ, МРТ, флюорография). На поверхности смоделированной грудной клетки определяются места стандартных отведений ЭКГ. Полученные данные заносятся в базу данных компьютера для многократного использования. В процессе исследования с помощью инструментов 3D-моделирования через отведение и центр диполя проводится вектор, который представляет прохождение электрического потенциала участка сердца к отведению . Этот вектор (вектор отведения) проходит через различные ткани – реберные кости, легкие, мышцы, жировые прослойки, кожу. Эти ткани имеют различное удельное электрическое сопротивление, которое известно для каждого вида ткани. Длина отрезка вектора, проходящего через каждую ткань, измеряется на модели. На основе известных данных с помощью специализированного программного обеспечения рассчитывается электрическое сопротивление участков тканей, а также суммарное сопротивление в направлении вектора отведения. В статье представлены результаты разработки и применения 3D-модели грудной клетки и внутренних органов, а также программы для управления геометрией модели и работы с векторами отведений.
3. Основные результаты
Для моделирования грудной клетки человека и находящихся в ней объектов использовалась среда Blender – свободно распространяемая среда разработки, рендеринга и анимации, являющаяся на данный момент одним из самых популярных и эффективных инструментов геометрического моделирования . Геометрические модели, созданные в Blender, могут присоединяться к программам визуализации, например, к Unity . Примеры внешней оболочки торса человека и входящих в него объектов приведены на рисунке 1.
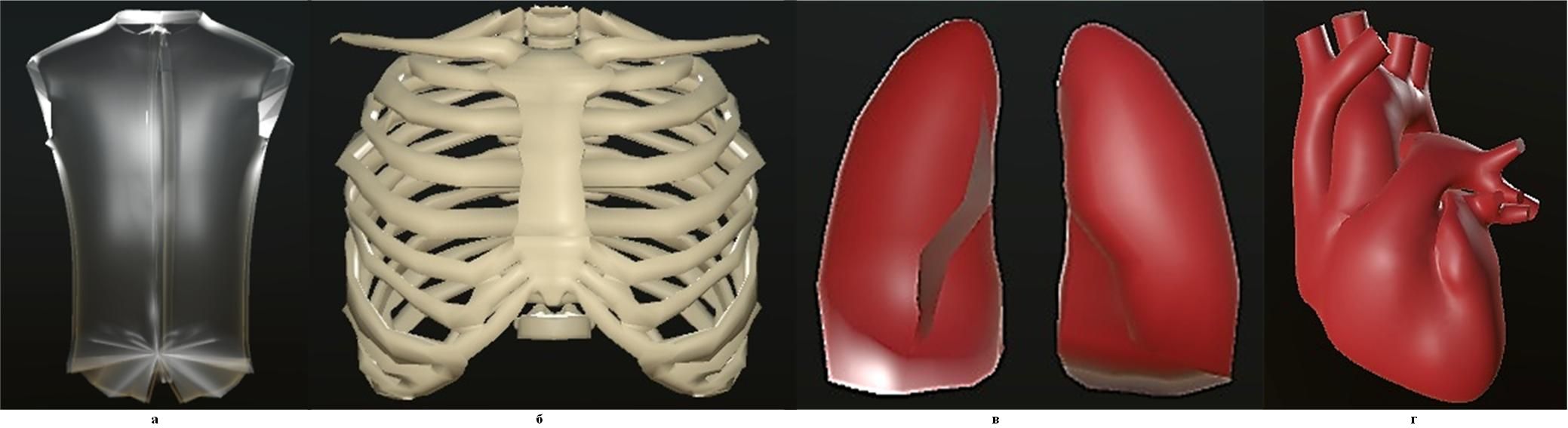
Рисунок 1 - 3D-модели двух слоев торса, костей грудной клетки, легких и сердца
Средствами программы пользователь может масштабировать модель вдоль трех координатных осей пространства, настраивая ее на геометрию реального пациента. В программе реализованы такие возможности визуализации, как свободный обзор модели (поворот, приближение и отдаление), просмотр модели в каркасном виде, удаление отдельных частей объектов для более детального рассмотрения остальных, возможность скрыть пользовательский интерфейс для расширения поля отображения модели. Управление визуализацией осуществляется с помощью «горячих» клавиш, кнопок интерфейса и манипулятора «мышь». Для более удобного представления изображения на языке программирования C# создан скрипт, вращающий камеру вокруг 3D-модели.
Основной геометрической задачей программы является поиск точек пересечения векторов отведений ЭКГ с объектами грудной клетки. Для решения этой задачи в 3D-модель каждого органа добавлен коллайдер – физическая оболочка объекта. В качестве входных данных вектора отведения задаются значения декартовых координат двух пространственных точек А и В – начала и конца вектора. Далее с применением методов встроенных библиотек Unity создается луч. При пересечении этого луча с каким-либо физическим объектом программа выдает данные о пересечении: координаты и имя объекта, который оказался на пути луча. При создании луча, идущего из точки А в точку В, находятся координаты его входа в объекты. Поменяв точки местами, получают координаты выхода луча из объектов. Разность координат дает расстояние, которое прошел луч внутри объекта, т.е. толщину ткани. Исходные данные и результат их обработки отображаются на панели интерфейса. Вид интерфейса программы показан на рисунке 2.
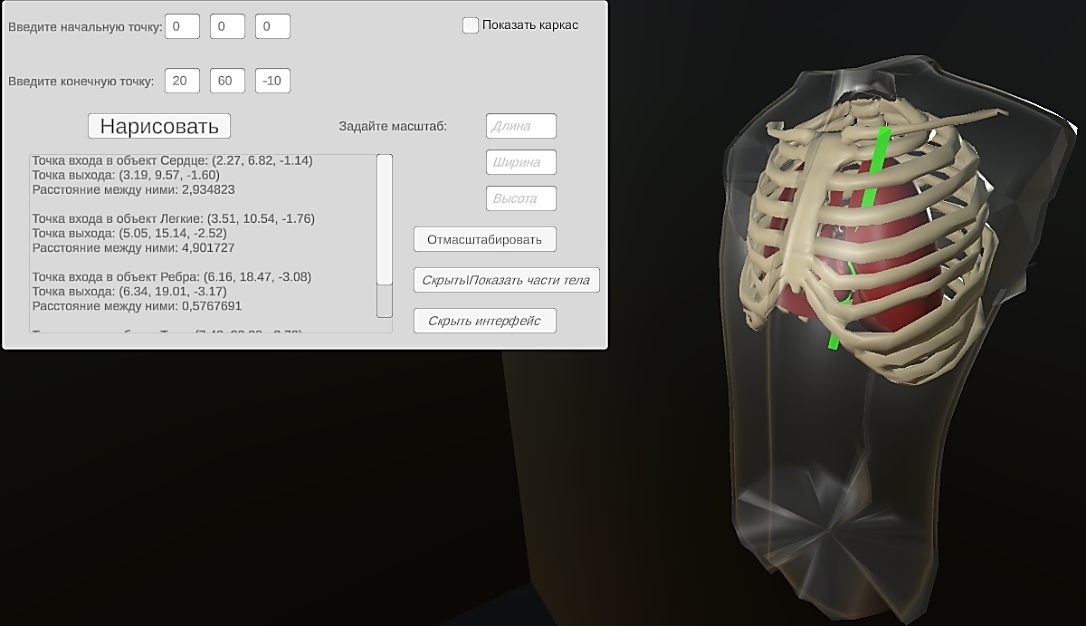
Рисунок 2 - Внешний вид интерфейса программы
4. Обсуждение
С помощью тестовых примеров определялось соответствие заданным параметрам направлений векторов отведений (лучей), точек их входа в объекты и выхода из них, расстояний, пройденных векторами внутри объектов грудной клетки, соблюдения физических закономерностей взаимного расположения трехмерных объектов (их загораживания), наглядности отображения сцены. Вид грудной клетки с различным прохождением векторов (показаны зеленым цветом) приведен на рисунке 3.
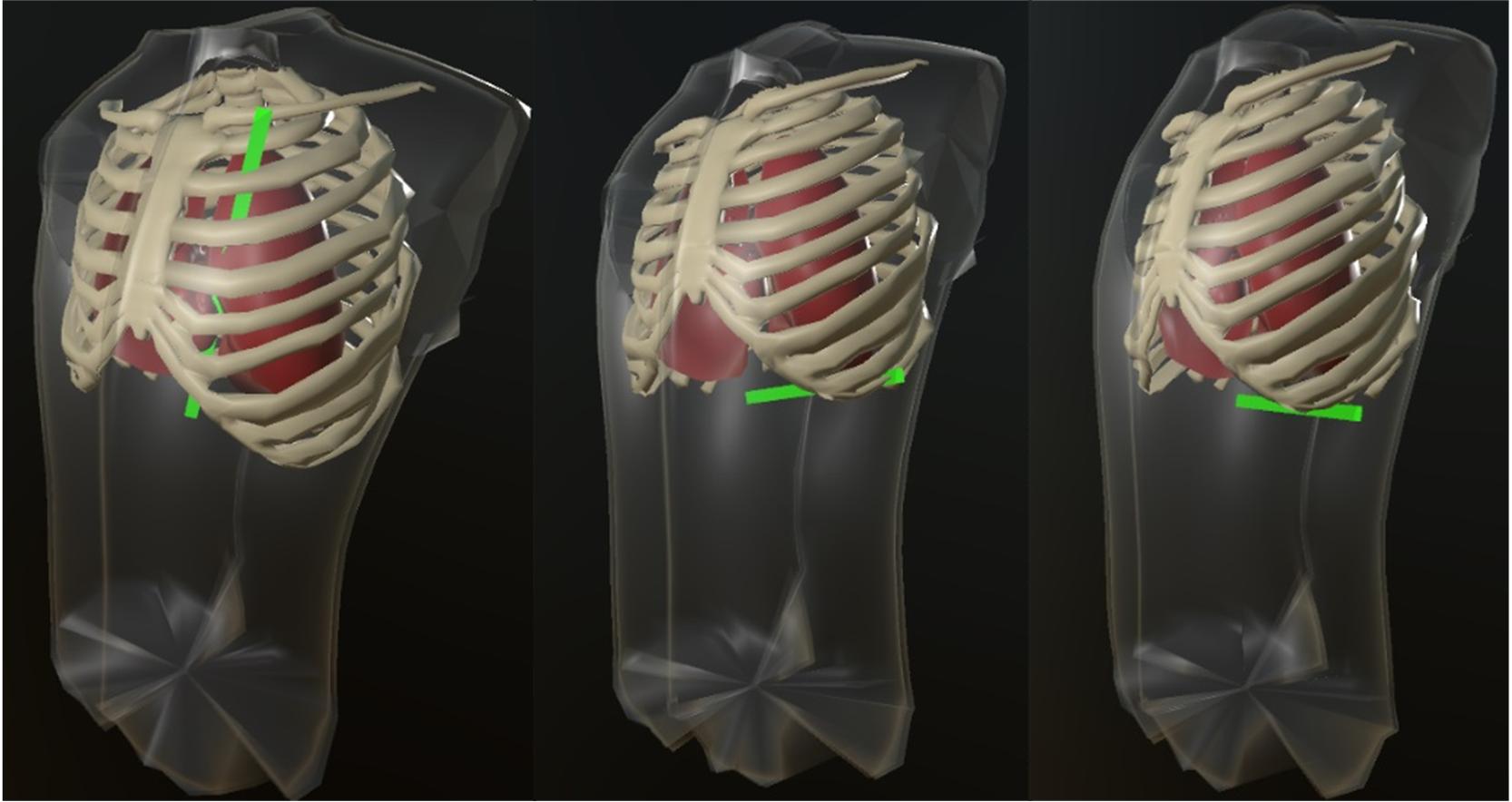
Рисунок 3 - Тестовое прохождение вектора
Таблица 1 - Набор тестовых данных и результат его использования
Объект | Расстояние, м | Удельное сопротивление Ом⸳м | Сопротивление объекта, Ом |
1. Торс | 0,42E-2 | 14,1 (мышцы) | 0,059 |
2. Кожа | 0,01Е-2 | 2,04 (кожа) | 0,0002 |
3. Ребра | 0,58E-2 | 15,6 (кость кортикальная) | 0,09 |
4. Легкие | 4,9E-2 | 3,3 (легкое раздутое) | 0,16 |
5. Сердце | 2,9E-2 | 1,4 (сердечная мышца) | 0,04 |
Итого | - | - | 0,349 |
Значения сопротивлений объектов вычислены путем умножения расстояния, пройденного вектором отведения внутри объекта (органа), на удельное сопротивление ткани органа. Удельные сопротивления тканей человека взяты из источника . Анализ показал удовлетворительное совпадение результатов моделирования с заданными значениями тестовых параметров.
5. Заключение
Созданные в ходе исследования модели и программное обеспечение являются полезными деталями для будущих исследований и могут служить основой для создания современных методов и средств персонализированной диагностики состояния сердца, как в условиях климатической адаптации, так и в других условиях. Развитие модели грудной клетки, повышение ее реалистичности, а также модернизация программного обеспечения – шаги, которые позволят получить больше важных для исследований данных о работе сердца на основе неинвазивного электрокардиографического метода исследования.
Дальнейшее развитие работы предполагается в двух направлениях. Первое направление – модернизация системы масштабирования модели грудной клетки с целью автоматизации настройки модели на конкретного пациента. Второе направление – совершенствование интерфейса программы с целью расширения получаемых данных, в частности, прямого вывода на экран сопротивлений органов на пути прохождения вектора отведения. Кроме того, предполагается упростить задание точек отведений, наложив на поверхность торса заранее сформированную визуальную маску отведений, что позволит оптимизировать работу пользователя. Применение разработанной программы позволяет выполнить индивидуальный расчет сопротивления для каждого вектора отведения. В этом случае программное обеспечение может стать компонентом систем мониторинга ЭКГ с анализом и корректировкой изменений биоимпеданса, что является отдельной темой для исследования.
