FOAM FORMING ACTIVITY OF SACCHAROMYCES CEREVISIAE AS A NEW TEST-REACTION FOR BIOTESTING OF SALT OF HEAVY METALS
Вятчина О.Ф.1, Жданова Г.О.2, Стом Д.И.3, Толстой М.Ю.4
1ORCID: 0000-0002-2205-1971, кандидат биологических наук, доцент
Иркутский государственный университет, г. Иркутск
2ORCID: 0000-0002-8355-9517, младший научный сотрудник
НИИ биологии, Иркутский государственный университет, г. Иркутск
3ORCID: 0000-0001-9496-2961, доктор биологических наук, профессор
Иркутский государственный университет, г. Иркутск
Иркутский национальный исследовательский технический университет, г. Иркутск, Байкальский музей ИНЦ СО РАН, г. Иркутск
4ORCID: 0000-0002-1573-060X, кандидат технических наук, профессор
Иркутский национальный исследовательский технический университет, г. Иркутск
Работа выполнена при финансовой поддержке грантов РФФИ р_а № 16-48-030887, № 16-48-030881.
ПЕНООБРАЗУЮЩАЯ АКТИВНОСТЬ SACCHAROMYCES CEREVISIAE КАК НОВАЯ ТЕСТ-РЕАКЦИЯ ДЛЯ БИОТЕСТИРОВАНИЯ СОЛЕЙ ТЯЖЕЛЫХ МЕТАЛЛОВ
Аннотация
Для оценки токсичности солей тяжелых металлов предложена новая тест-реакция, основанная на определении пенообразующей активности Saccharomyces cerevisiae. Показано, что разработанный биотест позволяет обнаруживать хлорид ртути в концентрации 0,0001, сульфат меди, хлорид кадмия, хлорид кобальта – 0,001, сульфат свинца – 0,01, сульфат железа – 0,1, сульфат цинка – 1 г/л. Результаты тестирования сопоставлены с данными, полученными при использовании методов по выживаемости Paramecium caudatum, подавлению люминесценции Photobacterium phosphoreum, прорастанию семян Raphanus sativus, входящих в государственный реестр токсикологических методов контроля природных сред. Составлены ряды токсичности исследуемых солей тяжелых металлов по отношению к используемым тест-объектам. Отличительной особенностью нового биотеста с использованием S. cerevisiae является экспрессность (время тест-отклика 15 мин), отсутствие необходимости в поддержании и выращивании тест-объекта (используется препарат сухих дрожжей), техническая простота исполнения, экономичность, хорошая воспроизводимость.
Ключевые слова: биотестирование, тяжелые металлы, Saccharomyces cerevisiae, пенообразование.
Vyatchina O.F.1, Zhdanova G.O.2, Stom D.I.3, Tolstoy М.Yu.4
1ORCID: 0000-0002-2205-1971, PhD in Biology, Associate professor
Irkutsk State University, Irkutsk
2ORCID: 0000-0002-8355-9517, junior researcher
Research Institute of Biology, Irkutsk State University, Irkutsk
3ORCID: 0000-0001-9496-2961, PhD in Biology, professor
Irkutsk State University, Irkutsk
Irkutsk National Research Technical University, Irkutsk
Baikal Museum of the INC SB RAS, Irkutsk
4ORCID: 0000-0002-1573-060X, PhD in Engineering, professor
Irkutsk National Research Technical University, Irkutsk
FOAM FORMING ACTIVITY OF SACCHAROMYCES CEREVISIAE AS A NEW TEST-REACTION FOR BIOTESTING OF SALT OF HEAVY METALS
Abstract
In order to estimate the toxicity of salts of heavy metals, a new test-reaction based on the determination of the foam forming activity of Saccharomyces cerevisiae is proposed in the paper. It is shown that the developed biotest allows to detect mercury chloride in the concentration of 0.0001, copper sulfate, cadmium chloride and cobalt chloride – 0.001, lead sulfate – 0.01, iron sulfate – 0.1, zinc sulfate – 1 g/l. The results of the testing are compared with the data obtained with the help of methods on survival rate of Paramecium caudatum, inhibition of photobacterium phosphoreum luminescence, and the germination of Raphanus sativus seeds included in the state register of toxicological methods for control of environmental media. The author also made up the series of toxicity of the investigated salts of heavy metal with respect to the test objects used is compiled. A distinctive feature of the new bio-test with the use of S. cerevisiae is the expressness (test response time of 15 min), no need to maintain and grow the test object (a dry yeast sample is used), technical simplicity of implementation, cost effectiveness, good reproducibility.
Keywords: biotesting, heavy metals, Saccharomyces cerevisiae, foaming.
Для выявления токсичности тяжелых металлов широко используют методы биотестирования [1, 2, 3]. Среди применяемых в качестве тест-объектов эукариотических микроорганизмов большое внимание привлекают дрожжи S. cerevisiae [4, 5, 6]. Большинство из известных методов биотестирования с использованием дрожжей достаточно трудоемки, требуют специального оборудования. Ранее нами был предложен биотест, основанный на способности пекарских дрожжей S. cerevisiae, как дрожжей верхового брожения, образовывать пену на поверхности сбраживаемой жидкости [7, 8]. Цель данной работы заключалась в проверке возможности использования предложенной тест-реакции для оценки токсичности ряда солей тяжелых металлов.
Для определения токсичности солей тяжелых металлов в эксперименте применяли препарат сухих пекарских дрожжей «Саф-Момент» (ООО «Саф-Нева», Россия). Тест-объектами также являлись люминесцирующие бактерии Photobacterium phosphoreum (штамм 1883), инфузории Paramecium caudatum, семена редиса Raphanus sativus (сорт «Красный великан», ЗАО «Иркутские семена»). Использовали соли тяжелых металлов (хч): HgCl2, CdCl2, CoCl2, CuSO4, Pb(CH3COO), Fe2(SO4)3, ZnSO4.
Токсичность исследуемых солей тяжелых металлов оценивали по изменению пенообразующей активности S. cerevisiae [7]. Для этого в 20 мл раствора исследуемой соли тяжелого металла вносили 1,36 г сухих дрожжей, тщательно перемешивали и добавляли 0,4 г глюкозы. Приготовленную реакционную смесь разливали по 3 мл в мерные пробирки объемом 10 мл, инкубировали в течение 15 мин при +20 ºС, затем определяли объем образовавшейся пены. Контролем служила суспензия дрожжей с глюкозой без внесения солей тяжелых металлов.
Токсичность солей тяжелых металлов оценивали также по выживаемости инфузорий P. caudatum [9], гашению люминесценции светящихся бактерий Ph. phosphoreum [10], прорастанию семян редиса R. sativus [11].
Все эксперименты проводили не менее чем в 5 независимых опытах с 3-6 параллельными измерениями в каждом. Для статистической обработки полученных данных использовали пакет программ Microsoft Exсel. Выводы сделаны с вероятностью безошибочного прогноза Р ≥ 0,95. Достоверность различия результатов определяли с помощью критерия Стьюдента.
Проведенные исследования показали, что наибольшее токсическое действие на процесс пенообразования в суспензии S. cerevisiae оказывал хлорид ртути. В присутствии 0,0001 г/л этой соли объем образовавшейся пены в течение 15 мин (время тест-отклика) был на 56,3 % меньше, чем в контроле (рис. 1).
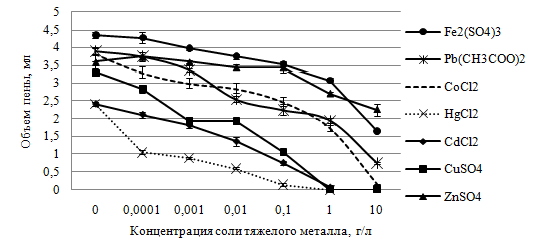
Рис. 1 – Влияние солей тяжелых металлов на интенсивность пенообразования в суспензии дрожжей с глюкозой
Токсический эффект сульфата меди, хлорида кадмия и хлорида кобальта по отношению к пенообразующей активности дрожжей отмечали при концентрации 0,001 г/л. При этом интенсивность пенообразования была на 41,4; 25,0 и 21,6 % ниже по сравнению с контролем, соответственно (см. рис. 1).
Токсическое действие ацетата свинца на активность S. cerevisiae проявлялось при более высокой концентрации – 0,01 г/л. В этом случае объем пены в суспензии дрожжей был на 34,6 % меньше, чем в контроле. Еще меньшей токсичностью по отношению к исследуемой тест-функции S. cerevisiae отличались сульфат железа и сульфат цинка, которые начинали подавлять пенообразование в дрожжевой суспензии при содержании 0,1 и 1 г/л, соответственно. Объем образовавшейся пены в суспензиях с этими солями был на 19,5 и 25,0 % меньше, чем в контроле, соответственно (см. рис. 1).
Полученные данные сравнивали с результатами биотестирования исследуемых солей тяжелых металлов при помощи методов, входящих в государственный реестр токсикологических методов контроля.
Хлорид ртути, сульфат меди и ацетат свинца вызывали гашение биолюминесценции Ph. phosphoreum при концентрации 0,0001 г/л. Наибольшей токсичностью отличался хлорид ртути, который при указанном содержании полностью подавлял эту тест-функцию. Сульфат меди при данной концентрации снижал интенсивность свечения на 78,0 %, ацетат свинца – на 35,0 % по сравнению с контролем, соответственно (рис. 2).
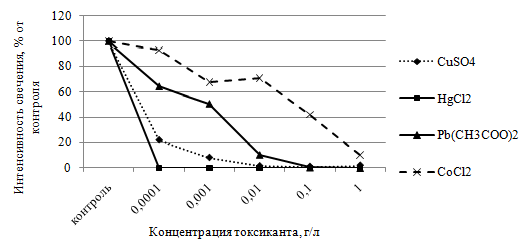
Рис. 2 – Влияние исследуемых солей тяжелых металлов на интенсивность свечения бактерий Ph. phosphoreum
Хлорид кобальта в меньшей степени оказывал влияние на люминесценцию Ph. phosphoreum. Достоверное снижение интенсивности свечения (на 32 % относительно контроля) отмечали в присутствии 0,001 г/л этой соли тяжелого металла (см. рис. 2).
По отношению к P. caudatum токсический эффект хлорида ртути, сульфата меди, хлорида кобальта, хлорида кадмия, ацетата свинца и сульфата железа отмечали при концентрации 0,0001 г/л. Гибель инфузорий при этом составляла 49,8; 28,9; 24,0; 19,6; 20,8 и 17,7 %, соответственно. Сульфат цинка оказывал токсическое действие в концентрации 0,01 г/л, вызывая отмирание 56,3 % особей P. caudatum (см. рис. 3).
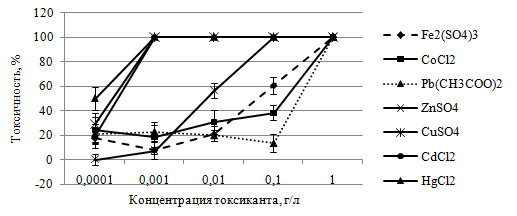
Рис. 3 – Влияние исследуемых солей тяжелых металлов на выживаемость инфузорий P. caudatum
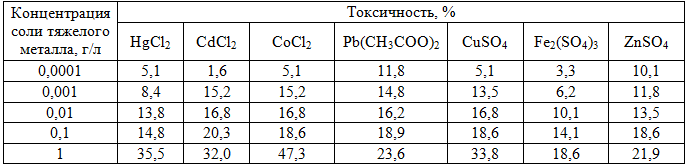
Метод биотестирования по прорастанию семян редиса R. sativus оказался менее чувствительным к тестируемым солям тяжелых металлов. Хлорид кадмия оказывал токсическое воздействие на эту тест-функцию в концентрации 0,1 г/л, хлорид ртути, хлорид кобальта, сульфат меди, ацетат свинца и сульфат цинка – 1 г/л. Сульфат железа в диапазоне концентраций от 0,0001 до 1 г/л в условиях нашего опыта не вызывал фитотоксического эффекта (табл. 1).
Таблица 1 - Влияние исследуемых солей тяжелых металлов на прорастание семян редиса R. sativus
По чувствительности к исследуемым солям тяжелых металлов биотест по подавлению пенообразующей активности S. cerevisiae занимает следующее положение в ряду испытанных биометодов (биотесты располагаются по уменьшению степени чувствительности): выживаемость инфузорий P. caudatum, биолюминесценция Ph. phosphoreum > пенообразующая активность S. cerevisiae > прорастание семян редиса R. sativus. При этом ряды токсичности солей тяжелых металлов были достаточно близки: выживаемость инфузорий P. caudatum – HgCl2 > CuSO4 > CdCl2 > CoCl2 > Fe2(SO4)3 > Pb(CH3COO)2 > ZnSO4; биолюминесценция Ph. phosphoreum – HgCl2 > CuSO4 > Pb(CH3COO)2 > CoCl2; пенообразующая активность S. cerevisiae – HgCl2 > CuSO4 > CdCl2 > CoCl2 > Pb(CH3COO)2 > Fe2(SO4)3 > ZnSO4; прорастание семян редиса R. sativus – CdCl2 > CoCl2 > HgCl2, CuSO4 > Pb(CH3COO)2, ZnSO4 > Fe2(SO4)3. Полученные ряды токсичности солей тяжелых металлов в основном, совпадают с имеющимися в литературе данными [12, 13].
Важным преимуществом предлагаемого теста с использованием S. cerevisiae является его экспрессность. Время тест-отклика составляет 15 мин, в то время как для биотестирования по выживаемости P. caudatum требуется 24 ч, гашению люминесценции P. phosphoreum (включая время подготовки питательных сред и выращивания культуры) – не менее 24 ч, по прорастанию семян R. sativus – до 3 сут. Кроме того, предложенный биотест отличается технической простотой исполнения, хорошей воспроизводимостью и экономичностью – он не требует использования дорогостоящих сред и оборудования, поддержания и выращивания культуры (используются коммерческие препараты сухих дрожжей).
Список литературы / References
- Ranjitha P. Detection of heavy metal resistance bioluminescence bacteria using microplate bioassay method / P. Ranjitha, E. S. Karthy // J Environ Sci Eng. – 2012. – Vol. 54(1). – P. 43–49.
- Baran А. Assessment of heavy metals mobility and toxicity in contaminated sediments by sequential extraction and a battery of bioassays / А. Baran, M. Tarnawski // Ecotoxicology. – 2015. – Vol. 24(6). – P. 1279–1293.
- Singh R. Heavy metals and living systems / R. Singh, N. Gautam, A. Mishra et al. // An overview Indian J. Pharmacol. – 2011. – Vol. 43(3). – P. 246–253.
- Dragone R. Diuron in Water: Functional Toxicity and Intracellular Detoxification Patterns of Active Concentrations Assayed in Tandem by a Yeast-Based Probe / R. Dragone, R. Cheng, G. Grasso et al. // Int. J. Environ. Res. Public Health. – 2015. – Vol. 12. – P. 3731–3740.
- Dolezalova J. A new biological test of water toxicity-yeast Saccharomyces cerevisiae conductometric test / Dolezalova, L. Rumlova // Environ Toxicol Pharmacol. – 2014. – 38(3). – P. 977–981.
- Bao S. Assessment of the Toxicity of CuO Nanoparticles by Using Saccharomyces cerevisiae Mutants with Multiple Genes Deleted. / S. Bao, Q. Lu, T. Fang et al. // Environ. Microbiol. – 2015. – Vol. 81, no. 23. – P. 8098–8107.
- Вятчина О. Ф. Экспрессный приём биологического анализа качества вод с помощью сахаромицетов / О. Ф. Вятчина, Г. О. Жданова, Д. И. Стом // Естественные науки. – 2009. – № 4. – С. 133–136.
- Вятчина О. Ф. Оценка токсичности пестицидов с использованием Saccharomyces cerevisiae / О. Ф. Вятчина, Г. О. Жданова, Д. И. Стом и др. // В мире научных открытий. – 2015. – № 12.2 (72). – С. 397–409.
- ПНД Ф Т 14.1:2:3.13-06 Т 16.1:2.3:3.10-06. Методика определения токсичности отходов, почв, осадков сточных, поверхностных и грунтовых вод методом биотестирования с использованием равноресничных инфузорий Paramecium caudatum
- ПНД Ф Т 14.1:2:3:4.11-04. Т 16.1:2.3:3.8-04. – 2010. Методика определения интегральной токсичности поверхностных, в том числе морских, грунтовых, питьевых, сточных вод водных экстрактов почв, отходов, осадков сточных вод по изменению интенсивности бактериальной биолюминесценции тест-системой «Эколюм».
- ПНД Ф Т 14.1:2:4.19-2013. Методика определения токсичности питьевых, грунтовых, поверхностных и сточных вод, растворов химических веществ по измерению показателей всхожести, средней длины и среднего сухого веса проростков семян кресс-салата (Lepidium sativum).
- Лыгин С. А. Горох и фасоль – биоиндикаторы тяжелых металлов / С. А. Лыгин, Е. С. Пурина, Р. И. Лыгина // Естественные и математические науки в современном мире, Новосибирск: СибАК. – 2014. – № 7(19). – С. 70–75.
- Madoni P. Acute toxicity of heavy metals towards freshwater ciliated protists / P. Madoni, M. G. Romeo // Environmental Pollution. – 2006. – Vol. 141. – P. 1–7.
Список литературы на английском языке / References in English
- Ranjitha P. Detection of heavy metal resistance bioluminescence bacteria using microplate bioassay method / P. Ranjitha, E. S. Karthy // J Environ Sci Eng. – 2012. – Vol. 54(1). – P. 43–49.
- Baran А. Assessment of heavy metals mobility and toxicity in contaminated sediments by sequential extraction and a battery of bioassays / А. Baran, M. Tarnawski // Ecotoxicology. – 2015. – Vol. 24(6). – P. 1279–1293.
- Singh R. Heavy metals and living systems / R. Singh, N. Gautam, A. Mishra et al. // An overview Indian J. Pharmacol. – 2011. – Vol. 43(3). – P. 246–253.
- Dragone R. Diuron in Water: Functional Toxicity and Intracellular Detoxification Patterns of Active Concentrations Assayed in Tandem by a Yeast-Based Probe / R. Dragone, R. Cheng, G. Grasso et al. // Int. J. Environ. Res. Public Health. – 2015. – Vol. 12. – P. 3731–3740.
- Dolezalova J. A new biological test of water toxicity-yeast Saccharomyces cerevisiae conductometric test / Dolezalova, L. Rumlova // Environ Toxicol Pharmacol. – 2014. – 38(3). – P. 977–981.
- Bao S. Assessment of the Toxicity of CuO Nanoparticles by Using Saccharomyces cerevisiae Mutants with Multiple Genes Deleted. / S. Bao, Q. Lu, T. Fang et al. // Environ. Microbiol. – 2015. – Vol. 81, no. 23. – P. 8098–8107.
- Vjatchina O. F. Jekspressnyj prijom biologicheskogo analiza kachestva vod s pomoshh'ju saharomicetov [Express reception of biological analysis of water quality with the help of saccharomycetes] / O. F. Vjatchina, G. O. Zhdanova, D. I. Stom // Estestvennye nauki [Natural sciences]. – 2009. – № 4. – P. 133-136. [in Russian]
- Vjatchina O. F. Ocenka toksichnosti pesticidov s ispol'zovaniem Saccharomyces cerevisiae [Assessment of the toxicity of pesticides with using of Saccharomyces cerevisiae] / O. F. Vjatchina, G. O. Zhdanova, D. I. Stom // V mire nauchnyh otkrytij [In the world of scientific discoveries]. – 2015. – № 12.2 (72). – P. 397–409.
- PND F T 14.1:2:3.13-06 T 16.1:2.3:3.10-06. Metodika opredelenija toksichnosti othodov, pochv, osadkov stochnyh, poverhnostnyh i gruntovyh vod metodom biotestirovanija s ispol'zovaniem ravnoresnichnyh infuzorij Paramecium caudatum Ehrenberg [Method for determination of toxicity of waste, soil, sewage, surface and groundwater sediments by the method of biotesting using equispature infusoria Paramecium caudatum Ehrenberg]. [in Russian]
- PND F T 14.1:2:3:4.11-04. T 16.1:2.3:3.8-04. – 2010. Metodika opredelenija integral'noj toksichnosti poverhnostnyh, v tom chisle morskih, gruntovyh, pit'evyh, stochnyh vod vodnyh jekstraktov pochv, othodov, osadkov stochnyh vod po izmeneniju intensivnosti bakterial'noj bioljuminescencii test-sistemoj «Jekoljum». [Method for determining the integrated toxicity of surface, including marine, groundwater, drinking, sewage water extracts of soil, waste, sewage sludge by changing the intensity of bacterial bioluminescence test system «Ecolum»] [in Russian]
- PND F T 14.1:2:4.19-2013 Metodika opredelenija toksichnosti pit'evyh, gruntovyh, poverhnostnyh i stochnyh vod, rastvorov himicheskih veshhestv po izmereniju pokazatelej vshozhesti, srednej dliny i srednego suhogo vesa prorostkov semjan kress-salata (Lepidium sativum) [Method for determining the toxicity of drinking, ground, surface and sewage, chemical solutions by measuring the germination, average length and average dry weight of seedlings of cress-salad seeds (Lepidium sativum)] [in Russian]
- Lygin S. A. Goroh i fasol' – bioindikatory tjazhelyh metallov [Pea and beans – bioindicators of heavy metals] / S. A. Lygin, E. S. Purina, R. I. Lygina // Estestvennye i matematicheskie nauki v sovremennom mire [Natural and mathematical sciences in the modern world]. – № 7(19). – Novosibirsk: SibAK, 2014. – P. 70–75. [in Russian]
- Madoni P. Acute toxicity of heavy metals towards freshwater ciliated protists / P. Madoni, M. G. Romeo // Environmental Pollution. – 2006. – Vol. 141. – P. 1–7.
