КОНЦЕНТРАЦИЯ АНТИБИОТИКА ГЕНТАМИЦИНА В ОРГАНАХ И ТКАНЯХ КРОЛИКА ПРИ РАЗЛИЧНЫХ СПОСОБАХ ВВЕДЕНИЯ
Тер-Аветисьянц И.А.1, Семененко М.П.2, Кузьминова Е.В.3, Мирошниченко П.В.4
1ORCID: 0000-0001-8271-4418, Кандидат биологических наук, 2ORCID: 0000-0001-8266-5900, Доктор ветеринарных наук, 3ORCID: 0000-0003-4744-0823, Доктор ветеринарных наук, 4ORCID: 0000-0002-5835-1159, Кандидат ветеринарных наук, ФГБНУ Краснодарский научно-исследовательский ветеринарный институт
КОНЦЕНТРАЦИЯ АНТИБИОТИКА ГЕНТАМИЦИНА В ОРГАНАХ И ТКАНЯХ КРОЛИКА ПРИ РАЗЛИЧНЫХ СПОСОБАХ ВВЕДЕНИЯ
Аннотация
В статье приведены результаты изучения распределения гентамицина в органах и тканях кролика в сравнительном аспекте при различных методах введения, а также некоторых особенностей связывания антибиотика в этих органах. Экспериментально установлено, что при ингаляционном введении гентамицина сульфата легкие обеспечиваются высокими концентрациями антибиотика, при этом уменьшение выводимого гентамицина с мочой при ингаляционном способе введения свидетельствует о задержке препарата в организме и его депонировании, а постепенное всасывание антибиотика в кровь обеспечивает его пролонгирующее действие.
Ключевые слова: антимикробная терапия, гентамицин, животные, аэрозоль
Ter-Avetisyants I.A. 1, Semenenko M.P.2, Kuzminova E.V.3, Miroshnichenko P.V.4
1ORCID: 0000-0001-8271-4418, PhD in Biology, 2ORCID: 0000-0001-8266-5900, PhD in Veterinary Medicine and Science, 3ORCID: 0000-0003-4744-0823, PhD in Veterinary Medicine and Science, 4ORCID: 0000-0002-5835-1159, PhD in Veterinary Medicine and Science, FSBSI Krasnodar Research Veterinary Institute
CONCENTRATION OF THE ANTIBIOTIC GENTAMICIN IN ORGANS AND TISSUES OF A RABBIT IN DIFFERENT WAYS OF NTRODUCTION
Abstract
The article presents the results of a study of gentamicin distribution in organs and tissues of a rabbit in the comparative aspect with different methods of introduction and some features of the antibiotic binding to these organs. It was experimentally established that with inhalation introduction of gentamicin sulphate lungs are provided with a high concentrations of antibiotic, at the same time a decrease of introduced gentamicin with urine by inhalation way of introduction indicates the delay of the preparation in the body and its deposition, and the gradual absorption of the antibiotic in the blood ensures its prolonged action.
Keywords: antimicrobial therapy, gentamicin, animals, aerosol
Одной из многочисленных групп лекарственных веществ, применяемых в клинической практике, на сегодняшний момент являются антибактериальные препараты, среди которых на первом месте стоят антибиотики.
За последние десятилетия открыты тысячи антибиотиков с различным спектром действия. Успешное развитие биологии, химии, фармакологии позволило не только расшифровать строение многих антибиотиков, но и раскрыть механизмы их действия на молекулярном уровне, а также найти пути их химического превращения в сторону повышения фармакологической активности [8].
Накопленный в нашей стране и во все мире огромный опыт применения антибиотиков и лекарственных средств, изготовленных на их основе, позволил пересмотреть принципы их назначения для более эффективного использования в клинической практике. Однако применение антибактериальных препаратов обуславливает необходимость разработки схем рациональной антибиотикотерапии с учетом индивидуальных особенностей больного, течения заболевания, характера возбудителя и свойств препарата [7].
Причем, при антибиотикотерапии большое значение имеет метод введения лекарственного вещества. Многие ученые отмечают явное преимущество в применении лечебных средств методом аэрозольной терапии, при которой всасывание компонентов препарата оказывается в двадцать раз эффективнее, а расход уменьшается в четыре раза при увеличении сроков сохранения антибиотиков в высоких концентрациях в крови и легких. При этом происходит увеличение активной поверхности лекарственного средства и его депонирование в подслизистом слое, богатом кровеносными и лимфатическими сосудами.
Аэрозольные препараты, и в частности, применяемые аэрозольно антибиотики, поступая в дыхательные пути и легкие, минуют печень, быстро всасываясь в кровь и лимфу, накапливаются там и воздействуют непосредственно на пораженные участки легочной ткани [1].
Поэтому аэрозольные лекарственные препараты особенно эффективны для лечения и профилактики респираторных болезней, так как в этом случае их вводят тем же путем, по которому возбудители обычно попадают в организм животных. При этом в процессе распыления частицы приобретают скорость. Крупные частицы одновременно двигаются и быстро оседают под действием силы тяжести на стенках верхних дыхательных путей. Мелкие частицы гораздо быстрее тормозятся сопротивлением воздуха, скорость их движения снижается, они как бы зависают в потоке вдыхаемого воздуха и движутся с этим потоком, медленно оседая под действием силы тяжести. Скорость движения воздуха в верхних дыхательных путях выше, что препятствует оседанию мелких частиц. Лишь попав в нижние отделы бронхов, поток воздуха замедляется и становится ламинарным, что способствует оседанию мелких частиц [2].
Образующееся в легких депо антимикробного препарата обеспечивает постепенное всасывание в кровь. Терапевтические концентрации сохраняются в организме в течение 24 часов, а при других способах введения аналогичных доз – только на протяжении 6–12 часов. Это позволяет сократить кратность лечебных обработок до одного раза в сутки и, к тому же, избежать болевых ощущений, характерных для парентерального введения лекарственных средств [4,5].
Одним из антибиотиков, применяемых в ветеринарии при аэрозольной терапии, является гентамицин. Его хорошая растворимость в воде и высокая стабильность водных растворов, способность накапливаться в легких при ингаляционном введении, широкий спектр действия, активность в отношении микроорганизмов, устойчивых к другим антибиотикам – ставят гентамицин в особое положение среди ингаляционных антимикробных препаратов [6,7,9].
При этом плохая всасываемость гентамицина из дыхательного тракта дает возможность применять его ингаляционно в довольно высоких дозах.
Целью исследований было изучение распределения гентамицина в органах и тканях животных в сравнительном аспекте при различных методах введения, а также некоторых особенностей связывания антибиотика в этих органах.
Опыты проводили на 20 кроликах породы шиншилла 7–9 месячного возраста с массой тела 2,0-3,0 кг, разделенных на две группы по 10 голов.
Поскольку в медицинской и ветеринарной практике чаще используют гентамицина сульфат, включающий, помимо С1 и С2 гентамицинов С10 гентамицин, для опытов использовали раствор гентамицина для инъекций в ампулах по 2 мл, содержащих 40 мг активно действующей субстанции. Аэрозоль гентамицина получали при помощи ингаляционного аппарата АИ-1.
Первой группе кроликов гентамицина сульфат вводили ингаляционным способом в дозе 1500 мг/м3, второй – путем внутримышечного введения в дозе 4 мг/кг массы, примерно соответствующей ингалируемой дозе. Животных забивали через час и изучали распределение антибиотика в органах и тканях методом диффузии в агар [7].
Для определения антибиотика, связанного с белками и другими компонентами тканей, применялся метод предварительной обработки органов и тканей протеолитическим ферментом, предложенный Даниеловой Л.Т. [3] и разработанный нами в отношении гентамицина.
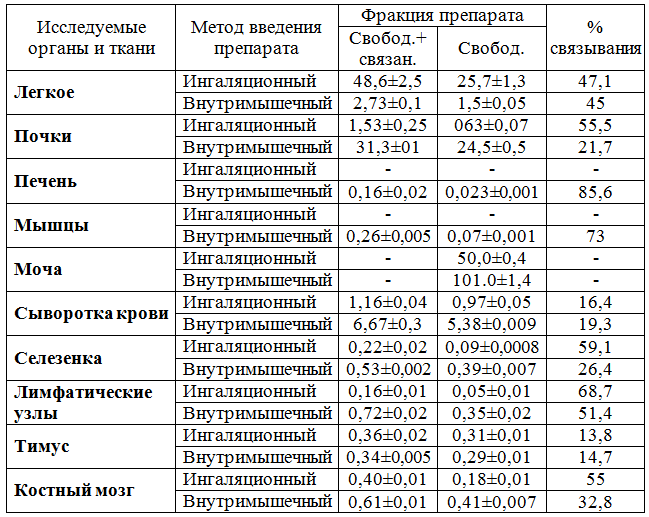
Как видно из таблицы, при аэрозольном введении наибольшую концентрацию антибиотика обнаруживали в легких – 48,6 мкг/г, в отличие от внутримышечного введения, при котором содержание гентамицина составило всего 2,73 мкг/г. Однако процент связывания с тканью легкого был почти одинаков в обеих группах и равнялся 47% и 45% соответственно.
Поскольку гентамицин из организма выводится, в основном, почками, то закономерно, что наибольшая его концентрация при внутримышечном введении обнаружена в почках – 31,3 мкг/г.
Таблица – Распределение и связывание гентамицина сульфат в органах и тканях при различных методах введении (мкг/г, мкг/мл)
В то же время концентрация антибиотика в почках при аэрозольном введении была более чем в 20 раз меньше, составляя 1,53 мкг/г. И это является важным моментом исследования, поскольку в высоких дозах гентамицин обладает нефротоксическим действием [7]. В нашем случае, препарат, проходя через стенки альвеол и бронхов, попадает в капилляры, затем с током крови поступает в левые отделы сердца и, по артериальным сосудам, доставляется к органам, в том числе, почкам. Поэтому, несмотря на его невысокую концентрацию, при ингаляционном введении процент связывания гентамицина с клетками почечной ткани оказывается в 2,5 раза больше, чем при внутримышечном введении (55,5% против 21,7% соответственно).
При внутримышечном введении антибиотик быстрее (в 2 раза) и в больших количествах (101 мкг/мл) выводился из организма с мочой, чем при аэрозольном (50 мкг/мл).
В печени при ингаляционном введении гентамицин не выявлялся, а при внутримышечном введении его концентрация была невысокой – всего 0,16 мкг/г, однако большая его часть 85,6% была представлена в связанном виде.
В мышцах гентамицин при ингаляционном введении отсутствовал. При внутримышечном введении его концентрация составляла 0,26 мкг/г, из которых 73% антибиотика было связано с этой тканью.
В сыворотке крови при внутримышечном введении концентрация антибиотика была достаточно высокой (6,67±0,3 мкг/г), превышая более чем в 5,5 раза концентрацию гентамицина, введенного аэрозольным методом. Однако процент связывания препарата был практически одинаков, составляя соответственно 19,3% и 16,4%. Различия по группам составили 2,9% в пользу внутримышечного способа введения.
Необходимо отметить, что низкая концентрация гентамицина в сыворотке крови и в почках при ингаляционном введении в период максимального содержания антибиотика в организме может снижать, в некоторой степени, его нефро- и ототоксическое действие [7].
Общая концентрация антибиотика в селезенке, костном мозге и лимфатических узлах при внутримышечном введении была выше в сравнении с ингаляционным методом соответственно в 2,4; 1,5 и 4,5 раза. В отличие от выше перечисленных органов, в тимусе общая концентрация гентамицина оказалась одинаковой – 0,34 мкг/г и 0,36 мкг/г при близком проценте связывания (13,8% и 14,7% соответственно). Однако несмотря на высокую концентрацию гентамицина в органах лимфоидной системы процент связанного антибиотика при ингаляционном введении оказался большим, чем при внутримышечном. Так, в селезенке при внутримышечном введении связанным оказалось 26,4% гентамицина, при ингаляционном – 59,1%, в костном мозге и лимфатических узлах – соответственно 32,8% и 55%; 51,4% и 68,7%.
Анализируя приведенные результаты, можно сделать следующие заключения:
- При ингаляционном введении гентамицина сульфата легкие обеспечиваются высокими концентрациями антибиотика, что при заболеваниях дыхательных путей является более эффективным способом терапии, чем внутримышечное введение.
- Снижение концентрации гентамицина в органах лимфоидно-кроветворной системы при ингаляционном методе введения, вероятно, происходит за счет слабого проникновения антибиотика в эти органы, в связи с низкой концентрацией его в сыворотке крови. Однако низкие концентрации антибиотика в лимфоидно-кроветворной системе при ингаляции, возможно, минимизируют его иммунодепрессивное влияние.
- Небольшие концентрации гентамицина в почках при ингаляционном методе введения снижают токсическое действие антибиотика на этот орган.
- Уменьшение выводимого гентамицина с мочой при ингаляционном способе введения свидетельствует о задержке препарата в организме и его депонировании, а постепенное всасывание антибиотика в кровь обеспечивает его пролонгирующее действие.
Литература
- Бессарабов Б.Ф., Полянинов В.Ю. Перспективные направления использования аэрозолей в птицеводстве //Ветеринария с-х животных. 2006. №6. С.72-73.
- Бучинский С.Н. Преимущества современной ингаляционной терапии [Электронный ресурс] URL: http://www.medafarm.ru (дата обращения 18.12.2015).
- Даниелова Л.Т. К проблеме остаточных количеств антибиотиков в органах, тканях и биологических жидкостях и методы их определения: Автореф. дис. докт. биол. наук. – Ереван. –1972.
- Киселенко П.С. Групповые аэрозольные методы лечения и профилактики неспецифической бронхопневмонии телят. Методические указания. Благовещенск. 2001.19 с.
- Литвин В.П., Полiщук В.В., Полiщук О.В. Аерозольний метод груповоi профiлактики й лiкування iнфекцiйних хвороб твари. Науковий свiт.-2001. С.17-18.
- Методические указания по применению аэрозолетерапии при респираторных болезнях молодняка /Антипов В.А., Трошин А.Н., Зуев Н.П., Хмыров А.В. и др. //Краснодар. 2015. 13 с.
- Навашин С.М., Фомина И.П. Рациональная антибиотикотерапия. – М.: Медицина, 1982. – 496 с.
- Рациональное использование лекарственных препаратов в ветеринарии /Е. Тяпкина, Л. Хахов, М. Семененко, Е. Кузьминова, В. Антипов, А. Трошин, А. Ферсунин //Краснодар. 57 с.
- Wretlind B., Nord C.E., Wadstrom T. Scand. J. Infekt. Dis. – 1974. – v.6/ - p.49-52.
References
- Bessarabov B.F., Poljaninov V.Ju. Perspektivnye napravlenija ispol'zovanija ajerozolej v pticevodstve //Veterinarija s-h zhivotnyh. 2006. №6. S.72-73.
- Buchinskij S.N. Preimushhestva sovremennoj ingaljacionnoj terapii [Jelektronnyj resurs] URL: http://www.medafarm.ru (data obrashhenija 18.12.2015).
- Danielova L.T. K probleme ostatochnyh kolichestv antibiotikov v organah, tkanjah i biologicheskih zhidkostjah i metody ih opredelenija: Avtoref. dis. dokt. biol. nauk. – Erevan. –1972.
- Kiselenko P.S. Gruppovye ajerozol'nye metody lechenija i profilaktiki nespecificheskoj bronhopnevmonii teljat. Metodicheskie ukazanija. Blagoveshhensk. 2001.19 s.
- Litvin V.P., Polishhuk V.V., Polishhuk O.V. Aerozol'nij metod grupovoi profilaktiki j likuvannja infekcijnih hvorob tvari. Naukovij svit.-2001. S.17-18.
- Metodicheskie ukazanija po primeneniju ajerozoleterapii pri respiratornyh boleznjah molodnjaka /Antipov V.A., Troshin A.N., Zuev N.P., Hmyrov A.V. i dr. //Krasnodar. 2015. 13 s.
- Navashin S.M., Fomina I.P. Racional'naja antibiotikoterapija. – M.: Medicina, 1982. – 496 s.
- Racional'noe ispol'zovanie lekarstvennyh preparatov v veterinarii /E. Tjapkina, L. Hahov, M. Semenenko, E. Kuz'minova, V. Antipov, A. Troshin, A. Fersunin //Krasnodar. 2014. 57 s.
- Wretlind B., Nord C.E., Wadstrom T. Scand. J. Infekt. Dis. – 1974. – v.6/ - p.49-52.