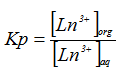ION FLOTATION OF Y(+3), Er(+3) и Yb(+3)
Лобачева О.Л.1, Берлинский И.В.2, Мкртчян А.А.3, Мисник А.В.
1 Кандидат химических наук, 2 Кандидат химических наук, 3 Студент, 4 Студент, Национальный минерально-сырьевой университет «Горный»
ИОННАЯ ФЛОТАЦИЯ Y3+, Er3+, Yb3+
Аннотация
Экспериментальные результаты и термодинамическое исследование ионной флотации из Y(+3), Er(+3) и Yb(+3) в водных системах с поверхностно-активные вещества представлены. Коэффициенты распределения редкоземельных элементов в процессе ионной флотации были определены. Было показано, если рН = 5,5 – Y(+3) селективно извлекается, рН = 6,4 - Er(+3) селективно удаляется из раствора и рН > 8,0 - Yb(+3) извлекается из растворов азотнокислых солей. Представлены результаты экспериментального и теоретического исследования процесса ионной флотации в растворах нитратов иттрия, эрбия, иттербия и додецилсульфата натрия, используемого в качестве флотореагента. Получены зависимости коэффициентов распределения ионов редкоземельных элементов в процессе ионной флотации от рН равновесной водной фазы. Было установлено, что в процессе ионной флотации наблюдается тенденция к увеличению коэффициента распределения при значениях рН максимального извлечения с порядковым номером лантаноидов. Значительный рост коэффициента распределения в 2 – 4 раза происходит при переходе к эрбию и иттербию. В итоге, при различных рН среды в процессе ионного обмена происходит изменение механизма взаимодействия катиона металла и додецилсульфат иона.
Ключевые слова: редкоземельные металлы, поверхностно-активные вещества, ионная флотация, термодинамические характеристики флотационного процесса.
Lobacheva O.L.1, Berlinskii I.V.2, Mkrtchyan A.A.3, Misnik A.V.4
1 PhD in Chemistry, 2 PhD in Chemistry, 3 Student, 4 Student, National Mineral Resources University (Mining University)
ION FLOTATION OF Y3+, Er3+, Yb3+
Abstract
The experimental results and thermodynamic investigation of the ion flotation of Y(+3), Er(+3) and Yb(+3) in aqueous systems with surface active substance are presented. Distribution coefficients of rare-earth elements in the approach of ion flotation were determined. It was shown, if pH = 5,5 – Y (+3) is removed, pH = 6,4 - Er(+3) is selectively removed and pH > 8,0 - Yb(+3) is extracted from solutions of nitrate salts by sodium dodecylsulfate.
The dependences of the distribution coefficients of ions of rare earth elements in the ion flotation approach from the equilibrium pH of the aqueous phase were stated. It was found that in the process of ion flotation is observed a tendency of increase of the distribution coefficient at the pH of maximum removal with a serial number of the lanthanides. A significant increase of the distribution coefficient in 2 – 4 times occurs during the transition to erbium and ytterbium. In the end, at different pH of the medium in the ion exchange processes there is a change of the mechanism of interaction of the metal cation and dodecyl sulfate ion.
Keywords: surface-active substances, rare-earth elements, ion flotation, thermodynamic data of the flotation approach.
Адсорбционно-пузырьковые методы разделения веществ широко используются в настоящее время для извлечения и разделения ионов редкоземельных металлов (РЗМ) [1,2]. Руда перерабатывается, для производства концентратов, содержащих 60-80% смешанных РЗМ в виде оксидов, в основном, с использованием флотационной технологии.
Ионная флотация основана на притяжении извлекаемого иона противоположно заряженными ионами собирателя, закрепившимися на поверхности барботируемых через объем раствора пузырьков воздуха или газа. Для извлечения катионов применяются анионные, для анионов - катионные собиратели. Между полярной группой собирателя и ионом действуют электростатические силы притяжения или связи, характерные для координационных соединений.
Возможны два механизма ионной флотации: адсорбционный (концентрирование сублата на поверхности пузырьков происходит в результате адсорбции) и адгезионный (сублат образует осадок - новую фазу, частицы которой прилипают к всплывающим пузырькам). В случае адсорбционного механизма раствор после введения собирателя остаётся гомогенным, а при адгезионном становится гетерогенной двухфазной системой. По кинетическим возможностям для промышленного использования предпочтительнее адгезионный механизм ионной флотации, при котором извлечение на уровне 90-99% может быть достигнуто за время от долей минуты до несколько минут. Поэтому в качестве реагентов-собирателей целесообразно использовать поверхностно-активные вещества (ПАВ), образующие труднорастворимые соединения. Адсорбционная ионная флотация при определенных условиях может протекать с образованием самостоятельной поверхностной фазы, существующей только на границе газ-жидкость.
Ионную флотацию осуществляют во флотационных машинах (пневмомеханические, пневматические и др.), сконструированных с учётом особенностей этого процесса. Ионную флотацию целесообразно применять при исходных концентрациях компонента в интервале 10-5-10-2 моль/л, т.к. при больших концентрациях слишком большой объёмный выход пенного продукта, а при меньших - велики стоимость потерь ПАВ с отработанными растворами и затраты на очистку последних. Характерные особенности ионной флотации (эффективность при относительно низких исходных концентрациях металла, высокая скорость процесса и др.) определяют перспективные направления промышленного использования этого процесса. Ионная флотация является полупромышленным способом для извлечения молибдена, вольфрама, скандия, рения, золота и др., выделение металлов из относительно бедных растворов (десятки-сотни мг/л) с целью извлечения основного металла и элементов-спутников, присутствующих в руде в небольших количествах.
В настоящее время методы поверхностного разделения веществ широко используются для извлечения и разделения ионов редкоземельных металлов. Кроме того, для производства концентратов, содержащих 60-70% смешанных РЗЭ в виде оксидов, добываемая руда перерабатывается в основном с использованием флотационной технологии. Для извлечения и разделения РЗЭ и очистки их от примесей применяют осадительные методы, селективное окисление или восстановление, ионообменную сорбцию и жидкостную экстракцию. Недостатки этих методов привели к использованию извлечения и разделения РЗЭ методом ионной флотации и поиск новых поверхностно-активных веществ в качестве собирателей.
В работе использовали поверхностно-активное вещество - представляющее собой молекулы с ионогенной функциональной группой и органическим радикалом с большим числом атомов углерода – додецилсульфат натрия (NaDS). В процессе флотации ПАВ взаимодействует с неорганическим ионом (катионом металла) и, образующийся сублат удаляется из раствора вместе с пеной.
В работе изучали раcпределение ионов редкоземельных элементов иттриевой группы – Y3+, Er3+, Yb3+ в системах «водный раствор – пена», образованных модельными растворами нитратов их солей и додецилсульфатом натрия [3].
Исследовалась зависимость коэффициента распределения (Kp) редкоземельных элементов для наиболее полного извлечения между водной и органической фазами от рН раствора. В качестве модельных использовались водные растворы нитратов Y(3+), Er(3+), Yb(3+) с концентрацией 0,001 моль/кг, в качестве собирателя – NaDS, концентрация которого соответствует реакции: Ln3++ 3 DS- = Ln(DS)3, т.е. 0,003 моль/кг, (Ln3+ – катион металла, DS-- додецилсульфат-ион). рН раствора устанавливали с помощью растворов азотной кислоты или гидроксида натрия. Объем исследуемого раствора варьировался от 100 до 200 мл.
Процесс ионной флотации проводили в течение 10 минут в специальном аппарате - лабораторной машине механического типа В-ФЛ 137 с объемом камеры 1,0 дм3. Разрушение отобранной пены проводили с помощью 30 мл раствора серной кислоты с концентрацией -1 моль/кг. Пенный продукт и раствор, оставшийся в кювете после процесса флотации, анализировали на содержание катиона металла [4].
Kp - коэффициент распределения иона исследуемого раствора металла между водной и органической фазами рассчитывали по отношению концентрации [Ln3+](Y3+, Er3+, Yb3+) в пене к концентрации [Ln3+] в остатке соответственно:
Содержание NaDS в камерном остатке и в пене определялось потенциометрическим титрованием с использованием ионоселективного электрода, изготовленного на кафедре физической химии Санкт-Петербургского государственного университета [5]. В качестве титранта использовали раствор цетилтриметиламмония хлорида концентрацией 0,002 моль/кг.
Экспериментальные данные (Рис. 1 - 3) в процессе ионной флотации по зависимости Kp редкоземельных элементов от значения рН раствора свидетельствуют о том, что в кислой среде извлечение РЗЭ практически не наблюдается.
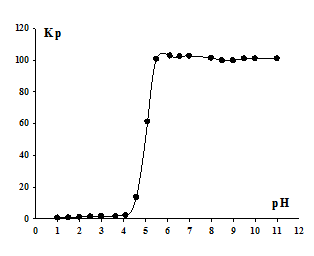
Рис. 1. - Зависимость коэффициента распределения Кр ионов Y3+ от рН раствора.
Из рисунка 1 видно, что извлечение ионов Y3+ начинается при рН = 5,5. Максимальное извлечение достигается при рН = 6,1. Это значение ниже полученной величины рН комплексообразования 6,3, что свидетельствует о флотации ионов иттрия в форме среднего додецилсульфата Y(C12H25OSO3)3.
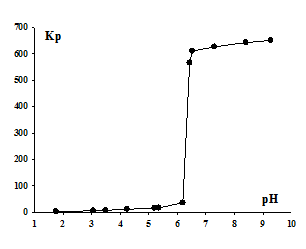
Из полученных экспериментальных данных (Рис.2) видно, что значение рН, при котором наблюдается резкое увеличение Kp, равное 6,3, ниже рН гидратообразования 6,4. Величина рН образования гидроксокомплексов Er(OH)2+ и Er(OH)2+ в соотношении 1:1 составляет 6,25. Отсюда можно заключить, что эрбий флотируется в виде смеси основных додецилсульфатов, причем в области максимального извлечения преимущественно в форме Er(OH)2(C12H25OSO3). Следует отметить, что флотация дигидроксокатионов протекает с Kp более 650, так как требует присоединения только одного аниона додецилсульфата к извлекаемому иону.
Рис. 2. - Зависимость коэффициента распределения Кр ионов Er3+ от рН раствора.
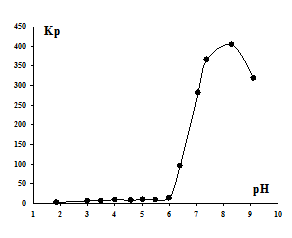
Ионная флотация ионов иттербия (Рис.3) показывает, что в кислых средах извлечение Yb3+ незначительное. При повышении рН начинается процесс флотации, и Kp резко возрастает. Значение рН, при котором начинается резкое увеличение Kp, равно 6,2 и соответствует по ранее выполненным данным кондуктометрического титрования рН½ образования дигидроксокомплекса иттербия. На этом основании можно предположить, что иттербий так же, как и эрбий, флотируется преимущественно в форме основного додецилсульфата дигидроксоиттербия Yb(OH)2(C12H25OSO3). При этом достигается Kp более 400, превышающий соответствующие значения при флотации моногидроксокатионов церия, европия и самария [6].
Рис. 3. - Зависимость коэффициента распределения Кр ионов Yb3+ от рН раствора.
Выводы: В процессе флотации ионы лантаноидов (Y3+, Er3+, Yb3+) извлекаются додецилсульфатом натрия в форме средних и основных додецилсульфатов (Ln(C12H25OSO3)3 и Ln(OH)(C12H25OSO3)2). В растворах редкоземельных элементов при рН = 5,5 возможно селективное извлечение Y3+, при рН = 6,4 – эрбия (3+) и при рН > 8,0 – иттербия (3+) из растворов их солей с применением NaDS в качестве собирателя в процессе ионной флотации. Наблюдается тенденция к увеличению коэффициента распределения при значениях рН максимального извлечения с порядковым номером лантаноидов. Значительный рост коэффициента распределения в 2 – 4 раза происходит при переходе к эрбию и иттербию. Это можно объяснить изменением механизма процесса, при котором требуется присоединение не двух, а только одного аниона додецилсульфата.
Литература
- Grieves R.B., Charewicz W.R. // Journal of the Separation Science. 1975. Vol. 10. N 1. pp. 77-92.
- Adsorptive bubble separation techniques / R.Lemlich. 1972. Academic Press. N-Y., London. pp 53-59.
- Chirkst D.E., Lobacheva O.L., Berlinskii I.V., Sulimova M.A. Recovery and separation of Ce3+ and Y3+ ions from aqueous solutions by ion flotation // Russian Journal of Applied Chemistry. - 2009. - №82 (8). - pp. 1370-1374.
- Саввин C.Б. Арсеназо III. – М: Атомиздат. 1966. 265 c.
- Тимофеев С.В., Матерова В.А., Архангельский Л.К. // Вестник ЛГУ. Серия физика, химия. - 1978. - № 16. - Вып. 3. - С. 139-141.
- Chirkst D.E., Lobacheva O.L., Berlinskii I.V., Sulimova M.A. The thermodynamic properties of hydroxo compounds and the mechanism of ion flotation for cerium, europium, and yttrium // Russian Journal of Physical Chemistry. - 2009. - №83 (12). - pp. 2022-2027.
References
- Grieves R.B., Charewicz W.R. // Journal of the Separation Science. 1975. Vol. 10. N 1. pp. 77-92.
- Adsorptive bubble separation techniques / R.Lemlich. 1972. Academic Press. N-Y., London. pp 53-59.
- Chirkst D.E., Lobacheva O.L., Berlinskii I.V., Sulimova M.A. Recovery and separation of Ce3+ and Y3+ ions from aqueous solutions by ion flotation // Russian Journal of Applied Chemistry. - 2009. - №82 (8). - pp. 1370-1374.
- Savvin S.B. Arsenazo III. – M: Atomizdat. 1966. 265 s.
- Timofeev S.V., Materova V.A., Arhangel'skij L.K. // Vestnik LGU. Serija fizika, himija. - 1978. - № 16. - Vyp. 3. - S. 139-141.
- Chirkst D.E., Lobacheva O.L., Berlinskii I.V., Sulimova M.A. The thermodynamic properties of hydroxo compounds and the mechanism of ion flotation for cerium, europium, and yttrium // Russian Journal of Physical Chemistry. - 2009. - №83 (12). - pp. 2022-2027.