ИНКРЕТИНОМИМЕТИКИ: ВЗГЛЯД НА ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ
Андреева Е.И.1, Унанова И.А.2, Андреева Е.А.3
1Кандидат медицинских наук, доцент, 2ассистент, 3аспирант, Ставропольский государственный медицинский университет.
ИНКРЕТИНОМИМЕТИКИ: ВЗГЛЯД НА ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ
Аннотация
В статье рассмотрена и сравнена сахароснижающая эффективность двух групп препаратов бигуанидов и инкретиномиметиков, а также их влияние на индекс массы тела (ИМТ), Оценивалась вероятности развития одного из возможных побочных эффектов - острого панкреатита. При достоверной доказательности эффективности препаратов инкретиномиметиков, в частности эксенатида, положительного его влияние на уменьшение ИМТ, а также минимальную вероятность развития острого панкреатита, позволит наиболее широко применять препарат данной группы с целью эффективного и безопасного контроля над сахарным диабетом 2 типа на фоне ожирения.
Ключевые слова: сахарный диабет, ожирение, гликированный гемоглобин, амилаза, панкреатит.
Andreeva E.I.1, Unanova I.A. 2, Andreeva E.A.3
1MD, 2assistent, 3aspirant, Stavropol State Medical University.
INKRETINOMIMETIKS: LOOK AT THE EFFICACY AND SAFETY
Abstract
The article examined and compared the performance of two groups of hypoglycemic drugs and inkretinomimetikov biguanide, as well as their impact on the body mass index (BMI), to evaluate the likelihood of one of the possible side effects - acute pancreatitis. When credible evidence of efficacy inkretinomimetikov particularly exenatide, its positive impact on the reduction of BMI and the lowest probability of acute pancreatitis, will allow the most widely used in the preparation of this group for the purpose of effective and safe control of type 2 diabetes by obesity.
Keywords: diabetes, obesity, glycated hemoglobin, amylase, pancreatitis.
ВведениеНа сегодняшний день, ожирение представляет одну из самых социально-значимых проблем, которая является предиктором множества серьёзных заболеваний, таких как сердечно - сосудистая, гастроэнтерологическая патологии, а также прокладывает прямой путь к развитию сахарного диабета 2 типа. В свою очередь, сахарный диабет второго типа(СД 2 типа), складывается из двух составляющих: первая- это, несомненно, инсулинорезистентность ( снижение периферической чувствительности к инсулину), и вторая- снижение объёма и функции b-клетки, приводящие к снижению синтеза инсулина. Ввиду того, что основные патогенетические аспекты развития СД 2 типа давно известны, длительное время стоял вопрос выбора терапии, которая могла бы перекрыть весь патогенетический континуум.
Единственным классом сахароснижающих препаратов, который, помимо эффективной коррекции гипергликемии, способствует снижению веса, являются миметики инкретинов. Однако длительное время миметики инкретинов были зарегистрированы только в качестве терапии второго ряда выбора в комбинации с другими пероральными сахароснижающими средствами (ПСС).
С ноября 2009 г. в мире и с июля 2010 г. в России первый препарат этого класса – эксенатид (Баета) одобрен к применению в монотерапии СД2 в сочетании с диетой и физической активностью.[ 20]
Инкретины - это гормоны желудочно-кишечного тракта, вызывающие стимуляцию секреции инсулина после приема глюкозы внутрь. Elrick и соавт. [1] и McIntyre и соавт. [2] в 1964 г. показали, что инсулиновый ответ на пероральный прием глюкозы значительно превышает таковой после ее внутривенного введения. В настоящее время стало известно, что этот эффект связан с секрецией инкретинов, наиболее мощным из которых, является глюкагоноподобный пептид-1 (ГПП-1) [3].
Инсулинотропное действие ГПП-1 осуществляется при взаимодействии со специфическим рецептором на мембране b-клеток поджелудочной железы. Результатом последовательных пострецепторных реакций становится повышение содержания ионов кальция в цитоплазме b-клеток и экзоцитоз инсулинсодержащих гранул [6,7]. Именно за счет данного рецепторопосредованного механизма реализуется до 70% суммарного инсулинотропного действия ГПП-1. Однако ГПП-1 воздействует и на другие звенья биосинтеза инсулина. Так, ГПП-1 регулирует ген проинсулина [8] и внутриклеточных транспортеров глюкозы-глюкокиназы и GLUT2 [9], а также активирует PDX-1 - ключевой фактор роста панкреатических островков и транскрипции гена инсулина [9].
ГПП-1 подавляет секрецию глюкагона, что особенно важно для коррекции постпрандиальной гипергликемии вследствие парадоксального повышения продукции глюкагона в ответ на прием пищи при СД типа 2 [14].
Присутствие рецепторов ГПП в ряде тканей определяет и его внепанкреатическое действие. Установлено, что этот пептид замедляет эвакуацию пищи из желудка [16] и, следовательно, способствует снижению постпрандиальных пиков концентрации глюкозы, а также подавляет аппетит [17] и снижает потребление пищи как у здоровых людей, так и у больных СД типа 2 [18]. В ряде исследований ГПП-1 вызывал уменьшение массы тела у больных СД 2 типа и ожирением. [19].
Согласно информации Медицинского Агентства Великобритании (MHRA), к февралю 2009 года было зарегистрировано 9 сообщений о панкреатите, развивавшемся при применении эксенатида. К настоящему времени препарат был назначен приблизительно 800 000 пациентам во всем мире. К сентябрю 2008 года во всем мире было зарегистрировано 396 сообщений о случаях развития панкреатита, 80% из которых трактовались как «возможные» по степени достоверности причинно-следственной связи. В нескольких сообщениях отмечалось возобновление НПР при повторном назначении препарата. Во всем мире выявлено 9 случаев развития некротического или геморрагического панкреатита, 2 из них со смертельным исходом. Информация об этих НПР была внесена в инструкцию по применению Баеты.
Цель исследования
Оценить сахароснижающее действие эксенатида по сравнению с метформином, а также выявить вероятность развития панкреатита у пациентов получающих в качестве базовой сахароснижающей терапии эксенатид.
Материалы и методы
Было проведено контролируемое исследование, в котором приняло участие 67 пациентов с ожирением и сахарным диабетом 2 типа, разделённые на 2 группы. Первую группу составили 33 пациента, в их числе 14 мужчин и 19 женщин, которые в качестве базисной терапии применяли эксенатид 5 мг п/к 2 раза в день, Возраст пациентов варьировал от 33 до 71 года (средний возраст -50 +6,91 лет), при этом средний возраст мужчин составил 48,6+6,7 лет, а средний возраст женщин 51 год +6,7. В состав второй группы вошло 34 человека : 15 мужчин и 19 женщин, получающие лечение в виде метформина в суточной дозе 2000 мг. Возрастные колебания этой группы составили от 29 до 68 лет (в среднем 48,9+6,1 лет), при этом средний возраст мужчин 50,8+7,04, женщин -47,5+5.
Всем пациентам до инициации сахароснижающей терапии определялся уровень гликированного гемоглобина , как объективный показатель углеводного обмена, а также лабораторным путём определялась амилаза сыворотки крови, являющаяся одним из наиболее изученных маркёров обострения панкреатита. Контрольные осмотры производились через 3 и 6 мес. от начала лечения. Так же, на всей протяжённости исследования пациенты вели дневник по выявлению жалоб обострения панкреатита, а именно, наличия тупой приступообразной эпигастральной боли, стеатореи, тошноты, рвоты.
Статистический анализ производился с использованием программ Exel, Biostat расчёт однофакторного дисперсного анализа.
Результаты и обсуждения
При обследовании пациентов до начала лечения в первой группе уровень гликированного гемоглобина среди мужчин составила в среднем 9,9 +2,0, а среди женщин 11,0+1,6 . Амилаза у мужчин в среднем 25,6+13,3 у женщин 33+12,5. Во второй группе средний показатель гликированного гемоглобина у мужчин составила 6,9+0,29 см, женщин-7,3+0,5, а амилаза 33,3+10,04 и 30,7+12,8 у мужчин и женщин соответственно.
При первом контрольном обследовании у всех пациентов первой группы имелась тенденция к снижению гликированного гемоглобина. У мужчин средний показатель достиг 8,7+1,6 см, р=0,643 статистически не значимым. Среди женщин средний уровень составил 9,5 + 1,2см, р=0,458 .Во второй группе, как у мужчин, так и у женщин степень снижения гликированного гемоглобина была менее стремительной по сравнению с первой группой 6,58+0,28 и 6,8+0,47 соответственно.
Показатели амилазы в первой группе. 19,7+1,4 и 30,6+13,1 среди мужчин и женщин соответственно. В группе пациентов получающих метформин усреднённые показатели амилазы среди мужчин составили 32,62+9,6, среди женщин -27,14+9,1.
Повторный контрольный осмотр, осуществлённый через 6 месяцев с момента старта терапии исследования, более наглядно продемонстрировал влияние эксенатида на углеводный обмен, а именно: HbA1c в группе применяемой эксенатид у мужчин в среднем составила 7,7+ 1,2, р=0,447, у женщин -8,5+ 0,8см, р=0,188. В то время как в группе с метформином 6,2+0,44 и 6,6+0,5 у мужчин и женщин соответственно. Амилаза изменялась следующим образом: 16,7+6,4 р=0,552 и 25,5+11,9 р=0,666 у мужчин и женщин получающих эксенатид. В группе применяемых метформин, никаких значительных изменений не отмечалось среди мужчин и женщин этот показатель остался на прежнем уровне-30,7+12,8 и 27,4+10,5.
В течении всего времени наблюдения за пациентами, не отмечалось ни одного случая возникновения острого панкреатита, уровень амилазы также у всех пациентов сохранялся в пределах допустимых значений.
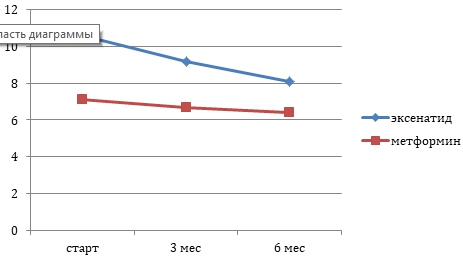
Рис №1 Суммарная ( мужчины и женщины) динамика гликированного гемоглобина у пациентов применяющих эксенатид и менформин.
Рис. 1
ВыводыТерапия эксенатидом продемонстрировала хороший сахароснижающий эффект, степень снижения глюкозы крови достоверно более значимая по сравнению с терапией метформином. Учитывая, что в течении периода наблюдения за пациентами не было зарегистрировано ни одного случая острого панкреатита, нельзя говорить о прямом влиянии эксенатида на развитие этого заболевания.
Литература
- Elrick H, Stimmler L, Hlad CJ, Turner DA. Plasma insulin responses to oral and intravenous glucose administration. J Clin Endocrinol Metab 1964; 24:1076-82.
- McIntryre N, Holdsworth CD, Turner DA. New interpretation of oral glucose tolerance. Lancet 1964; II: 20-1.
- Fehse FC, Trautmann ME, Holst JJ, Halseth AE et al. Exenatide augments first- and second-phase insulin secretion in response to intravenous glucose in subjects with type 2 diabetes. J Clin Endocrinol Metab 2005; 90: 5991-5997.
- Holst JJ, and Gromada J. Role of incretin hormones in the regulation of insulin secretion in diabetic and nondiabetic humans. AJP-Endo 2004; 287: 199-206.
- Nauck MA, Meier JJ. Glucagon-like peptide 1 and its derivatives in the treatment of diabetes. Regul Pept 2005; 128: 135-148.
- Fehmann HC and Habener JF. Insulinotropic hormone glucagon-like peptide-I(7-37) stimulation of proinsulin gene expression and proinsulin biosynthesis in insulinoma beta TC-1 cells. Endocrinology 1992; 130: 159-166.
- Buteau J, Roduit R, Susini S, Prentki M. Glucagon-like peptide-1 promotes DNA synthesis, activates phosphatidylinositol 3-kinase and increases transcription factor pancreatic and duodenal homeobox gene 1 (PDX-1) DNA binding activity in beta (INS-1)-cells. Diabetologia 1999; 42:856-64.
- Shah P, Vella A, Rizza RA. Glucagon physiology, pathophysiology and prospects of glucagons antagonists for the treatment of diabetes. Int Diabetes Monitor 2005; 17(6): 3-10.
- Wettergren A, Schjoldager B, Mortensen PE et al. Truncated GLP-1 (proglucagon 78-107-amide) inhibits gastric and pancreatic functions in man. Dig Dis Sci 1993; 38: 665-73.
- Naslund E, Barkeling B, King N et al. Energy intake and appetite are suppressed by glucagon-like peptide-1 (GLP-1) in obese men. Int J Obes Relat Metab Disord 1999; 23: 304-11.
- Gutzwiller JP, Drewe J, Goke B et al. Glucagon-like peptide-1 promotes satiety and reduces food intake in patients with diabetes mellitus type 2. Am J Physiol 1999; 276: R1541-4.
- Zander M, Madsbad S, Madsen JL, and Holst JJ. Effect of 6-week course of glucagon-like peptide 1 on glycaemic control, insulin sensivity, and beta-cell function in type 2 diabetes: a parallel-group study. Lancet 2002; 359:
- Викулова О.К. Шестакова М.В. Новые показания к терапии эксенатидом у больных сахарным диабетом 2 типа с ожрением. //Сахарный диабет 2010; №3.